HŲ░ß╗øng dß║½n giß║Żi b├Āi tß║Łp SGK Ho├Ī hß╗Źc 12 B├Āi 27 Nh├┤m v├Ā hß╗Żp chß║źt cß╗¦a nh├┤m gi├║p c├Īc em hß╗Źc sinh nß║»m vß╗»ng phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp v├Ā ├┤n luyß╗ćn tß╗æt kiß║┐n thß╗®c m├┤n ho├Ī.
-
B├Āi tß║Łp 1 trang 128 SGK H├│a hß╗Źc 12
Viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a c├Īc phß║Żn ß╗®ng thß╗▒c hiß╗ćn d├Ży chuyß╗ān ─æß╗Ģi sau:
\(Al \xrightarrow[ \ ]{ \ (1) \ } AlCl_{3}\xrightarrow[ \ ]{ \ (2) \ } Al(OH)_3\xrightarrow[ \ ]{ \ (3) \ } NaAlO_{2} \xrightarrow[ \ ]{ \ (4) \ } Al(OH)_{3} \xrightarrow[ \ ]{ \ (5) \ }\)\(Al_{2}O_{3} \xrightarrow[ \ ]{ \ (6) \ } Al\)
-
B├Āi tß║Łp 2 trang 128 SGK H├│a hß╗Źc 12
C├│ 2 lß╗Ź kh├┤ng ghi nh├Żn ─æß╗▒ng dung dß╗ŗch AlCl3 v├Ā dung dß╗ŗch NaOH. Kh├┤ng d├╣ng th├¬m chß║źt n├Āo kh├Īc, l├Ām thß║┐ n├Āo ─æß╗ā nhß║Łn biß║┐t mß╗Śi chß║źt?
-
B├Āi tß║Łp 3 trang 128 SGK H├│a hß╗Źc 12
Ph├Īt biß╗āu n├Āo sau ─æ├óy l├Ā ─æ├║ng?
A. Nh├┤m l├Ā 1 kim loß║Īi lŲ░ß╗Īng t├Łnh.
B. Al(OH)3 l├Ā mß╗Öt bazŲĪ lŲ░ß╗Īng t├Łnh.
C. Al2O3 l├Ā mß╗Öt oxit trung t├Łnh.
D. Al(OH)3 l├Ā mß╗Öt hi─æroxxit lŲ░ß╗Īng t├Łnh.
-
B├Āi tß║Łp 4 trang 129 SGK H├│a hß╗Źc 12
Trong nhß╗»ng chß║źt sau, chß║źt n├Āo kh├┤ng c├│ t├Łnh lŲ░ß╗Īng t├Łnh?
A. Al(OH)3
B. Al2O3
C. ZnSO4
D. NaHCO3
-
B├Āi tß║Łp 5 trang 129 SGK H├│a hß╗Źc 12
Cho mß╗Öt lŲ░ß╗Żng hß╗Śn hß╗Żp Mg ŌĆō Al t├Īc dß╗źng vß╗øi dung dß╗ŗch HCl dŲ░ thu ─æŲ░ß╗Żc 8,96 l├Łt H2. Mß║Ęt kh├Īc, cho lŲ░ß╗Żng hß╗Śn hß╗Żp nhŲ░ tr├¬n t├Īc dß╗źng vß╗øi dung dß╗ŗch NaOH dŲ░ th├¼ thu ─æŲ░ß╗Żc 6,72 l├Łt H2. C├Īc thß╗ā t├Łch kh├Ł ─æß╗üu ─æo ß╗¤ ─æktc. T├Łnh khß╗æi lŲ░ß╗Żng cß╗¦a mß╗Śi kim loß║Īi c├│ trong lŲ░ß╗Żng hß╗Śn hß╗Żp ─æ├Ż d├╣ng?
-
B├Āi tß║Łp 6 trang 129 SGK H├│a hß╗Źc 12
Cho 100 ml dung dß╗ŗch AlCl3 1M t├Īc dß╗źng vß╗øi 200 ml dung dß╗ŗch NaOH. Kß║┐t tß╗¦a tß║Īo th├Ānh ─æŲ░ß╗Żc l├Ām kh├┤ v├Ā nung ─æß║┐n khß╗æi lŲ░ß╗Żng kh├┤ng ─æß╗Ģi c├ón nß║Ęng 2,55 gam. T├Łnh nß╗ōng ─æß╗Ö mol cß╗¦a dung dß╗ŗch NaOH ban ─æß║¦u.
-
B├Āi tß║Łp 7 trang 129 SGK H├│a hß╗Źc 12
C├│ 4 mß║½u kim loß║Īi l├Ā Na, Al, Ca, Fe. Chß╗ē d├╣ng nŲ░ß╗øc l├Ām thuß╗æc thß╗Ł th├¼ sß╗æ kim loß║Īi c├│ thß╗ā ph├ón biß╗ćt ─æŲ░ß╗Żc tß╗æi ─æa l├Ā bao nhi├¬u?
A. 1.
B. 2.
C. 3.
D. 4.
-
B├Āi tß║Łp 8 trang 129 SGK H├│a hß╗Źc 12
─Éiß╗ćn ph├ón Al2O3 n├│ng chß║Ży vß╗øi d├▓ng ─æiß╗ćn cŲ░ß╗Øng ─æß╗Ö 9,65 A trong khoß║Żng thß╗Øi gian 3000 gi├óy, thu ─æŲ░ß╗Żc 2,16 gam Al. Hiß╗ću suß║źt cß╗¦a qu├Ī tr├¼nh ─æiß╗ćn ph├ón l├Ā:
A. 60%.
B. 70%.
C. 80%.
D. 90%.
-
B├Āi tß║Łp 1 trang 176 SGK H├│a 12 N├óng cao
Cho Al + HNO3 ŌåÆ Al(NO3)3 + NO + H2O, sß╗æ ph├ón tß╗Ł HNO3 bß╗ŗ Al khß╗Ł v├Ā sß╗æ ph├ón tß╗Ł HNO3 tß║Īo muß╗æi nitrat trong phß║Żn ß╗®ng l├Ā:
A. 1 v├Ā 3
B. 3 v├Ā 2
C. 4 v├Ā 3
D. 3 v├Ā 4
-
B├Āi tß║Łp 2 trang 167 SGK H├│a hß╗Źc 12 n├óng cao
Mß╗Öt pin ─æiß╗ćn h├│a ─æŲ░ß╗Żc cß║źu tß║Īo bß╗¤i c├Īc cß║Ęp oxi h├│a - khß╗Ł Al3+/Al v├Ā Cu2+/Cu. Phß║Żn ß╗®ng h├│a hß╗Źc xß║Ży ra khi pin hoß║Īt ─æß╗Öng l├Ā:
A. 2Al + 3Cu ŌåÆ 2Al3+ + 2Cu2+
B. 2Al3+ + 2Cu ŌåÆ 2Al + 3Cu2+
C. 2Al + 3Cu2+ ŌåÆ 2Al3+ + 3Cu
D. 2Al3+ + 3Cu2+ ŌåÆ 2Al3+ + 3Cu2+
-
B├Āi tß║Łp 3 trang 176 SGK H├│a hß╗Źc 12 n├óng cao
T├╣y thuß╗Öc nß╗ōng ─æß╗Ö cß╗¦a dung dß╗ŗch HNO3 kim loß║Īi nh├┤m c├│ thß╗ā khß╗Ł HNO3 th├Ānh NO2, NO, N2 hoß║Ęc NH4NO3. H├Ży viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a c├Īc phß║Żn ß╗®ng tr├¬n.
-
B├Āi tß║Łp 4 trang 176 SGK H├│a 12 N├óng cao
C├│ 4 kim loß║Īi l├Ā: Ca, Na, Fe v├Ā Al. H├Ży nhß║Łn biß║┐t mß╗Śi kim loß║Īi bß║▒ng phŲ░ŲĪng ph├Īp h├│a hß╗Źc v├Ā dß║½n ra nhß╗»ng phß║Żn ß╗®ng h├│a hß╗Źc ─æ├Ż d├╣ng.
-
B├Āi tß║Łp 5 trang 176 SGK H├│a 12 N├óng cao
Khß╗Ł ho├Ān to├Ān 16 gam bß╗Öt Fe2O3 bß║▒ng bß╗Öt nh├┤m. H├Ży cho biß║┐t:
a. Khß╗æi lŲ░ß╗Żng bß╗Öt nh├┤m cß║¦n d├╣ng.
b. Khß╗æi lŲ░ß╗Żng cß╗¦a nhß╗»ng chß║źt sau phß║Żn ß╗®ng.
-
B├Āi tß║Łp 6 trang 176 SGK H├│a 12 N├óng cao
Sß║Żn xuß║źt nh├┤m bß║▒ng phŲ░ŲĪng ph├Īp ─æiß╗ćn ph├ón nh├┤m oxit n├│ng chß║Ży. H├Ży t├Łnh khß╗æi lŲ░ß╗Żng Al2O3 v├Ā than ch├¼ (C) cß║¦n d├╣ng ─æß╗ā sß║Żn xuß║źt ─æŲ░ß╗Żc 5,4 tß║źn nh├┤m. Cho rß║▒ng to├Ān bß╗Ö lŲ░ß╗Żng kh├Ł oxi sinh ra ß╗¤ cß╗▒c dŲ░ŲĪng ─æ├Ż ─æß╗æt ch├Īy than ch├¼ th├Ānh cacbon ─æioxit.
-
B├Āi tß║Łp 1 trang 180 SGK H├│a 12 N├óng cao
Hß╗Żp chß║źt n├Āo cß╗¦a nh├┤m t├Īc dß╗źng vß╗øi dung dß╗ŗch NaOH (theo tß╗ē lß╗ć mol 1:1) c├│ sß║Żn phß║®m l├Ā Na[Al(OH)4]?
A. Al2(SO4)3
B. AlCl3
C. Al(NO3)3
D. Al(OH)3
-
B├Āi tß║Łp 2 trang 180 SGK H├│a 12 N├óng cao
D├Ży n├Āo dŲ░ß╗øi ─æ├óy gß╗ōm c├Īc chß║źt vß╗½a t├Īc dß╗źng ─æŲ░ß╗Żc vß╗øi dung dß╗ŗch axit v├Ā dung dß╗ŗch kiß╗üm?
A. AlCl3 v├Ā Al2(SO4)3
B. Al(NO3)3 v├Ā Al(OH)3
C. Al2(SO4)3 v├Ā Al2O3
D. Al(OH)3 v├Ā Al2O3
-
B├Āi tß║Łp 3 trang 180 SGK H├│a 12 N├óng cao
C├│ 3 chß║źt rß║»n l├Ā: Mg, Al2O3, Al. H├Ży nhß║Łn biß║┐t mß╗Śi chß║źt ─æ├Ż cho bß║▒ng phŲ░ŲĪng ph├Īp h├│a hß╗Źc. Viß║┐t c├Īc phŲ░ŲĪng tr├¼nh h├│a hß╗Źc.
-
B├Āi tß║Łp 4 trang 181 SGK H├│a 12 N├óng cao
Viß║┐t c├Īc phŲ░ŲĪng tr├¼nh h├│a hß╗Źc biß╗āu diß╗ģn nhß╗»ng chuyß╗ān ─æß╗Ģi h├│a hß╗Źc sau, ghi r├Ą c├Īc ─æiß╗üu kiß╗ćn cß╗¦a phß║Żn ß╗®ng v├Ā cho biß║┐t phß║Żn ß╗®ng n├Āo thuß╗Öc loß║Īi phß║Żn ß╗®ng oxi h├│a khß╗Ł:
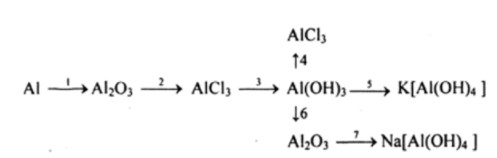
-
B├Āi tß║Łp 5 trang 181 SGK H├│a 12 N├óng cao
C├│ c├Īc dung dß╗ŗch AlCl3, HCl, NaOH, H2O v├Ā nhß╗»ng dß╗źng cß╗ź cß║¦n thiß║┐t. H├Ży ─æiß╗üu chß║┐ v├Ā chß╗®ng minh t├Łnh lŲ░ß╗Īng t├Łnh cß╗¦a Al2O3 v├Ā Al(OH)3. Viß║┐t c├Īc phŲ░ŲĪng tr├¼nh h├│a hß╗Źc.
-
B├Āi tß║Łp 6 trang 181 SGK H├│a 12 N├óng cao
Cho 31,2 gam hß╗Śn hß╗Żp bß╗Öt Al v├Ā Al2O3 t├Īc dß╗źng vß╗øi dung dß╗ŗch NaOH dŲ░, phß║Żn ß╗®ng xong thu ─æŲ░ß╗Żc 13,44 l├Łt H2 (─æktc). H├Ży cho biß║┐t:
a. C├Īc phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a c├Īc phß║Żn ß╗®ng ─æ├Ż xß║Ży ra?
b. Khß╗æi lŲ░ß╗Żng mß╗Śi chß║źt c├│ trong hß╗Śn hß╗Żp ban ─æß║¦u?
c. Thß╗ā t├Łch dung dß╗ŗch NaOH 4M ─æ├Ż d├╣ng (biß║┐t rß║▒ng trong th├Ł nghiß╗ćm n├Āy ngŲ░ß╗Øi ta ─æ├Ż d├╣ng dŲ░ 10 cm3 so vß╗øi thß╗ā t├Łch cß║¦n d├╣ng).
-
B├Āi tß║Łp 7 trang 181 SGK H├│a 12 N├óng cao
Cho 150 cm3 dung dß╗ŗch NaOH 7M t├Īc dß╗źng vß╗øi 100 cm3 dung dß╗ŗch Al2(SO4)3 1M. H├Ży x├Īc ─æß╗ŗnh nß╗ōng ─æß╗Ö mol cß╗¦a c├Īc chß║źt c├│ trong dung dß╗ŗch sau phß║Żn ß╗®ng.
-
B├Āi tß║Łp 27.1 trang 62 SBT H├│a hß╗Źc 12
Nh├┤m hi─æroxit thu ─æŲ░ß╗Żc tß╗½ c├Īch l├Ām n├Āo sau ─æ├óy ?
A. Cho dŲ░ dung dß╗ŗch HCl v├Āo dung dß╗ŗch natri aluminat.
B. Thß╗Ģi dŲ░ kh├Ł CO2 v├Āo dung dß╗ŗch natri aluminat.
C. Cho dŲ░ dung dß╗ŗch NaOH v├Āo dung dß╗ŗch AlCl3.
D. Cho Al2O3 t├Īc dß╗źng vß╗øi nŲ░ß╗øc.
-
B├Āi tß║Łp 27.2 trang 62 SBT H├│a hß╗Źc 12
Chß╗ē d├╣ng ho├Ī chß║źt n├Āo sau ─æ├óy c├│ thß╗ā ph├ón biß╗ćt 3 chß║źt rß║»n l├Ā Mg, Al v├Ā Al2O3 ?
A. Dung dß╗ŗch HCl
B. Dung dß╗ŗch KOH
C. Dung dß╗ŗch NaCl
D. Dung dß╗ŗch CuCl2
-
B├Āi tß║Łp 27.3 trang 62 SBT H├│a hß╗Źc 12
C├Īc dung dß╗ŗch ZnSO4 v├Ā AlCl3 ─æß╗üu kh├┤ng m├Āu. ─Éß╗ā ph├ón biß╗ćt 2 dung dß╗ŗch n├Āy c├│ thß║┐ d├╣ng dung dß╗ŗch cß╗¦a chß║źt n├Āo sau ─æ├óy ?
A. NaOH
B. HNO3
C. HCl
D. NH3
-
B├Āi tß║Łp 27.4 trang 62 SBT H├│a hß╗Źc 12
Hiß╗ćn tŲ░ß╗Żng n├Āo sau ─æ├óy ─æ├║ng khi cho tß╗½ tß╗½ dung dß╗ŗch NH3 ─æß║┐n dŲ░ v├Āo ß╗æng nghiß╗ćm ─æß╗▒ng dung dß╗ŗch AlCl3 ?
A. Sß╗¦i bß╗Źt kh├Ł, dung dß╗ŗch vß║½n trong suß╗æt v├Ā kh├┤ng m├Āu.
B. Sß╗¦i bß╗Źt kh├Ł v├Ā dung dß╗ŗch ─æß╗źc dß║¦n do tß║Īo ra chß║źt kß║┐t tß╗¦a.
C. Dung dß╗ŗch ─æß╗źc dß║¦n do tß║Īo ra chß║źt kß║┐t tß╗¦a sau ─æ├│ kß║┐t tß╗¦a tan v├Ā dung dß╗ŗcl lß║Īi trong suß╗æt.
D. Dung dß╗ŗch ─æß╗źc dß║¦n do tß║Īo ra chß║źt kß║┐t tß╗¦a v├Ā kß║┐t tß╗¦a kh├┤ng tan khi chi dŲ░ dung dß╗ŗch NH3.
-
B├Āi tß║Łp 27.5 trang 62 SBT H├│a hß╗Źc 12
Trong 1 l├Łt dung dß╗ŗch Al2(SO4)3 0,15M c├│ tß╗Ģng sß╗æ mol c├Īc ion do mue ph├ón li ra (bß╗Å qua sß╗▒ thuß╗Ę ph├ón cß╗¦a muß╗æi) l├Ā
A. 0,15 mol.
B. 0,3 mol.
C. 0,45 mol.
D. 0,75 mol.
-
B├Āi tß║Łp 27.6 trang 63 SBT H├│a hß╗Źc 12
H├▓a tan m gam Al t├Īc dß╗źng hß║┐t vß╗øi dung dß╗ŗch HNO3 rß║źt lo├Żng chß╗ē thu ─æŲ░ß╗Żc hß╗Śn hß╗Żp kh├Ł gß╗ōm 0,015 mol N2O v├Ā 0,01 mol NO. Gi├Ī trß╗ŗ cß╗¦a m l├Ā
A. 13,5.
B. 1,35.
C. 0,81.
D. 8,1.
-
B├Āi tß║Łp 27.7 trang 63 SBT H├│a hß╗Źc 12
Cho 5,4 g Al v├Āo 100 ml dung dß╗ŗch KOH 0,2M. Sau khi phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān thß╗ā t├Łch kh├Ł H2 (─æktc) thu ─æŲ░ß╗Żc l├Ā
A. 4,48 l├Łt.
B. 0,448 l├Łt.
C. 0,672 l├Łt.
D. 0,224 l├Łt.
-
B├Āi tß║Łp 27.8 trang 63 SBT H├│a hß╗Źc 12
Nung n├│ng hß╗Śn hß╗Żp gß╗ōm 10,8 g bß╗Öt Al vß╗øi 16 g bß╗Öt Fe2O3 (kh├┤ng c├│ kh├┤ng kh├Ł), nß║┐u hiß╗ću suß║źt phß║Żn ß╗®ng l├Ā 80% th├¼ khß╗æi lŲ░ß╗Żng Al2O3 thu ─æŲ░ß╗Żc l├Ā
A. 8,16 g.
B. 10,20 g.
C. 20,40 g.
D. 16,32 g.
-
B├Āi tß║Łp 27.9 trang 63 SBT H├│a hß╗Źc 12
─Éß╗æt ch├Īy bß╗Öt Al trong b├¼nh kh├Ł Cl2 dŲ░, sau khi phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān khß╗æi lŲ░ß╗Żng chß║źt rß║»n trong b├¼nh t─āng 4,26 g. Khß╗æi lŲ░ß╗Żng Al ─æ├Ż phß║Żn ß╗®ng l├Ā
A. 2,16 g.
B. 1,62 g.
C. 1,08 g.
D. 3,24 g.
-
B├Āi tß║Łp 27.10 trang 63 SBT H├│a hß╗Źc 12
Cho 4,005 g AlCl3 v├Āo 1000 ml dung dß╗ŗch NaOH 0,1M. Sau khi phß║Żn ß╗®ng xong thu ─æŲ░ß╗Żc khß╗æi lŲ░ß╗Żng kß║┐t tß╗¦a l├Ā
A. 1,56 g
B. 2,34 g
C. 2,60 g
D. 1,65 g.
-
B├Āi tß║Łp 27.11 trang 63 SBT H├│a hß╗Źc 12
─Éß╗ā khß╗Ł ho├Ān to├Ān m gam hß╗Śn hß╗Żp CuO v├Ā PbO cß║¦n 8,1 g kim loß║Īi nh├┤m sau phß║Żn ß╗®ng thu ─æŲ░ß╗Żc 50,2 g hß╗Śn hß╗Żp 2 kim loß║Īi. Gi├Ī trß╗ŗ cß╗¦a m l├Ā
A. 57,4.
B. 54,4.
C. 53,4.
D. 56,4.
-
B├Āi tß║Łp 27.12 trang 63 SBT H├│a hß╗Źc 12
Cho 16,2 g kim loß║Īi X (c├│ ho├Ī trß╗ŗ n duy nhß║źt) t├Īc dß╗źng vß╗øi 3,36 l├Łt O2 (─æktc), phß║Żn ß╗®ng xong thu ─æŲ░ß╗Żc chß║źt rß║»n A. Cho A t├Īc dß╗źng hß║┐t vß╗øi ─æung dß╗ŗch HCl thß║źy c├│ 1,2 g kh├Ł H2 tho├Īt ra. Kim loß║Īi X l├Ā
A. Mg.
B. Zn.
C. Al.
D. Ca.
-
B├Āi tß║Łp 27.13 trang 64 SBT H├│a hß╗Źc 12
Khi cho m gam Al t├Īc dß╗źng vß╗øi dung dß╗ŗch NaOH dŲ░ ─æŲ░ß╗Żc X l├Łt kh├Ł v├Ā khi cho c┼®ng m gam Al t├Īc dß╗źng vß╗øi HNO3 lo├Żng dŲ░ ─æŲ░ß╗Żc y l├Łt kh├Ł N2 duy nhß║źt (c├Īc thß╗ā t├Łch kh├Ł ─æo ß╗¤ c├╣ng ─æiß╗üu kiß╗ćn). Quan hß╗ć giß╗»a x v├Ā y l├Ā
A. x = 5y.
B. y = 5x.
C. x = y.
D. x= 2,5y.
-
B├Āi tß║Łp 27.18 trang 64 SBT H├│a hß╗Źc 12
Tuß╗│ thuß╗Öc v├Āo nß╗ōng ─æß╗Ö cß╗¦a dung dß╗ŗch HNO3, Al c├│ thß╗ā khß╗Ł HNO3 th├Ānh NO2, N2O, NO, N2, NH4NO3. Viß║┐t phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a c├Īc phß║Żn ß╗®ng?
-
B├Āi tß║Łp 27.19 trang 64 SBT H├│a hß╗Źc 12
C├│ 4 kim loß║Īi ri├¬ng biß╗ćt l├Ā Na, Ca, Cu, Al. H├Ży nhß║Łn biß║┐t mß╗Śi kim loß║Īi bß║▒ng phŲ░ŲĪng ph├Īp ho├Ī hß╗Źc v├Ā viß║┐t c├Īc phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc.
-
B├Āi tß║Łp 27.20 trang 65 SBT H├│a hß╗Źc 12
Chß╗ē d├╣ng nhß╗»ng chß║źt ban ─æß║¦u l├Ā NaCl, H2O, Al h├Ży ─æiß╗üu chß║┐ :
a) AlCl3.
b) Al(OH)3.
c) Dung dß╗ŗch NaAlO2
-
B├Āi tß║Łp 27.21 trang 65 SBT H├│a hß╗Źc 12
C├│ g├¼ giß╗æng v├Ā kh├Īc nhau khi cho kh├Ł CO2 v├Ā dung dß╗ŗch HCl lo├Żng t├Īc dß╗źng vß╗øi dung dß╗ŗch NaAlO2? Viß║┐t phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a c├Īc phß║Żn ß╗®ng xß║Ży ra.
-
B├Āi tß║Łp 27.22 trang 65 SBT H├│a hß╗Źc 12
Cho 13,5 g Al v├Āo dung dß╗ŗch NaOH n├│ng, lß║źy dŲ░.
a) Viß║┐t phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a phß║Żn ß╗®ng dŲ░ß╗øi dß║Īng ph├ón tß╗Ł v├Ā ion thu gß╗Źn.
b) T├Łnh thß╗ā t├Łch kh├Ł H2 bay ra ß╗¤ 735 mmHg v├Ā 22,5┬░C.
-
B├Āi tß║Łp 27.23 trang 65 SBT H├│a hß╗Źc 12
Ho├Ā tan 0,12 mol FeCl3, 0,15 mol MgSO4 v├Ā 0,16 mol Al2(SO4)3 v├Āo dung dß╗ŗch chß╗®a 0,4 moi H2SO4 v├Ā 0,1 mol HCl ─æŲ░ß╗Żc dung dß╗ŗch X. Cho 254 ml dung dß╗ŗch NaOH 10M v├Āo X ─æŲ░ß╗Żc m gam kß║┐t tß╗¦a. X├Īc ─æß╗ŗnh gi├Ī trß╗ŗ cß╗¦a m.
-
B├Āi tß║Łp 27.24 trang 65 SBT H├│a hß╗Źc 12
Cho 100 ml dung dß╗ŗch NaOH X mol/l (x > 0,4M) v├Āo dung dß╗ŗch chß╗®a 0,02 mol MgCl2 v├Ā 0,02 mol AlCl3. Lß╗Źc lß║źy kß║┐t tß╗¦a v├Ā nung ─æß║┐n khß╗æi lŲ░ß╗Żng kh├┤ng ─æß╗Ģi ─æŲ░ß╗Żc m gam chß║źt rß║»n. ─Éß╗ā m nhß╗Å nhß║źt th├¼ gi├Ī trß╗ŗ cß╗¦a X bß║▒ng bao nhi├¬u.






