Bài tập 22.4 trang 30 SBT Hóa học 8
Đốt nóng 1,35g bột nhôm trong khi clo, người ta thu được 6,675g nhôm clorua. Em hãy cho biết:
a) Công thức hóa học đơn giản của nhôm clorua, giải sử rằng ta chưa biết hóa trị của nhôm và clo.
b) Phương trình hóa học của nhôm tác dụng với khí clo.
c) Thể tích khí clo (đktc) đã tham gia phản ứng với nhôm.
Hướng dẫn giải chi tiết bài 22.4
a) Công thức hoá học đơn giản của nhôm clorua:
- Khối lượng clo có trong lượng nhôm clorua thu được:
mCl = 6,675 −1,35 = 5,325(g)
- Số mol Al và Cl đã kết hợp với nhau tạo thành nhôm clorua:
nAl = 1,35 : 27 = 0,05 (mol); nCl = 5,325 : 35,5 = 0,15(mol)
-Trong hợp chất nhôm clorua, số mol Cl gấp 3 lần số mol Al. Suy ra số nguyên tử Cl gấp 3 lần số nguyên tử Al. Công thức hoá học đơn giản của nhôm clorua là AlCl3
b) Phương trình hoá học của Al với Cl2
2Al + 3Cl2 → 2AlCl3
c) Thể tích khí clo tham gia phản ứng:
- Số mol phân tử Cl2 tham gia phản ứng: nCl2 = 5,325 : 71 = 0,075 (mol)
- Thể tích khí clo (đktc) tham gia phản ứng: VCl2 = 22,4.0,075 = 1,68(l)
-- Mod Hóa Học 8 HỌC247
-


Xác định tên kim loại A
bởi Choco Choco
 15/01/2019
15/01/2019
1/ Cho 0.7 gam 1 kim loai A vao dd H2SO4 loang, du. Sau khi PU xay ra hoan toan thu duoc 0.28 lit H2(dktc). Hay xac dinh ten kim loai A
Theo dõi (0) 1 Trả lời -


2/Tính khối lượng oxi cần dùng khí đốt cháy 16,8g sắt trong lọ chứa oxi, sau phản ứng thu được 23,2g oxi sắt từ (Fe3 O4)
chỉ mình vs câu này mình ko biết làm
Theo dõi (0) 1 Trả lời -


Xác định công thức hóa học của X ,Biết rằng dx/H2 =17
bởi thuy tien
 15/01/2019
15/01/2019
X là hợp chất khí với hidro của phi kim lưu huỳnh.Trong hợp chất này lưu huỳnh chiếm 94,12% về khối lượng , còn lại là H . Xác định công thức hóa học của X ,Biết rằng dx/H2 =17
Giải giúp vs
Theo dõi (0) 1 Trả lời -


Tính thể tích của khí H2 sinh ra ở Đktc
bởi bach hao
 15/01/2019
15/01/2019
Hoà tan hoàn toàn kẽm vào 9,8 gam axit sunfuric (H2So4) thu được kẽm sunfat (znso4) và giải phóng H2 câu hỏi : (a) viết phương trình và tính khối lượng của Zn? (B) tính thể tích của khí H2 sinh ra ở Đktc
Theo dõi (0) 1 Trả lời -


Công thức của A là gì?
bởi Nguyễn Hiền
 15/01/2019
15/01/2019
Đốt cháy hoàn toàn 0.3g hợp chất hữu cơ A thu được 0.224 dm3 khí CO2 ở đktc và 0.18g H2O. Lập công thức của A ( cái này em tính làm sao a, em đổi 0.224 dm3 ra rồi tính số mol, khối lượng nhưng tính xong lại không theo định luật bảo toàn khối lượng ) . :)
Theo dõi (0) 1 Trả lời -


nicotin là một chất độc gây nghiện ,có nhiều trong cây thuốc là .Công thức hóa học của nicotin có đang là C H N .THành phần trăm về khối lượng của các nguyên tố trong nicotin như sau : 74,07 %c ; 17,28 % n và 8,64 % H
a) xác đin h còn thức hóa học của nicotin , biết ở trạng thái hơi , nicotin có tỉ khối so với hiđro là 81
b) theo em nên làm gì để tạo một không gian không thời thuốc lá
Theo dõi (0) 1 Trả lời -


Tính hiệu suất của phản ứng trên
bởi na na
 15/01/2019
15/01/2019
Đốt cháy 4,96g photpho trong không khí thu được 8g P2O5 . Tính hiệu suất của phản ứng trên
Help tớ vs , tớ ko biết j về hiệu suất hết !!
Theo dõi (0) 1 Trả lời -


Tính thể tích khí so2 tạo ra và thể tích không khí cần dùng để đốt cháy hết 3,2 gam lưu huỳnh
bởi thanh hằng
 15/01/2019
15/01/2019
lưu huỳnh cháy trong không khí tạo ra khí sunfurơ ( so2) . đây là một chất khí độc , có mùi hắc , gây ho và lầ một trong các khí gây ra hiện tượng mưa axit
a) viết phương trình hóa học của phản ứng xảy ra
b) tính thể tích khí so2 tạo ra và thể tích không khí cần dùng để đốt cháy hết 3,2 gam lưu huỳnh ( biết các thể tích khí đo ở đktc ; trong không khí õi chiếm 20% về thể tích )
Theo dõi (0) 1 Trả lời -


Hãy tính thành phần trăm theo khối lượng của các nguyên tố có trong phân tử saccarozo?
bởi Suong dem
 15/01/2019
15/01/2019
Bài tập 1 saccarozo là thành phần chính của đường kính , saccarozo có nhiều trong cây mía , củ cải đường và hoa thốt nốt , nó được ứng dụng nhiều trong công nghiệp thực phẩm . hãy tính thành phần trăm theo khối lượng của các nguyên tố có trong phân tử saccarozo
Theo dõi (0) 1 Trả lời -


Tính khối lượng Zn sinh ra sau phản ứng
bởi Phan Quân
 15/01/2019
15/01/2019
CHo x gam Zn vào dung dịch H2SO4 dư thì thu được 483g ZnSO4 vè khí Hidro
a) Tính thể tích khí H2 sinh ra sau phản ứng
b) Tính khối lượng Zn sinh ra sau phản ứng
c) Tính khối lượng h2co4 đã phản ứng
Help mee!!!!!!Theo dõi (0) 1 Trả lời -


Tính khối lượng Fe3O4 thu được
bởi Lê Bảo An
 15/01/2019
15/01/2019
Đốt cháy 11,2 gam sắt trong bình chứa 22,4 lít khí oxi ( đktc ) tạo thành sắt từ oxit ( Fe3O4 )
a) Viết PTHH
b) Tính số mol mỗi chất trước phản ứng
c) Tính khối lượng chất dư sau phản ứng
d) Tính khối lượng Fe3O4 thu được
Theo dõi (0) 1 Trả lời -


Xác định tên kim loại
bởi Nguyễn Anh Hưng
 15/01/2019
15/01/2019
1/De hoa tan 2,4 gam oxit cua 1 kim loai hoa tri 3 can dung 2.19 gam HCl.Xac dinh oxit tren
2/Cho 18 gam 1 kim loai hoa tri 3 tac dung het voi 11,2 lit khi o2(dktc).Xac dinh ten kim loai
Theo dõi (0) 1 Trả lời -


Khối lượng P2O5 tạo thành
bởi Dell dell
 15/01/2019
15/01/2019
cho 3,4 g photpho tác dụng với 6g khí oxi tính khối lượng diphotpho pentaoxit (P2O5) tạo thành
Theo dõi (0) 1 Trả lời -


Tính khối lượng KCl tạo thành
bởi hai trieu
 15/01/2019
15/01/2019
cho sơ đồ phản ứng
KClO3 tạo thành KCl+O2
a) tính khối lượng KClO3 cần thiết để điều chế 9,6g khí ôxi
b) tính khối lượng KCl tạo thành ( theo 2 cách)
Theo dõi (0) 1 Trả lời -


Tính khối lượng KCl
bởi Nguyễn Lê Thảo Trang
 15/01/2019
15/01/2019
Khi phân hủy hoàn toàn KClO3 thu được KCl và O2
a, lập phương trình hóa học cho phản ứng trên
b, cho biết tỉ lệ số nguyên tử và phân tử
c; biểu thúc định luật bảo toàn khối lượng
d; cho biết khối lượng KClO3 đem phản ứng là 19g khối lượng O2 thu được 24,9g . Tính khối lượng KCl
Theo dõi (0) 1 Trả lời -


Tính mFe, mCu
bởi Phan Thị Trinh
 15/01/2019
15/01/2019
Bài 1: Hòa tan hoàn toàn 5,1g hỗn hợp Al và Mg trong dung dịch H2SO4 loãng dư thu đc 5,6 lít H2(đktc). Tính khối lượng mỗi kim loại.
Bài 2: có 1 hỗn hợp gồm 60% FeO3 và 405 CuO. người ta dùng H2 dư để khử 20g hỗn hợp đó
a,Tính mFe, mCu
b,Tính nH2
M.n Giúp mk nha!!!
Theo dõi (0) 1 Trả lời -


Tính giá trị a, b, c biết các khí đo ở ĐKTC.
bởi Ban Mai
 15/01/2019
15/01/2019
Đốt cháy hết a gam khí Axetilen (C2H2) trong bình chứa 1,12 lít không khí ( Oxi chiếm 20% thể tích ) thì sau phản ứng thu được b gam hơi nước và c lít khí Cacbonic. Tính giá trị a, b, c biết các khí đo ở ĐKTC.
Theo dõi (0) 1 Trả lời -


Khối lượng dd Magie clorua tạo thành là bao nhiêu?
bởi Nguyễn Thị An
 01/10/2018
01/10/2018
cho 3,6 gam kim loai mg tac dung vua het voi 210g dung dich axit clohidrit va thoat ra 0,11g hdro .
a, viet phuong THH
b, tinh khoi luong dung dich magie clorua tao thanh
Theo dõi (0) 1 Trả lời -


Tìm CTHH của hợp chất A tạo bởi 2 nguyên tố C,H
bởi Đào Thị Nhàn
 15/01/2019
15/01/2019
hợp chất A tạo bởi 2 nguyên tố C,H trong do nguyen to h chiem 14,2%
Theo dõi (0) 1 Trả lời -


Dẫn 6,72 lít khí hidro ở đktc qua ống sứ chứa 19,6 gam hỗn hợp A gồm CuO và \(Fe_3O_4\) nung nóng thu được hỗn hợp X.Xác định khối lượng các chất có trong X biết hiệu suất phản ứng đạt 60%
Các bạn giúp mình với mình đang rất vội nhé
Theo dõi (0) 1 Trả lời -


Tính khối lượng khí hidro clorua thu đc sau phản ứng
bởi Thùy Nguyễn
 15/01/2019
15/01/2019
Trong công nghiệp , hidro clorua đc điều chế bằng cách đốt khí hidro trong khí clo . Tính thể tích khí clo(ở đktc ) cần dùng để phản ứng vừa đủ với 67.2 lít khí hidro ( ở đktc ) và tính khối lượng khí hidro clorua thu đc sau phản ứng
Theo dõi (0) 1 Trả lời -


Tính khối lượng kết tủa
bởi Nguyễn Minh Hải
 15/01/2019
15/01/2019
A là hỗn hợp 2 kim loại Ba và Mg cho a gam A vào nước dư thu được 2,24l H2.Cũng cho a gam A vào HCl dư thu được 4,48l H2 và dung dịch B
a)TÍnh a
b) thêm vào dung dịc B 0,1 mol H2SO4 sau đó thêm tiếp 0,3 mol NaOH.Tính khối lượng kết tủa
Theo dõi (0) 1 Trả lời -


Tính khối lượng của mỗi kim loại trong hỗn hợp Y.
bởi Quynh Nhu
 15/01/2019
15/01/2019
Một hỗn hợp Y có khối lượng 7,8 gam gồm 2 kim loại Al và Mg, biết tỷ lệ số mol của Al và Mg trong hỗn hợp là 2:1.
a) Tính số mol của mỗi kim loại trong hỗn hợp Y.
b) Tính khối lượng của mỗi kim loại trong hỗn hợp Y.
Theo dõi (0) 1 Trả lời -


Cho hỗn hợp CuO và Fe3O4 tác dụng với 0,8 gam hidro ở nhiệt độ cao. Sau phản ứng thu được khối lượng sắt nhiều hơn của đồng là 10,4 gam.
a)Tìm khối lượng mỗi oxit trong hỗn hợp ban đầu.
b)Tìm thể tích khí hidro cần để tác dụng với lượng oxit trên ( các khí đo ở đktc).
Theo dõi (0) 1 Trả lời -


Khối lượng oxit sắt FexOy là bao nhiêu?
bởi Suong dem
 15/01/2019
15/01/2019
dẫn từ từ 8.96 lít h2(dktc) qua m gam oxit sắt FexOy nung nóng sau phản ứng thu được 7.2d nước và hỗn hợp 2 chất rắn nặng 28.4 gam(Phản ứng sảy ra hoàn toàn). Tìm giá trị của m
Theo dõi (0) 1 Trả lời -


Tìm CTHH của oxit đó
bởi Chai Chai
 15/01/2019
15/01/2019
Hòa tan hoàn toàn 9,4g của oxit kim loại (R2O) trong nước thu được 11,2 g ROH. Tìm CTHH của oxit đó.
Theo dõi (0) 1 Trả lời -


Định công thức hóa học của kim loại trên
bởi Bi do
 15/01/2019
15/01/2019
Hòa tan hoàn toàn 2,8 g một kim loại hóa trị II bằng dung dịch HCl thu được 1,12 lít H2. Định công thức hóa học của kim loại trên
Giúp mình với, mình đang cần gấp. Mai cô kiểm tra rồi
Theo dõi (0) 1 Trả lời -


Khối lượng FeCl2 tạo thành là bao nhiêu?
bởi Lê Nguyễn Hạ Anh
 15/01/2019
15/01/2019
Cho 11.2 gam Fe tác dụng với dung dịch HCl. Tính:
a. Thể tích khí H2 thu được ở đktc
b. khối lượng HCl phản ứng
c. Khối lượng FeCl2 tạo thànhTheo dõi (0) 1 Trả lời -


Tính thể tích khí CO2 thu được ở đktc
bởi Nguyễn Hoài Thương
 15/01/2019
15/01/2019
Đốt cháy hoàn toàn 1.12 lít khí CH4 ( ở đktc) thu được sản phẩm là cacbonic và hơi nước
a) Tính thể tích khí O2 ở đktc cần dùng
b) Tính thể tích khí CO2 thu được ở đktc
c) Tính khối lượng nước thu được sau phản ứng
Theo dõi (0) 1 Trả lời -


Xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất.
Hợp chất khối lượng mình mol( M ) Số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất Khối lượng của mỗi nguyên tố có trong 1 mol hợp chất Thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất KMnO4 -Nêu các bước giải bài toán xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất .
-Viết công thức tính thành phần phần trăm theo khối lượng của 1 nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất.
Theo dõi (0) 1 Trả lời -


Tính khối lượng Fe3O4 tạo thành
bởi Spider man
 28/07/2019
28/07/2019
Cho 8,4g bột sắt cháy hết trong 22,4 lít khi oxi (ĐKTC) tạo ra Fe3O4
a) Viết phương trình phản ứng
b) Tính khối lượng Fe3O4 tạo thành
Cho mình biết là bài này thuộc dạng nào nhé , mình ko biết loại bài này
Theo dõi (0) 1 Trả lời -


ms phản ứng là bao nhiêu?
bởi hành thư
 29/07/2019
29/07/2019
Đun nóng mạnh hỗn hợp gồm 28 bột sắt và 20g bột lưu huỳnh thu đc 44g FeS màu xám
a) Viết PTHH
b) ms phản ứng = ?
Theo dõi (0) 1 Trả lời -


Tính khối lượng mỗi kim loại
bởi A La
 29/07/2019
29/07/2019
ai trả lời hộ với sắp phải nộp rùi:
cho 17,7g hỗn hợp đồng và nhôm. Biết rằng tổng số mol cua 2 kim loại bằng số mol cua 10,08 lit khí hiđrô ở đktc.tính khối lượng mỗi kim loại
Theo dõi (0) 1 Trả lời -


Mẫu than trên chứa bao nhiêu %C nếu đốt cháy hết 3 kg than cùng loại thì lượng oxi, khí cacbonic sinh ra bao nhiêu g?
bởi Đào Thị Nhàn
 29/07/2019
29/07/2019
bài 10: đốt cháy hoàn toàn 1,5 kg than ( thành phần chính là C ) thì dùng hết 3,2 kg oxi và sinh ra 4,4 kg khí cacbonic
a/ hãy lập PTHH của phản ứng
b/ mẫu tha trên chứa bao nhiêu %C
nếu đốt cháy hết 3 kg than cùng loại thì lượng oxi, khí cacbonic sinh ra bao nhiêu g?
Theo dõi (0) 1 Trả lời -


cho 5,1g hỗn hợp Al và Mg vào dung dịch H2SO4 loãng dư thu được 5,6l H2 (đktc).tìm khối lượng kim loại ban đầu bik phản ứng xảy ra hoàn toàn
Theo dõi (0) 1 Trả lời -


Tính khối lượng ZnCl2 là bao nhiêu?
bởi Lan Ha
 29/09/2018
29/09/2018
cho 32.5g Zn phản ứng vs HCL thu được ZnCl2 và H2
a) viết pthh
b) tính khối lượng HCL
c) Tích thể tích H2
d) Tính khối lượng ZnCl2
Theo dõi (0) 1 Trả lời -


Khối lượng kết tủa thu được là bao nhiêu khi cho Na2CO3 và K2CO3 + HCl?
bởi Phạm Phú Lộc Nữ
 29/09/2018
29/09/2018
Hỗn hợp X gồm 2 muối Na2CO3 và K2CO3 có khối lượng 35 gam. Khi thêm từ từ và khuấy đều 0,8 lít dd HCl 0,5M?vào dd chứa 2 muối trên thì có 2,24 lít CO2 thoát ra ở dkc và được dd Y. Thêm Ca(OH)2 dư vào dd Y ta thu được kết tủa A. Tính khối lượng mỗi muối trong hỗn hợp X và tính khối lượng kết tủa A.
Theo dõi (0) 1 Trả lời -


Tính thể tích khí Oxi và Hiđro ở đktc để điều chế 900g
bởi Lê Nhi
 15/01/2019
15/01/2019
tính thể tích khí Oxi và Hiđro ở đktc để điều chế 900g nước
Theo dõi (0) 1 Trả lời -


Tính khối lượng của oxi đã phản ứng
bởi Nguyễn Thị Thanh
 15/01/2019
15/01/2019
1. Đốt cháy hoàn toàn 9 gam kim loại Mg trog không khí thu được 15 gam magie oxi ( MgO) . cho rằng chỉ xảy ra phản ứng giữa mg với oxi (O2) trong không khí
a, viết PTHH của pưng hóa học xảy ra
b, viết phương trình bảo toàn khối lượng
c, tính khối lượng của oxi đã phản ứng
Các bạn giúp mình nha mình đang cần gấp .........
 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Xác định tên kim loại đem dùng
bởi Lê Bảo An
 15/01/2019
15/01/2019
Hòa tan 8 gam oxit của một kim loại ( chưa rõ hóa trị của kim loại ) vào dung dịch chưa a gam HCl ( vừa đủ), phản ứng xong thu được 13,5g muối và nước. Xác định tên kim loại đem dùng. Tính giá trị a.
Theo dõi (0) 1 Trả lời -


Nêu các bước giải bài toán theo pthh
bởi Lê Gia Bảo
 15/01/2019
15/01/2019
nêu các bước giải bài toán theo pthh
Theo dõi (0) 1 Trả lời -


Tính khối lượng muối kẽm clorua bằng hai cách
bởi Trieu Tien
 15/01/2019
15/01/2019
ngâm 13g kẽm trong dung dịch AxitClohidric sau phản ứng thu đc Kẽm Clỏua và khí Hiđro
a. lập phương trình hoá học
b. tính khối lượng Axit Clohiđric cần dùng
c. tính thể tích của hiđro(đktc)
d. tính khối lượng muối kẽm clorua bằng hai cách
Theo dõi (0) 1 Trả lời -


Cho 5,2g Zn tác dụng 5,5l Oxi ở đktc. Sau phản ứng thu được chất rắn A. Tính phần trăm khối lượng mỗi chất trong A
Theo dõi (0) 1 Trả lời -


Tính nồng độ mol NAOH đã dùng
bởi Nguyễn Vũ Khúc
 29/09/2018
29/09/2018
CHO 50 ml dd H2SO4 1M tác dụng với 50 ml NAOH. Dung dịch sau phản ứng làm đổi màu quỳ tím thành đỏ. Để dung dịch không làm đổi màu quỳ tím người ta phải cho thêm vào dung dịch trên 20 ml KOH. 0,5 M
a) viết PTPƯB) tính nồng độ mol NAOH đã dùngTheo dõi (0) 1 Trả lời -


Nếu sau phản ứng thu đc 42g fe thì khối lượng fe2O3 đã tham gia phản ứng là bao nhiêu g
bởi Dương Quá
 15/01/2019
15/01/2019
khi cho khí hidro đi qua bột sắt (lll) oxit fe2o3 nung nóng người ta thu được theo sơ đồ phản ứng
a, nếu sau phản ứng thu đc 42g fe thì khối lượng fe2O3 đã tham gia phản ứng là bao nhiêu g
b, khối lượng hơi nước tạo thành trong phản ứng trên là bao nhiêu g
HELP ME
 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Tính khối lượng Fe phản ứng là bao nhiêu?
bởi Thùy Trang
 29/09/2018
29/09/2018
nhung 1 thanh sat nang 100 g vao 100 ml dd Cu(N03)2 0.2M va AgNO3 0.2M. Sau thời gian cân lại thanh sát năng 101.72g.tính khối lượng Fe phản ứng
Theo dõi (0) 1 Trả lời -


Tính nồng độ mol của các chất trong dung dịch A
bởi Hy Vũ
 29/09/2018
29/09/2018
Thêm từ từ từng giọt 100 ml dung dịch HCl 1,5 M vào 400 ml dung dịch A gồm KHCO3 và Na2CO3 thu được dung dịch B và thoát ra 1,008 lít khí (đktc).Cho dung dịch B phản ứng với một lượng Ba(OH)2 dư thu 29,55 gam kết tủa. Tính nồng độ mol của các chất trong dung dịch A.
Theo dõi (0) 1 Trả lời -


Tìm công thức hóa học của các hợp chất
bởi Goc pho
 15/01/2019
15/01/2019
Tìm công thức hóa học của các hợp chất có thành phần các nguyên tố sau
1) hợp chất A có khối lượng mol là 106 gam / mol thành phần các nguyên tố theo khối lượng : 43,4% Na ; 11,3% C và 45,3% O
2) hợp chất B có thành phần các nguyên tố là : 60,68% Cl và còn lại là Na biết hợp chất B có khối lượng mol phân tử là 80g/mol oxít
Theo dõi (0) 1 Trả lời -


Khối lượng cực đại của chất rắn là bao nhiêu?
bởi Van Tho
 29/09/2018
29/09/2018
Cho 16g FexOy tác dụng vowid HNO3 sư sau phản ứng co cạn dung dịch thu được muối khan , đem nung đến khối lượng không đổi thi thu được a gam chất rắn. Khối lượng cực đâị của chất rắn là:
A.17,778g B.16g C.16,55g D.Đáp án khác
Theo dõi (0) 1 Trả lời -


Lập phương trình hóa học
bởi Tra xanh
 15/01/2019
15/01/2019
Lập phương trình hóa học và cho biết tỉ lệ số trong nguyên tử, phân tử của các chất trong mỗi phản ứng.
1) Al + H2SO4 = Al2(SO4)3 + 2
Theo dõi (0) 1 Trả lời -


Tính % mỗi oxit Fe2O3 và CuO là bao nhiêu?
bởi Bin Nguyễn
 01/10/2018
01/10/2018
Cho 28(g) X gồm có Fe2O3 và CuO tác dụng hết với khí H2.Thu được 20.8(g) chất rắn. Tính % mỗi Oxit trong hỗn hợp
Theo dõi (0) 1 Trả lời -


Cho 65g kim loại kẽm tác dụng với axít clohiđric (HCl) thu được muối kẽm clorua (ZnCl2) và khí hiđro (H2)
a. Lập phương trình hóa học của phản ứng.
b. Cho biết tỉ lệ số nguyên tử, phân tử giữa các chất trong phản ứng.
c. Tính khối lượng của kẽm Clorua (ZnCl2) và khí hiđro (H2)
Theo dõi (0) 1 Trả lời -


hh X chua Al , Fe . Cho 13,9g X vao 200ml đ CuSO4 1M . Ket thuc phan ung thu dc dd Y va 21,2g hhR . Tinh % m Al trong X
Theo dõi (0) 1 Trả lời -


Khối lượng khí oxi đã phản ứng là bao nhiêu gam?
bởi Đào Thị Nhàn
 29/09/2018
29/09/2018
Đốt cháy hết 9 gam kim loại magie trong không khí thu được 15 gam hợp chất magieoxit(mgo) biết rằng, magie cháy là xảy ra phản ứng với oxi(o2) trong không khí
a, viết công thức về khối lượng của phản ứng xảy ra
b, tính khối lượng khí oxi đã phản ứng
Theo dõi (0) 1 Trả lời -


2 Hỗn hợp X gồm Al và 1 kim loại R. cho 1.93 gam X td với dung dịch H2SO4 loãng ( dư ), thu được 1.456 lít khí H2 (dktc). Nếu cho 1.93 gam X td hết với dung dịch HNO3 đặc, nóng (dư), thu được 3.36 lít khí NO2 (dktc). kim loại R là:
A Fe B Mg C Zn D SnTheo dõi (0) 1 Trả lời -


1 cho 36 gam hỗn hợp gồm Fe3O4 và Cu vào dung dịch HCl ( dư) sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn không tan là 6.4 gam. phần trăm khối lương Fe3O4 trong hỗn hợp ban đầu là?
Theo dõi (0) 1 Trả lời -


Tính thể tích và số phân tử khí oxi đã phản ứng
bởi bich thu
 15/01/2019
15/01/2019
Đốt cháy kẽm thu được 20,25g kem oxit .Tinh
a)Khối lượng của kẽm tham gia phản ứng
b)Tính thể tích và số phân tử khí oxi đã phản ứng
c)tính thể tích của không khí sử dụng cho phản ứng trên biết
Thể tích của không khí bằng 5 lần thể tích của khí oxi
Theo dõi (0) 1 Trả lời -


Một 1 tấn đá vôi chứa 95% là CaCO3 còn lại là hợp chất không bị phân hủy. Khi nung 1 tấn đá vôi đó thì thu đc bao nhiêu tấn vôi sống??
Theo dõi (0) 1 Trả lời -


Đốt cháy 2,3g Natri thì thu được 5,3g Natri Oxit ( Na2O )
a) Viết phương trình chữ của phản ứng trên.
b) Lập phương trình hóa học.
c) Tính khối lượng Oxi đã tham gia phản ứng.
Theo dõi (0) 1 Trả lời -


Hãy cho biết
a) Khối lượng 6,72 lít khí N2 ( ở đktc)
b) Thành phần trăm theo khối luongej của Đồng trong hợp chất CuSO4
Theo dõi (0) 1 Trả lời -


Tính khối lượng CaCO3 cần dùng để điều chế 5.6 tấn CaO
bởi minh thuận
 29/09/2018
29/09/2018
CaCO3 được dùng để sản xuất CaO. Tính khối lượng CaCO3 cần dùng để điều chế 5.6 tấn CaO.
Theo dõi (0) 1 Trả lời -


Nung 6,435 NaCl2 với H2SO4 đặc dư thu đc bao nhiêu lít khí HCl , biết H% = 80%
bởi Lê Gia Bảo
 15/01/2019
15/01/2019
1 . Nung 6,435 NaCl2 với H2SO4 đặc dư thu đc bao nhiêu lít khí HCl , biết H% = 80%
PTHH:
\(NaCl+H_{ 2}SO_4\rightarrow Na_2SO_4+HCl\uparrow\)
Giúp mk nha các bạn.....
Theo dõi (0) 1 Trả lời -


Tính số g mỗi kim loại Zn và Fe
bởi Huong Duong
 15/01/2019
15/01/2019
Cho 16,8g hỗn hợp Zn và Fe tác dụng vừa đủ với 200ml dung dịch HCl được dung dịch X và 6,72l H2
a) Tính số g mỗi kim loại
b) Tính a
c) Tính số g muối (2 cách)
Theo dõi (0) 1 Trả lời -


Xác đinh kim loại A
bởi Nguyễn Anh Hưng
 15/01/2019
15/01/2019
hòa tan hoàn toàn 3,78 gam một kim loại A bằng dd HCl thu được 4,704 lít khí hidro (đktc) . xác đinh kim loại A?
ai đó giải hộ mk với, khó quá!
Theo dõi (0) 1 Trả lời -


Al hay H2SO4 còn dư sau phản ứng ?
bởi Đào Thị Nhàn
 01/10/2018
01/10/2018
cho 5.4 g al vào dung dịch h2so4 loãng có chứa 39 ,2 g
a) chất nào còn dư sau phản ứng ? bao nhiêu gam ?
b) tính thể tích khí hidro thu được ở đktc
Theo dõi (0) 1 Trả lời -


Cân bằng P2O5 + H20 → H3POb) Al(OH)3→Al2O3 + H2O
bởi Nguyễn Xuân Ngạn
 15/01/2019
15/01/2019
a) P2O5 + H20 → H3PO
b) Al(OH)3→Al2O3 + H2O
Theo dõi (0) 1 Trả lời -


Hoà tan 16,24g hỗn hợp bột kẽm và nhôm trong dung dịch HCl dư thu được 8,512l khí Hiđro ở đktc. Khối lượng mỗi kim loại trong hỗn hợp ban đầu là bao nhiêu?
Theo dõi (0) 1 Trả lời -


Tính khối lượng AlCl3 thu được trong dung dịch A
bởi Lê Nhật Minh
 15/01/2019
15/01/2019
Cho 2,7 gam Al tác dụng với dung dịch chứa 7,3 gam HCl phản ứng kết thúc được dung dịch A và khí H2
a,Chất nào còn dư và dư bao nhiêu
b, Tính khối lượng AlCl3 thu được trong dung dịch A
c,Tính khối lượng và thể tích (đktc) khí H2 thu được
Theo dõi (0) 1 Trả lời -


Cho 8,1 gam Al vào dung dịch có chứa 53,9 gam H2So4, phản ứng kết thúc thu được dung dịch A và V lit H2
a,Chất nào dư và dư bao nhiêu gam
b, Tính khối lượng Al2(So4)3 thu được trong dung dịch A
c, Tính khối lượng và thể tích (đktc) của h2 thu được
Theo dõi (0) 1 Trả lời -


Tính khối lượng FeCl2 thu được trong dung dịch A
bởi Nguyễn Tiểu Ly
 15/01/2019
15/01/2019
Cho 8.4 gam Fe tác dụng với dung dịch chứa 14,6 gam HCl phản ứng hoàn toàn thu được dung dịch A và khí H2
a,Chất nào dư và dư bao nhiêu gam
b, Tính khối lượng FeCl2 thu được trong dung dịch A
c, Tính khối lượng à thể tích khí (đktc) H2 thu được
Theo dõi (0) 1 Trả lời -


Tính số MOl và khối lượng HCl đã phản ứng
bởi Phan Quân
 15/01/2019
15/01/2019
Cho 4,05 gam AL tác dụng với dung dịch HCl dư ohanr ứng hoàn toàn thu được ALcl3 và H2
a, Tính số MOl và khối lượng HCl đã phản ứng
b,Tính số Mol và khối lượng Alcl3 thu được
c, Tính số Mol khối lượng và thể tích khí (đktc) H2 thu được
Theo dõi (0) 1 Trả lời -


Tính khối lượng Cu (Hóa trị 2) oxit sau phản ứng
bởi Nguyễn Thanh Trà
 15/01/2019
15/01/2019
Cho 112l không khí ở đktc đốt cháy đồng.
a.Viết PTHH
b.Tính thể tích oxi nguyên chất và số mol oxi
c.Tính khối lượng Cu (Hóa trị 2) oxit sau phản ứng .
Giúp mình nha...Cảm ơn !!!
Theo dõi (0) 1 Trả lời -


Chất khí X có trong thành phần của khí hoá lỏng, dùng cho bếp gas để đun nấu... Khí X có thành phần phần trăm về khối lượng các nguyên tố như sau : 81,82%C ; 18,18%H. Xác định công thức hoá học của X, biết khí X nặng hơn khí hiđro 22 lần.
Theo dõi (0) 1 Trả lời -


B1: ở cùng điều kiện nhiệt độ và áp suất: a mol khí H2 ( khối lương 4g) và x mol khí cacbonic có khối lượng y gam chiếm thể tích bằng nhau
a) Tính x và yb) Tính số nguyên tử và số phân tử trong mỗi lượng chất trênB2: Hòa tan hoàn toàn 9,6 gam một kim loại X có hóa trị II bằng dung dịch HCl vừa đủ. Khi phản ứng kết thúc thu được 8,96 lít khí (đktc)a) Xác định tên kim loại X ?b) Tính thể tích dung dịch HCl 1 M cần dùng cho phản ứng trênB3: Để khử hoàn toàn 47,2 gam hỗn hợp CuO, FeO, Fe3O4 cần dùng V lít khí H2 ( ở đktc). Sau pứ thu được m gam kim loại và 14,4 gam nướca) Viết PTHH xảy rab) Tính giá trị m và V?B4: Cho 21,5 gam hỗn hợp kim loại M và M2O3 nung ở nhiệt độ cao, rồi dẫn luồng khí CO đi qua để pứ xảy ra hoàn toàn thu được m gam kim loại và 6,72 lít khí CO2 ( ở đktc)a) Xác định kim loại M và oxit M2O3, gọi tên các chất đó?b) Tìm m biết tỉ lệ số mol của M và M2O3 là 1:1B5: Hòa tan hoàn toàn 6,5 gam Zn bằng dung dịch H2SO4 loãng vừa đủ thu được dung dịch A và V lít khí ở đktc.Tính klg chất tan có trong dd ATheo dõi (0) 1 Trả lời -


Tính nồng độ mol NaOH
bởi Lê Nhật Minh
 15/01/2019
15/01/2019
Cho 5,6g sắt 3 clorua phản ứng với 200ml dung dịch NaOH
a) viết phương trình
b) tính khối lượng kết tủa
c) tính nồng độ mol NaOH
Theo dõi (0) 1 Trả lời -


Tính thể tích khí SO2 tạo ra và thể tích không khí cần dùng để đốt cháy hết 3,2g lưu huỳnh
bởi hi hi
 15/01/2019
15/01/2019
Lưu huỳnh cháy trong không khí tạo ra khí sunfuro(SO2). Đây là một chất khí độc, có mùi hắc, gây ho và là một trong các khí gây ra mưa axit.
a) Viết phương trình phản ứng hóa học của phản ứng đã xảy ra.
b)Tính thể tích khí SO2 tạo ra và thể tích không khí cần dùng để đốt cháy hết 3,2g lưu huỳnh biết các thể tích đo được ở điều kiện tiêu chuẩn, trong không khí oxi chiếm 20% về thể tích.
Thế số vào phương trình luôn
Theo dõi (0) 1 Trả lời -


Tính khối lượng nhôm oxit tạo thành
bởi Sasu ka
 15/01/2019
15/01/2019
Cho 5,4g nhôm phản ứng với 11,2l Oxit
a/ Tính khối lượng nhôm oxit tạo thành
b/ Sắt và Oxit chất nào phản ứng còn dư và dư bao nhiêu gam
Theo dõi (0) 1 Trả lời -


Xác định tên kim loại hóa trị III
bởi Nguyễn Trọng Nhân
 29/09/2018
29/09/2018
hòa tan một lượng muối cacbonat của một loại hóa trị III bằng dung dịch H2SO4 16%. Sau khi khí không thoát ra nữa, được dung dịch chứa 20% mưới sunfat tan. Xác định tên kim loại hóa trị III.
Theo dõi (0) 1 Trả lời -


Cân bằng PTHH sau:Fe + H2SO4 ---> Fe2(SO4)3 + SO2 + H2O
bởi Thụy Mây
 15/01/2019
15/01/2019
Cân bằng PTHH sau:
Fe + H2SO4 ---> Fe2(SO4)3 + SO2 + H2O
Ai giỏi giúp mk với. Cảm ơn nhé!
Theo dõi (0) 1 Trả lời -


Tính m của các chất tạo thành theo V,theo a,theo m
bởi My Hien
 15/01/2019
15/01/2019
Cho V lít khí CO ở điều kiện tiêu chuẩn đi qua ống sứ đựng CuO nóng. Sau khi kết thúc thí nghiệm cho khí đi ra khỏi ống sứ hấp thụ vào dung dịch NaOH dư.Sau đó thu vào một lượng dư BaCl2 thấy tạo ra m g chất tủa
a)Viết các phương trình phản ứng xảy ra
b)Tính m của các chất tạo thành theo V,theo a,theo m
Theo dõi (0) 1 Trả lời -


Cho 19,8g kẽm tác dụng voi dung dịch axit clohidric hãy cho biet
A) thể tích khí H2 sinh ra ( đktc)
B) neu dùng thể tích khí H2 trên de khữ 19,2 sắt (|||) oxit thì thu dc bao nhieu gam sắt
Theo dõi (0) 1 Trả lời -


Tính thể tích dd HCl có nồng độ 2M cần dùng
bởi Lê Thánh Tông
 15/01/2019
15/01/2019
Hòa tan 5.6 gam fe bằng dung dịch HCl vừa đủ.
a) Tính thể tích dd HCl có nồng độ 2M cần dùng
b) Tính thể tích khí hidro thu được ở (đktc)
Theo dõi (0) 1 Trả lời -


Cho 1 luồng khí H2 dư đi chậm qua 40(g) hỗn hợp X gồm CuO và Fe2O3. Khi phản ứng xảy ra hoàn toàn thu được 29,6(g) hỗn hợp 2 kim loại Y.
a, Lập PTHH xảy ra.
b, Tính VH2 đã dùng(đktc) biết hiệu suất phản ứng chỉ đạt 75%
c, Tính % khối lượng mỗi kim loại trong X.
Mình cần gấp vào thứ 3 tuần sau,mn giúp mình với
Theo dõi (0) 1 Trả lời -


Tính CM của chất tan trong A
bởi minh dương
 15/01/2019
15/01/2019
Hòa tan hết 9,4(g) hỗn hợp X gồm Mg và Al bằng 400 ml dung dịch HCl 2,5M được dung dịch A và 6,72(l) khí B ở đktc.
a, Lập PTHH
b, Tính % khối lượng mỗi chất trong X.
c, Tính CM của chất tan trong A.
Mình cần gấp vào thứ 3 tuần sau, mn giúp mình với.
Theo dõi (0) 1 Trả lời -


Tính thể tích dd HCl có nồng độ 2M cần dùng
bởi cuc trang
 15/01/2019
15/01/2019
Hòa tan 5.6 gam fe bằng dung dịch HCl vừa đủ.
a) Tính thể tích dd HCl có nồng độ 2M cần dùng
b) Tính thể tích khí hidro thu được ở (đktc)
Theo dõi (0) 1 Trả lời -


Tính thể tích khí oxi dùng để đốt cháy 54 gam bột nhôm
bởi bala bala
 01/10/2018
01/10/2018
Cho 54g bột nhôm cháy trong oxi thu được 102g nhôm oxit. Viết PTHH xày ra và tính thể tích khí oxi đã dùng ?
Theo dõi (0) 1 Trả lời -


Tính số Mol và khối lượng FeCl2
bởi Hương Lan
 15/01/2019
15/01/2019
cho Fe tác dụng vừa đủ với dung dịch chứa 14,6 gam HCl
a, Tính số Mol và khối lượng Fe đã phản ứng
b,Tính số Mol và khối lượng FeCl2
c, Tính khối lượng và thể tích (đktc) khí H2 thu được
Theo dõi (0) 1 Trả lời -


Nếu thay thế kẽm bằng nhôm thì muốn có thể tích H2 gấp đôi sẽ cần bao nhiêu gam nhôm?
bởi Bình Nguyen
 15/01/2019
15/01/2019
cho 19,5g kẽm vào axit sunfuric H2SO4 loãng, dư thu được bao nhiêu lít khí hidro và bao nhiêu gam muối kẽm sunfat tạo thành?
nếu thay thế kẽm bằng nhôm thì muốn có thể tích H2 gấp đôi sẽ cần bao nhiêu gam nhôm?
Theo dõi (0) 1 Trả lời -


Tính thể tích ko khí (đktc) cần dùng để đốt cháy hết lượng khí hidro trên biết thể tích oxi
bởi Cam Ngan
 15/01/2019
15/01/2019
Câu hỏi : Cho 5,6 lít nước hidro tác dụng với 3,2g khíc Oxi tạo ra nước
a) Viết phương trình hóa học
b) Khí Oxi và khí hidro ,chất nào dư sau phân tử tính thể tích khí dư.Biết thể tích các khí đo ở đktc
c) Tính Khối lượng nước thu được bằng 2 cách?
d) Tính thể tích ko khí (đktc) cần dùng để đốt cháy hết lượng khí hidro trên biết thể tích oxi bằng 1/5 thể tích ko khí>?Theo dõi (0) 1 Trả lời -


Hãy tính thể tích H2 ở đktc thu được sau
bởi Mai Anh
 29/07/2019
29/07/2019
Cho 5,6g sắt tan hoàn toàn trong dung dịch chứa 0,2 mol H2SO4 . Hãy tính thể tích H2 ở đktc thu được sau khi kết thúc phản ứng. Help me!!
Theo dõi (0) 1 Trả lời -


Xác định lượng dư sau phản ứng khi cho 4,48 lít SO2 vào 0,12 mol Ca(OH)-2?
bởi Thanh Truc
 29/07/2019
29/07/2019
Dẫn từ từ 4.48 lít khí lưu huỳnh đioxit vào 0.12 mol dung dịch Ca(OH)2
a.Chất nào còn dư, dư bao nhiêu gam?
b.Tính khối lượng muối thu được.
Theo dõi (0) 1 Trả lời -


Đốt cháy hết 4,4g hỗn hợp gồm C và S người ta dùng hết 4,48 lít khí oxi (đkc). Tính khối lượng các chất khí sinh ra?
Theo dõi (0) 1 Trả lời -


Tính % mỗi chất ban đầu biết cho 8g Cu và Fe tác dụng với HCl dư thu được 1,68 lít H2?
bởi thanh duy
 30/07/2019
30/07/2019
Cho 8g hh Cu và Fe tác dụng với dung dịch HCL dư thu được 1,68l khí H2 ( đktc)
a) Tính thành phần % của khối lượng trong hh đầu
b) Tính khối lượng muối tạo thành
Theo dõi (0) 1 Trả lời -


Cho kim loại Na tác dụng với nước thu được 3,36 lít H2(đktc)
A)tính khối lượng Na đã phản ứng và khối lượng sản phẩm tạo thành
B)nếu cho quỳ tím vào dung dịch sau phản ứng, quỳ tím có đổi màu không?
C)với thể tích khí trên có thể khử được bao nhiêu g sắt (III) oxit
Theo dõi (0) 1 Trả lời -


Hòa tan 8,4g sắt bằng dd HCl 10,95%
a. Tính nồng độ phần trăm của dung dịch thu được sau phản ứng?
b. Cho một hỗn hợp gồm Al và Zn tác dụng hết với dd HCl thấy thoát ra khí hidro đúng bằng lượng hidro thu được ở phản ứng trên. Tính thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp. Biết số mol của hai kim loại này trong hỗn hợp bằng nhau?Theo dõi (0) 1 Trả lời -


Tính khối lượng của lưu huỳnh
bởi Nguyễn Thị Thúy
 01/10/2018
01/10/2018
Đun nóng mạnh hỗn hợp gồm 28g bột Fe và 20g bột lưu huỳnh thu được 44g chất sắt (II) sunfua màu xám. Biết rằng để phản ứng xảy ra hết người ta đã lấy dư lưu huỳnh. Tính khối lượng của lưu huỳnh lấy dư.
Theo dõi (0) 1 Trả lời -


Tính mAl2O3 tạo thành khi đốt 15g Al trong không khí?
bởi Lê Tường Vy
 30/07/2019
30/07/2019
B1:Cho m gam Zn vào 150ml dd HCl 2M. sau khi phản ứng xả ra hoàn toàn tính giá trị của m và VH2 thoát ra
B2: Đốt cháy 15g Al trong không khí. Tính khối lượn Al2O3 tạo thành và thể tích không khí ( đktc ) cần dùng. Biết oxi chiếm 20% thể tích không khí
Mn giúp mình với nha!!! mình cần câu trả lời gấp lắm ạ. càng sớm càng tốt
Cảm ơn nhiềuTheo dõi (0) 1 Trả lời -


Tính m dung dịch thu được biết cho 18,8g Fe và Fe2O3 tác dụng với HCl thu được 1,12 lít H2?
bởi Kim Ngan
 30/07/2019
30/07/2019
cho 18,8 g hỗn hợp Fe Fe2O3 tác dụng hết với dung dịch Hcl thu được 1,12l khí H2 dung dịch thu được cho tác dụng NaOH dư. kết tủa thu được đem nung trong không khi đến khối lượng không đổi thu được m g chất rắn.giá trị của m là
Theo dõi (0) 1 Trả lời -


cho 8,125gam kẽm tác dụng với 18,25gam HCl hãy tính khói lượng ZnCl2 và thể tích H2 tạo thành (đktc)
Theo dõi (0) 2 Trả lời -


Tìm khối lượng P2O5 và khối lượng H2O
bởi Long lanh
 27/09/2018
27/09/2018
A xít H3PO4 được tạo thành do P2O5 kết hợp với nước.
a. Viết PTHH.
b. Để tạo được 41 gam H3PO4 người ta cho P2O5 kết hợp với nước theo tỉ lệ khối lượng 7,1:2,7. Tìm khối lượng P2O5 và khối lượng H2O
Giúp mình với đặc biệt là câu b, câu a ko làm cũng được! giải chi tiết giúp mình với nghe các bạn
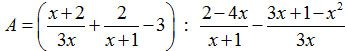 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Tính C% của chất tan có trong dung dịch A
bởi Anh Nguyễn
 15/01/2019
15/01/2019
1, Cho 10,8 (g) bột nhôm vào 200(g) dung dịch HCl 27,375% được dung dịch A và V(l) khí B ở đktc.
a, Lập PTHH
b, Tính VB
c, Tính C% của chất tan có trong dung dịch A
2, Đốt cháy hoàn toàn 12,6(g) hỗn hợp X gồm S và P với khí O2. Sau phản ứng thu được 4,48(l) khí O2 ở đktc.
a, Lập PTHH xảy ra.
b, Tính khối lượng chất rắn sau phản ứng.
c, Tính %m mỗi chất rắn trong X.
Mình cần gấp lắm, mọi người giúp mình với!
Theo dõi (0) 1 Trả lời -


Để sản xuất sắt, người ta đưa vào lò 250 tấn quặng hematit có chứa 60% Fe2O3, còn lại là tạp chất rắn không phản ứng rồi khử bằng khí CO. Tính khối lượng sắt thu được biết hiệu suất của nó chỉ đạt 90%.
Mình cần gấp lắm, giúp mình với
Theo dõi (0) 1 Trả lời -


Tính hiệu suất phản ứng
bởi hà trang
 15/01/2019
15/01/2019
Hỗn hợp X gồm N2 và H2 có dX/H2 =4,9. Cho X vào bình kín rồi nung nóng ở nhiệt độ thích hợp một thời gian được hỗn hợp khí Y có dY/H2 =6,125.Tính hiệu suất phản ứng.
Mình cần gấp lắm, mọi người giúp mình với
Theo dõi (0) 1 Trả lời -


Tính thể tích khối Fe tác dụng với HCl
bởi Lê Minh
 01/10/2018
01/10/2018
5,6gam Fe tác dụng với HCl
a)Viết phương trình phản ứng
b)Tính khối lượng của HCl
c)Tính thể tíc khối tác dụng với HCl
Theo dõi (0) 1 Trả lời -


Zn hay HCl dư?
bởi minh dương
 29/09/2018
29/09/2018
khi cho 6,5g Zn tác dụng với 36,5g HCL tạo thành muối và giải phóng khí
a, Zn hay HCL dư? tính số mol dư và số lượng chất dư
b, tính klg muối tạo thành sao phản ứng ?
m.n giải giúp e vs ạ
Theo dõi (0) 1 Trả lời -


cho hỗn hợp gồm 60% FE2O3 và 40% CuO người ta dùng H2 để khử 20g hỗn hợp đó. tính khối lượng sắt và đồng thu dc sau phản ứng và tính số mol H2 phản ứng
giúp tôi
Theo dõi (0) 1 Trả lời -


Tính nồng độ phần trăm của dd HCl sau phản ứng
bởi Nguyễn Thanh Trà
 29/09/2018
29/09/2018
Hòa tan 6,5 (g) Zn bằng 50 (g) dd HCl 18,25%
a) tính thể tích khì thu được sau phản ứng (đktc)b) tính khối lựơng muối tạo thành
c) tính nồng độ phần trăm của dd sau phản ứng
Theo dõi (0) 1 Trả lời -


Tính m mỗi chất trong A biết cho 11,15g PbO tác dụng với H2 thu được 10,38g?
bởi Mai Bảo Khánh
 30/07/2019
30/07/2019
có 11,15 gam chì oxit được nung nóng dưới dòng khí hidro. Sau khi ngừng nung nóng, sản phẩm rắn A thu được có khối lượng là 10,38 gam. Tính thành phần khối lượng A
Theo dõi (0) 1 Trả lời -


Trong quặng Bô-xit trung bình có 50% Al2O3. Kim loại luyện được từ Oxit đó có chứa 1,5% tạp chất. Tính lượng Al nguyên chất được điều chế từ nửa tấn quặng Bô-xít. Cho biết rằng để luyện nhân nguyên chất dùng phương trình hóa học luyện Al:
Al2O3 = Al + O2
Theo dõi (0) 1 Trả lời -


Có hỗn hợp gồm Fe và Fe2O3,chia hỗn hợp thành 2 phần bằng nhau: -Phần 1 ngâm trong dung dịch HCl dư, phản ứng xong thu được 4,48 lít khí H2 ở đktc -Phần 2 nung nóng và cho dòng khí hidro dư đi qua thì thu được 33,6 gam Fe Tính thành phần phần trăm theo khối lượng của mỗi chất có trong hỗn hợp ban đầu
Theo dõi (0) 1 Trả lời -


Viết PTHH khi cho Fe, Mg tác dụng với HCl?
bởi Mai Rừng
 30/07/2019
30/07/2019
cho 6,8g hỗn hợp gồm 2 kim loại gồm sắt và Mg tác dụng với 800ml dung dịch HCl vừa đủ. sau Phản ứng thu được 3,36lits khí hidro( điều kiện tiêu chuẩn)
a. viết phương trình phản ứng xảy ra
b. tính thành phần phần trăm théo khối lượng của mỗi kim loại có trong hỗn hợp
c. tính nồng độ mol của dung dịch HCl đã dùng
Theo dõi (0) 1 Trả lời -


Tính khối lượng Mg
bởi thanh hằng
 15/01/2019
15/01/2019
dot chay hoan toan 4,8 g Mg . tinh mMgo thu duoc .
Theo dõi (0) 1 Trả lời -


Tính VH2 thu được khi cho 5,4g Al tác dụng với HCl?
bởi Nguyễn Vân
 30/07/2019
30/07/2019
Cau 1: cho 6.05 g hỗn hợp gồm Zn và Al tác dụng vừa đủ vói m gam đ HCl 10% cô cạn đ sau pứ thu đc 13.15g muối khan.Tính m
Câu2:200g đ AgNO3 8.5% tác dụng vừa đủ 150ml dd HCl. Tìm nồng độ mol của ddHCl
Câu3:Cho 5.4g Al td với HCl thì thể tích khí hiđro sinh ra ở đktc là bao nhiêu?
Câu4 Trong phòng thí nghiệm có các hóa chất:CaO,H2O,MnO2,axitH2SO4 70%(D=1.61g/cm3)và NaCl.Hỏi cần pải dùng những chất gì và với lượng chất là bao nhiêu để điều chế 254g clorua vôi?
Caau Cho 500 ml dd NaOH 1.8M pứ với 500ml dd FeCl3 0.8M thu đc dd A và chất rắn B
XĐ:Khối lg chất rắn B và nồng độ mol/l mỗi chất trong dd A
Theo dõi (0) 1 Trả lời -


Tính khối lượng muối ZnCl2 tạo thành
bởi Quế Anh
 15/01/2019
15/01/2019
các bạn tl nhanh hộ mk nhé
cho Phương trình hóa học sau:Zn+HCl->ZnCl2+H2
a)tính khối lượng muối ZnCl2 tạo thành
b)tính khối lượng hcl cần dùng biết :mZn =6.5g
Theo dõi (0) 1 Trả lời -


Viết PTHH khi cho Al tác dụng với HCl?
bởi Nguyễn Xuân Ngạn
 30/07/2019
30/07/2019
Hoà tan m Al vào 300g dd HCl nông dô 7,3% thu duoc dd nhôm clorua và khí hidro
a:viêt PT p/u xåy ra
b:tính m
c:tính V hidro (dktc)
d:tính m muôi thu duoc
Theo dõi (0) 1 Trả lời -


Xác định M biết 8,3g M phản ứng với 3,36 lít O2, sản phẩm thu được cho vào HCl thu được 3,36 lít H2?
bởi Đan Nguyên
 30/07/2019
30/07/2019
cho 8,3g kim loại M pư vs 3,36 lít Oxi toàn bộ sản phẩm thu được cho phản ứng vs HCL dư thu được 3,56 lít khí ở dktc.Xác định kim loại
Theo dõi (0) 1 Trả lời -


Tính m muối thu được khi cho 3,36 lít SO2 tác dụng với 0,5 lít KOH 2M và NaOH 2M?
bởi Trịnh Lan Trinh
 30/07/2019
30/07/2019
Cho \(3,36l\) \(SO_2\) tác dụng với \(0,5l\) hỗn hợp gồm KOH 0.2M và NaOH 0.2M .sau phản ứng thu được m gam muối khan. Xác định m?
Theo dõi (0) 1 Trả lời -


Tính khối lượng oxit sắt từ
bởi Trần Bảo Việt
 15/01/2019
15/01/2019
Cho 2.8g sắt phản ứng với oxi trong không khí thu được oxit sắt từ \(Fe_3O_4\)
a) Tính khối lượng oxit sắt từ
b)Tính thể tích khí \(O_2\) đã phản ứng
c)Tính thể tích của không khí đã phản ứng (biết trong không khí oxi chiếm 20%)
Theo dõi (0) 1 Trả lời -


cho 1,68lit CO2(dktc) sục vào bình đựng dung dịch KOH dư . Tính nồng độ mol/lít của muối thu được sau phản ứng. Biết thể tích dung dịch là 250ml
Theo dõi (0) 1 Trả lời -


Tính hiệu suất phản ứng nhiệt phân 4,9 gam KClO3
bởi khanh nguyen
 29/09/2018
29/09/2018
Câu 1
Lấy 4,9 gam KClO3 đem nung có xúc tác, khi phản ứng xảy ra xong thu được 2,5 gam KCl và V (ml) khí O2 ở DKTC
a) Tính hiệu suất
b) Tính V
Theo dõi (0) 1 Trả lời -


Khối lượng nhôm oxit tạo ra là bao nhiêu?
bởi Thiên Mai
 15/01/2019
15/01/2019
Lập phương trình hoá học của phản ứng có sơ đồ: Nhôm+Khí oxi------>Nhôm oxit (Al2O3)
A) Thể tính oxi đã dùng (đktc).
B) Khối lượng nhôm oxit tạo ra.
Theo dõi (0) 1 Trả lời -


Xác định tên nguyên tố có hóa trị IV
bởi Lê Tấn Thanh
 29/09/2018
29/09/2018
Khi oxi hóa 2 gam một nguyên tố hóa học có hóa trị IV bằng oxi thu được 2,54 gam oxi . Xác định tên nguyên tố đó
Theo dõi (0) 1 Trả lời -


Hỏi muốn loại bớt 90% Cacbon có trong 5 tấn gang chứa 4% Cacbon thì cần bao nhiêu kí Fe2O3 ?
bởi Lê Bảo An
 15/01/2019
15/01/2019
Để sản xuất thép từ gang thì người ta có thể loại bớt Cacbon bằng Fe2O3 theo phản ứng sau Fe2O3+C => Fe+ CO Hỏi muốn loại bớt 90% Cacbon có trong 5 tấn gang chứa 4% Cacbon thì cần bao nhiêu kí Fe2O3 ?
Theo dõi (0) 1 Trả lời -


Tính m axit tham gia phản ứng
bởi Bo Bo
 15/01/2019
15/01/2019
Hòa tan gồm 7,8 kim loại A(II) và kim loại B(III) tác dụng vừa đủ vs H2SO4 tạo ra 8,96l khí H2 (ở đktc)
a) Viết PTHH
b) Tính m axit tham gia phản ứng
c) Tìm kim loại A,B biết nB=2nA và MA = 8/9 MB
Theo dõi (0) 1 Trả lời -


Xác định công thức hóa học của oxit
bởi Mai Rừng
 01/10/2018
01/10/2018
Khử 23,2 gam một oxit sắt bằng CO , sau phản ứng thu được 16,8 (g) sắt
a) Tính thể tích khí CO2 thoát ra (đktc)
b) Xác định công thức hóa học của oxit ấy
Theo dõi (0) 1 Trả lời -


Nếu dùng 80 gam CaCO3 thì thu được bao nhiêu gam CaO và bao nhiêu lít Khí CO2
bởi Nguyễn Thị Thanh
 15/01/2019
15/01/2019
cho PTHH sau : CaCO3 -------> CaO + CO2:
a, cần dùng bao nhiêu mol CaCO3 để điều chế được 28 gam CaO?
b, Nếu dùng 80 gam CaCO3 thì thu được bao nhiêu gam CaO và bao nhiêu lít Khí CO2(đktc)
c, nếu thu được 8,4 lít khí CO2 (đktc) tính khối lượng chất rắn tham gia và tạo thành
mn giúp tớ nhanh nha.. tks ạ
Theo dõi (0) 1 Trả lời -


Tính KL thể tích cùa khí SO2 thu được
bởi thùy trang
 15/01/2019
15/01/2019
Đốt cháy 6,4g lưu huỳnh trong bình chứa 2,24 lít Oxi ở ĐKTC. Tính KL thể tích cùa khí \(SO_2\) thu được
Theo dõi (0) 1 Trả lời -


1.1 (g) hỗn hợp bột Fe va Al tác dụng với 1.28 (g) bột S
a. Viết phương trình phản ứng
b. Tính tỉ lệ % cua Fe va Al trong hỗn hợp.đầu
Theo dõi (0) 1 Trả lời -


Tìm công thức MxOy biết khử 4,06g MxOy bằng CO rồi dẫn khí qua Ca(OH)2 thu được 7g kết tủa?
bởi Đan Nguyên
 30/07/2019
30/07/2019
Khử hoàn toàn 4,06g một oxit kim loại bằng CO ở nhiệt độ cao thành kim loại. Dẫn toàn bộ khí sinh ra vào bình đựng nước vôi trong dư, thấy tạo thành 7g kết tủa. Nếu lấy lượng kim loại sinh ra hòa tan hết vào dung dịch HCl dư thì thu được 1,176 lít khí H2 (đktc). Xác định công thức oxit kim loại.
Theo dõi (0) 1 Trả lời -


Tính V H2 ở đktc
bởi Bình Nguyen
 15/01/2019
15/01/2019
Hòa tan hoàn toàn 4g hỗn hợp khí gồm 1 kim loại(II) và 1 kim loại(III) cần dùng hết 340ml dd HCl 1M
a) Tính V H2 ở đktc
b) Cô cạn dd thu đc ? g muối khan
c) Biết kim loại(III) là nhôm và số mol=5 lần số mol kim loại (II). Tìm Kim loại (II)
Theo dõi (0) 1 Trả lời -


Tính Vdd HCl 0,2M cần để hòa tan hết kim loại này
bởi Choco Choco
 15/01/2019
15/01/2019
Hòa tan hoàn toàn 16,25g kim loại M(chưa rõ hóa trị) vào HCl dư. Khi phản ứng kết thúc thu được 5,6 lít H2 (ở đktc)
a) Xác định M
b) Tính Vdd HCl 0,2M cần để hòa tan hết kim loại này
Theo dõi (0) 1 Trả lời -


Tính % Chi(II) nitrat bị phân hủy
bởi Bo Bo
 15/01/2019
15/01/2019
Nhiệt phân 66,2g Chì(II) nitrat tạo ra 55,4g chất rắn. Tính % Chi(II) nitrat bị phân hủy
Theo dõi (0) 1 Trả lời -


Tính % mỗi kim loại trong hỗn hợp gồm Mg, Al, Cu?
bởi Huong Duong
 30/07/2019
30/07/2019
Dạng bài tập quy về 100, giải theo chương trình của thcs:
Hỗn hợp A gồm kim loại Mg, Al, Cu. Oxi hóa hoàn toàn m (g) A thu được 1,72m (g) hỗn hợp 3 oxit với hóa trị cao nhất của mỗi kim loại. Hòa tan m (g) A bằng dung dịch HCl dư thu được 0,952m (l) khí (đktc). Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp A.
Theo dõi (0) 1 Trả lời -


Tính %mMgO biết cho HCl tác dụng với 6g Mg, MgO thu được 2,24 lít H2?
bởi Nguyễn Thanh Thảo
 30/07/2019
30/07/2019
Cho axit clohidric HCl phản ứng với 6 gam hỗn hợp bột gồm Mg và MgO.
a) Tính thành phần phần trăm khối lượng của MgO có trong hỗn hợp nếu phản ứng tạo ra 2,24 lít khí hidro (đktc)
b) Tính thể tích của dung dịch axit clohidric 20% (D=1,1g/ml) vừa đủ để phản ứng với hỗn hợp đó.
Theo dõi (0) 1 Trả lời -


Hỗn hợp gồmCu, Mg, Al có khối lượng bằng 20 (g).
Cho hỗn hợp này tác dụng với dung dịch HCl dư, lọc phần kết tủa rửa sạch đem nung trong không khí đến khi phản ứng hoàn toàn thu được sản phẩm có khối lượng 16(g). Cho thêm dung dịch NaOH vào phần nước lọc đến dư. Lọc kết tủa rửa sạch nung ở nhiệt độ cao thu được sản phẩm có khối lượng 8(g).
Tính thành phần phần trăm về khối lượng mỗi kim loại trong hỗn hợp?Theo dõi (0) 1 Trả lời -


Tính khối lượng A phản ứng
bởi May May
 15/01/2019
15/01/2019
Đốt cháy 1 hợp chất A cần vừa đủ 8,96 lít O2, sau phản ứng thu được 4,48 lít khí CO2 và 7,2 gam H2O. biết A có tỉ khối hơi so với He= 4, các thể tích khí đo ở đktc
a, Tính khối lượng A phản ứng
b, tính CTPT của A
Theo dõi (0) 1 Trả lời -


Tính m muối khan thu được khi cho 2,81g Fe2O3, MgO, CuO tác dụng với H2SO4 0,1M?
bởi Trần Thị Trang
 30/07/2019
30/07/2019
Hòa tan hoàn toàn 2,81g hỗn hợp gồm Fe2O3,MgO,CuOtacs dụng vừa đủ với 200ml dung dochj H2SO4 0,1M vừa đủ. Cô cạn dung dịch sau phản ứng thì thu được số muối khan là
Mấy bạn giải thích giúp mik với mai nộp rùi
 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Tính tỉ lệ a,b
bởi Nguyễn Trà Giang
 15/01/2019
15/01/2019
Hòa tan a gam Al và b gam Zn bằng dung dịch HCl thu được những thể tích khí Hidro bằng nhau.Tính tỉ lệ a,b
Theo dõi (0) 1 Trả lời -


Phân hợp chất Al2O3 thì có 5,4 gam Al . Vậy khi cho Al2O3 tiếp xúc vs Hcl thì ta được bao nhiêu gam ALCL3
Theo dõi (0) 1 Trả lời -


Tính V biết đốt cháy V bằng O2 thu được 5,32g oxit?
bởi Dell dell
 30/07/2019
30/07/2019
Chia 10 gam hỗn hợp gồm 2 kim loại A,B có hoá trị không đổi thành 2 phần bằng nhau. Phần 1 đốt cháy hoàn toàn cần V lít khí O2 ở đktc, thu được 5,32 gam hỗn hợp 2 oxit. Phần còn lại hoà tan hoàn toàn trong dung dịch hcl (dư) thấy có V' lít khí H2 thoát ra ở đktc và m gam muối clorua. Tính các giá trị: V, V', m?
Theo dõi (0) 1 Trả lời -


Thể tích Pb(NO3)2 20% (có d=1,1 g/ml) tối thiểu cần dùng để hấp thụ khí B là?
bởi An Nhiên
 30/07/2019
30/07/2019
Nung nóng hh gồm \(11,2g\) \(Fe\) ;\(6,4g\) \(Cu\); \(19,5g\) \(Zn\) với lượng dư \(S\) đến khi pư hoàn toàn. Sản phẩm của phản ứng tác dụng với HCl dư thu đc khí B
Thể tích dd Pb(NO3)2 20% (có d=1,1 g/ml) tối thiểu cần dùng để hấp thụ khí B là?
Theo dõi (0) 1 Trả lời -


Tính nồng độ % của dd thu được sau pứ Na, Na2O + H2O
bởi Mai Thuy
 01/10/2018
01/10/2018
Cho 9.6 g Na và 9.3 g Na2O vào 100g nc tính nồng độ % của dd thu đc sau pứ
Theo dõi (0) 2 Trả lời -


Viết PTHH khi cho kẽm tác dụng với HCl?
bởi Mai Đào
 30/07/2019
30/07/2019
Bài 1: Cho 6,5g Kẽm tdung htoan trong 146g dd HCl tạo muối kẽm clrua và khí H2.
a, vt pthh xảy ra
b, tính mHCl tham gia p/ung
c,Tính nồng độ % dd HCl tham gi p/ung
d,tính nồng độ muối tạo thành sau p/ung
Bài 2: Cho3,55g P205 vào nước được dd A
a, Dd A thuộc hợp chất gì? đọc tên
b, Tính nồng độ % và nồng độ M của dd A.Biết sự hòa tan ko làm thay đổi Vdd.
Theo dõi (0) 1 Trả lời -


Tìm M biết 16,2g M tác dụng đủ với 0,15 mol O2?
bởi Nguyễn Minh Minh
 30/07/2019
30/07/2019
Cho 16,2 gam kim loại M có hoá trị n tác dụng với 0,15 mol O2. Chất rắn thu được sau phản ứng đem hoà tan vào dung dịch HCl dư thấy thoát ra 13,44 lít H2 ở đktc. Kimloại M là
A. Fe. B. Al. C. Ca. D. Mg.
Theo dõi (0) 1 Trả lời -


Tính m biết cho m gam Mg tác dụng với O2 được X, cho X vào HCl thu được 4,48 lít H2 và 47,5g muối?
bởi Thùy Trang
 30/07/2019
30/07/2019
cho m gam Mg tác dụng với oxi dư (H=80%) thu được chất rắn X. Hòa tan hoàn toàn X vào trong HCl dư thì thu được 4,48 lít khí H2 và 47,5 gam muối MgCl2. Tính m
Theo dõi (0) 1 Trả lời -


Cho 3,5g zn tac dung voi HCL du.Tinh the tich khi H2 thu duoc(dktc)
Theo dõi (0) 1 Trả lời -


Tính m muối thu được biết cho 16g (Mg, Al, Fe) vào 25,55g HCl thu được 6,72 lít H2?
bởi Thanh Nguyên
 30/07/2019
30/07/2019
Cho 16 gam hỗn hợp X gồm 3 kim loại Mg, Al, Fe vào dung dịch chứa 25,55 gam axit clohidric, phản ứng kết thúc thu được dung dịch A và 6,72 lít khí ( đktc)
a/ Axit clohidric hết hay dư
b/ Cô cạn dung dịch A thu được bao nhiêu gam muối khan?
c/ Dẫn 6,72 lít khí Hiđrô ở trên đi qua ống thủy tinh chứa 16 gam Fe2O3 nung nóng. Sau phản ứng thu được 12,16 gam chất rắn. Tính hiệu suất phản ứng
Mn giải giúp mình với (gửi cả lời giải giúp minh với )..... Ths trước
Theo dõi (0) 1 Trả lời -


Ngâm một lá sắt có khối lượng 2,5 gam trong 25 ml dung dịch CuSO4 15% có khối lượng riêng là 1,12 g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô thì cân nặng 2,58 gam.
a) Hãy viết phương trình hoá học.
b) Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
Theo dõi (0) 1 Trả lời -


Tính mAl tham gia phản ứng với H2SO4 biết sau phản ứng thu được 3,36 lít khí?
bởi bach dang
 30/07/2019
30/07/2019
Cho kloại Al vào dd H2SO4.sau phản ứng thu đựợc 3.36 lit khí..
a.tính khối lựợng nhôm phản ứng.
b.cho 4.05g Al vào dd axit trên có chứa 29.4g H2SO4 thì sau phản ứng chất nào dư và dư bao nhiêu.
c.nếu thay Al bằng kim loại có hóa trị 2 cho phản ứng hết voi lựợng axít trên thì sau phản ứng thu được 48.3 g muối.xác địh kim loại trên..
Theo dõi (0) 1 Trả lời -


Viết PTHH khi đốt cháy Zn trong không khí?
bởi Nguyễn Thị Thúy
 30/07/2019
30/07/2019
đốt cháy hoàn toàn 19,5g Zn trong không khí.
a) lập PTPƯ. Tính khối lượng kẽm oxits xinh ra.
b) tính V oxi cần dùng .
c) Nếu đem lượng khí oxi trên để đốt cháy trong 2.24 lít khí hidro (đktc). Tinh khối lượng chất thu được sau phản ứng.
Theo dõi (0) 1 Trả lời -


Tính m chất có trong hỗn đầu biết 21g Al, Al2O3 tác dụng với HCl thu được 13,44 lít H2?
bởi sap sua
 30/07/2019
30/07/2019
đốt cháy 21 gam hỗn hợp bột nhôm và nhôm oxit tác dụng với dung dịch HCL làm thoát ra 13,44 lít k (đktc)
a tính khối lượng chất có trong hỗn hợp ban đầu
b, tính \(V_{ddHCl}\) 36% có d=1,18 để vừa đủ hoà tan hỗn hợp đóTheo dõi (0) 1 Trả lời -


đốt cháy 2,7gam nhôm bằm khí oxi rồi lấy sản phẩm thu được hoà tan trong dung dịch HCL 14,6%
a, viết pt pứngb, tính thể tích oxi ở đktc đã dùngc, tính khối lượng dd HCL vừa đủ để pứTheo dõi (0) 1 Trả lời -


Tính khối lượng oxi cần dùng để đốt cháy
bởi Lê Minh Trí
 15/01/2019
15/01/2019
tính khối lượng oxi cần dùng để đốt cháy hoàn toàn
a) một tấn than chứa 95% cacbon. các tạp chất còn lại ko cháy
b) 4 kg khí metan(CH4) tinh khiết
giúp tôi

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


tính khối lượng oxi điều chế được khi nung nóng 24,5 kg KNO3
 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Có phương trình hóa học sau:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
a) Tính khối lượng canxi clorua thu được khi cho 10 g canxi cacbonat tác dụng với axit clohiđric dư
b) Tính thể tích khí cacbonic thu được trong phòng thí nghiệm, nếu có 5 g canxi cacbonat tác dụng hết với axit. Biết 1 mol khí ở điều kiện phòng có thể tích là 24 lít.
Theo dõi (0) 1 Trả lời -


Tính m Al, Fe tác dụng với 250ml H2SO4 loãng biết sau phản ứng thu được 72,2g muối và 12,32 lít khí?
bởi Nhat nheo
 30/07/2019
30/07/2019
cho m (g) hon hop X gom Al va Fe tac dung voi 250 ml dd H2SO4 loang thu duoc 72.2 (g) hon hop muoi va 12.32 lit khi (dktc)
a) tinh % khoi luong tung chat trong X
b) tinh Cm dung dich H2SO4 da dung biet dung du 5% so voi phan ung
Theo dõi (0) 1 Trả lời -


Viết PTHH khi hòa tan SO3 vào nước?
bởi Bo Bo
 30/07/2019
30/07/2019
Cho 24g SO3 tan hoàn toàn vào nước thu được 500ml dung dịch axit H2SO4
a,viết PTHH
b,tính nồng độ mol của dung dịch
c,tính khối lượng nhôm đủ để phản ứng hết với lượng axit có trong dung dịch
Theo dõi (0) 1 Trả lời -


Tính % kim loại biết cho 2,52g Al, Fe, Cu vào HCl dư thu được 0,3g chất rắn?
bởi Nguyễn Trà Giang
 30/07/2019
30/07/2019
Cho 2,52 g hỗn hợp gồm Al Fe Cu vào dd HCl dư. Phản ứg thu đc 0,3g chất rắn là Cu và 1,344l Hiđro ở đktc.
A. Tính tp% của kim loại trog hỗn hợp ban đầu
B. Tính C%của 200g dd HCl Cần dùng
Các cậu giúp mình vs nhé. Cảm ơn nhìu nhìu nha nha nha ^^
Theo dõi (0) 1 Trả lời





