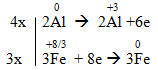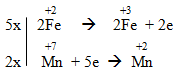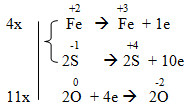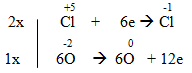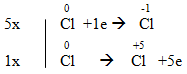Nội dung bài giảng Luyện tập: Phản ứng oxi hóa - khử ôn tập lại kiến thức về Chất khử, chất oxi hoá, sự khử, sự oxi hoá, Phản ứng oxi hoá- khử, Phân loại phản ứng trong hoá học vô cơ.
Tóm tắt lý thuyết
1.1. Khái niệm về Chất khử, chất oxi hóa, sự khử, sự oxi hóa
- Chất khử: Chất nhường e → Số oxi hoá tăng
- Chất oxi hoá: Chất nhận e → Số oxi hoá giảm
- Sự khử: Sự nhận e → Làm giảm số oxi hoá
- Sự oxi hoá: Sự nhường e → Làm tăng số oxi hoá
1.2. Mối quan hệ giữa sự khử và sự oxi hóa
Sự khử và sự oxi hoá luôn xảy ra đồng thời → Đó là phản ứng oxi hoá khử
1.3. Định nghĩa về phản ứng oxi hóa khử
Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất phản ứng, hay phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
1.4. Phân loại phản ứng hóa học vô cơ
Dựa vào số oxi hoá, phản ứng hoá học chia làm 2 loại: Phản ứng oxi hoá khử và phản ứng không thuộc loại phản ứng oxi hoá khử
Bài tập minh họa
Bài 1:
Lập phương trình hóa học của các phản ứng oxi hóa khử sau đây:
a) Al + Fe3O4 → Al2O3 + Fe
b) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
c) FeS2 + O2 → Fe2O3 + SO2
d) KClO3 → KCl + O2
e) Cl2 + KOH → KCl + KClO3 + H2O
Hướng dẫn:
a) 8Al + 3Fe3O4 → 4Al2O3 + 9Fe
b) 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 +2MnSO4 + K2SO4 + 8H2O
c) 4FeS2 +11 O2 → 2Fe2O3 + 8SO2
d) 2KClO3 → 2KCl + 3O2
e) 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
3. Luyện tập Bài 19 Hóa học 10
Sau bài học cần nắm: kiến thức về Chất khử, chất oxi hoá, sự khử, sự oxi hoá, Phản ứng oxi hoá- khử, Phân loại phản ứng trong hoá học vô cơ.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Luyện tập: Phản ứng oxi hóa - khử có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. 2KClO3 \(\overset{t^0}{\rightarrow}\) 2KCl + 3O2.
- B. 2NaOH + Cl2 → NaCl + NaClO + H2O.
- C. 4Fe(OH)2 + O2 \(\overset{t^0}{\rightarrow}\) 2Fe2O3 + 4H2O.
- D. CaCO3 \(\overset{t^0}{\rightarrow}\) CaO + CO2.
-
Câu 2:
Cho phương trình hóa học (với a, b, c, d là các hệ số):
aFe2O3 + b Al → cAl2O3 + dFe
Tỉ lệ a : c là?
- A. 2 : 1.
- B. 1 : 2.
- C. 1 : 1.
- D. 3 : 1.
-
- A. 3 : 8.
- B. 1 : 3.
- C. 3 : 5.
- D. 3 : 10.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Luyện tập: Phản ứng oxi hóa - khử.
Bài tập 1 trang 88 SGK Hóa học 10
Bài tập 2 trang 89 SGK Hóa học 10
Bài tập 3 trang 89 SGK Hóa học 10
Bài tập 4 trang 89 SGK Hóa học 10
Bài tập 5 trang 89 SGK Hóa học 10
Bài tập 6 trang 89 SGK Hóa học 10
Bài tập 7 trang 89 SGK Hóa học 10
Bài tập 8 trang 89 SGK Hóa học 10
Bài tập 9 trang 90 SGK Hóa học 10
Bài tập 10 trang 90 SGK Hóa học 10
Bài tập 11 trang 90 SGK Hóa học 10
Bài tập 12 trang 90 SGK Hóa học 10
Bài tập 19.1 trang 46 SBT Hóa học 10
Bài tập 19.2 trang 46 SBT Hóa học 10
Bài tập 19.3 trang 47 SBT Hóa học 10
Bài tập 19.4 trang 47 SBT Hóa học 10
Bài tập 19.5 trang 47 SBT Hóa học 10
Bài tập 19.6 trang 48 SBT Hóa học 10
Bài tập 19.7 trang 48 SBT Hóa học 10
Bài tập 19.8 trang 48 SBT Hóa học 10
Bài tập 19.9 trang 48 SBT Hóa học 10
Bài tập 19.10 trang 48 SBT Hóa học 10
Bài tập 19.11 trang 48 SBT Hóa học 10
Bài tập 19.12 trang 49 SBT Hóa học 10
Bài tập 19.13 trang 49 SBT Hóa học 10
Bài tập 19.14 trang 49 SBT Hóa học 10
Bài tập 19.15 trang 49 SBT Hóa học 10
Bài tập 1 trang 112 SGK Hóa học 10 nâng cao
Bài tập 2 trang 112 SGK Hóa học 10 nâng cao
Bài tập 3 trang 112 SGK Hóa học 10 nâng cao
Bài tập 4 trang 112 SGK Hóa học 10 nâng cao
Bài tập 5 trang 112 SGK Hóa học 10 nâng cao
Bài tập 6 trang 113 SGK Hóa học 10 nâng cao
Bài tập 7 trang 113 SGK Hóa học 10 nâng cao
Bài tập 8 trang 113 SGK Hóa học 10 nâng cao
Bài tập 9 trang 113 SGK Hóa học 10 nâng cao
Bài tập 10 trang 113 SGK Hóa học 10 nâng cao
Bài tập 11 trang 113 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 19 Chương 4 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.