Bài giảng hệ thống hóa kiến thức về tính chất hóa học và phương pháp điều chế Anđehit, Axit cacboxylic. Vận dụng tốt các tính chất hóa học để nhận biết các chất và giải các bài tập liên quan.
Tóm tắt lý thuyết
1.1. Các định nghĩa
- Anđehit là hợp chất hữu cơ phân tử có chứa nhóm –CH=O liên kết trực tiếp với gốc hidrocacbon hay nguyên tử H
- Xeton là hợp chất hữu cơ có chứa nhóm >C=O liên kết trực tiếp với 2 gốc hidrocacbon.
- Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
1.2. Cấu tạo, Phân loại, Danh pháp
| Anđehit | Axit | |
| Cấu tạo |
R-CHO Với: CXHY- ; H- ; -CHO |
R-COOH Với CXHY- ;H- ; -COOH |
| Tên thay thế |
Mạch chính đánh số từ nhóm chức –CHO Tên = Tên của hidrocacbon tương ứng với mạch chính + al |
Mạch chính đánh số từ nhóm chức –COOH Tên = Axit + tên của hidrocacbon tương ứng với mạch chính + oic |
| Phân loại |
- Theo đặc điểm cấu tạo của R: no, không no, thơm - Theo số nhóm chức trong phân tử: đơn chức, đa chức |
|
| Điều chế |
-Ancol bậc I → Anđehit → Axit cacboxylic -Oxi hóa hidrocacbon |
|
1.3. Tính chất
|
|
Anđehit - Xeton |
Axit cacboxylic |
|
Tính chất |
a) Andehit có tính khử và tính oxi hóa - Tính oxi hóa: R-CH=O + H2 - Tính khử: R-CHO + 2AgNO3+ H2O + 3NH3 R-COONH4 + 2NH4NO3 + 2Ag b) Xeton có tính oxi hóa R-CO-R’ + H2
|
- Trong dung dịch, axit cacboxylic phân ly thành ion - Tác dụng với oxit bazơ, bazơ, dung dịch muối và kim loại đứng trước H trong dãy hoạt động hóa học - Tác dụng với ancol tạo thành este
|
1.4. Điều chế
Điều chế Anđehit - xeton
a. Từ ancol tạo Anđehit
R – CH2OH + CuO \(\overset{t^{0}}{\rightarrow}\) R – CHO + Cu + H2O
Ví dụ: CH3–CH2OH + CuO \(\overset{t^{0}}{\rightarrow}\) CH3CHO + Cu + H2O
b. Từ Hidrocacbon tạo Anđehit
- Từ Metan: CH4 + O2 \(\overset{xt,t^{0}}{\rightarrow}\) H-CH=O + H2O
(Fomanđehit)
- Từ Etilen: 2CH2 = CH2 + O2 \(\overset{xt,t^{0}}{\rightarrow}\) 2 CH3 – CH=O
(Axetanđehit)
c. Từ ancol tạo Xeton
R – CH(OH) – R’ + CuO \(\overset{t^{0}}{\rightarrow}\) R – CO – R’ + Cu + H2O
Ví dụ: CH3–CO–CH3 +CuO \(\overset{t^{0}}{\rightarrow}\) CH3–CHOH–CH3 + Cu+ H2O
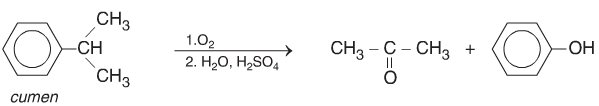
d. Từ Hidrocacbon tạo Xeton
Oxi hóa không hoàn toàn Cumen thu được axeton và Phenol theo sơ đồ:
Điều chế Axit cacboxylic
a. Phương pháp lên men giấm
\({C_2}{H_5}OH + {O_2}\)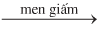
b. Oxi hóa anđehit axetic
\(C{H_3}CHO + {O_2}\overset{xt}{\rightarrow}C{H_3}COOH\)
c. Oxi hóa Ankan
\(2C{H_3}C{H_2}C{H_2}C{H_3} +5{O_2}\xrightarrow[180^{0}C, 50 atm]{xt}4C{H_3}COOH + 2{H_2}O\)
d. Từ metanol
\(C{H_3}OH + CO\overset{t^{0},xt}{\rightarrow}C{H_3}{\rm{COOH}}\)
Bài tập minh họa
2.1. Bài tập Anđehit, Xeton , Axit cacboxylic - Cơ bản
Bài 1:
Cho 3,6 gam anđehit đơn chức X phản ứng hoàn toàn với một lượng dư AgNO3 trong dung dịch NH3, đun nóng, thu được m gam Ag. Hoà tan hoàn toàn m gam Ag bằng dung dịch HNO3 đặc, sinh ra 2,24 lít NO2 (sản phẩm khử duy nhất, ở đktc). Công thức của X là:
Hướng dẫn:
Ag + 2HNO3 → AgNO3 + H2O + NO2
0,1 \(\overset{\ }{\leftarrow}\) 0,1
TH1: X là HCHO ⇒ nHCHO = 0,1 : 4 = 0,025 mol ⇒ mX = 0,75g < 3,6
⇒ loại
TH2: X là RCHO ⇒ nRCHO = 0,1 : 2 = 0,05 ⇒ MRCHO = 3,6 : 0,05 = 72
⇒ MR = 43 ⇒ R là C3H7
Bài 2:
Cho hỗn hợp HCHO và H2 đi qua ống đựng bột Ni nung nóng, thu được hỗn hợp X.Dẫn toàn bộ sản phẩm thu được vào bình đựng nước lạnh thấy khối lượng bình tăng 11,8 gam.Lấy toàn bộ dung dịch trong bình cho tác dụng dung dịch AgNO3 trong dung dịch NH3 dư tạo ra 21,6 gam Ag.Khối lượng ancol có trong X là:
Hướng dẫn:
Ancol thu được là CH3OH
Khối lượng bình nước tăng bao gồm khối lượng của CH3OH và HCHO dư
Khi cho toàn bộ dung dịch trong bình vào AgNO3/NH3 chỉ có HCHO tác dụng
\(n_{HCHO}=\frac{1}{4}n_{Ag}=0,05gam\)
\(\Rightarrow m_{HCHO}=1,5 gam\)
\(m_{CH_{3}OH}=11,8-1,5=10,3gam\)
Bài 3:
Hỗn hợp X chứa ba axit cacboxylic đều đơn chức, mạch hở, gồm một axit no và hai axit không no đều có một liên kết đôi (C=C). Cho m gam X tác dụng vừa đủ với 150 ml dung dịch NaOH 2M, thu được 25,56 gam hỗn hợp muối. Đốt cháy hoàn toàn m gam X, hấp thụ toàn bộ sản phẩm cháy bằng dung dịch NaOH dư, khối lượng dung dịch tăng thêm 40,08 gam. Tổng khối lượng của hai axit cacboxylic không no trong m gam X là:
Hướng dẫn:
Số mol NaOH = 0,3 mol ⇒ Số mol O (axit) = 0,6 mol
BTKL ta có: mX = 18,96 gam
Đặt số mol CO2: x mol; số mol H2O: y mol
Ta có hệ pt: \(\left\{\begin{matrix} 44x + 18y = 40,08 \ \ \ \ \\ 12x + y = 18,96 - 9,6 \end{matrix}\right.\rightarrow \left\{\begin{matrix} x = 0,69 \\ y = 0,54 \end{matrix}\right.\)
⇒ Số mol aixt không no = 0,15; số mol axit no = 0,15
⇒ Số nguyên tử cacbon trung bình = 2,3; số nguyên tử hidro trung bình = 3,6 ⇒ Có HCOOH
Vậy khối lượng của 2 axit không no trong hỗn hợp X = 18,96 - 0,15.46 = 12,06 gam
2.2. Bài tập Anđehit, Xeton, Axit cacboxylic - Nâng cao
Bài 1:
X là hỗn hợp gồm HOOC-COOH, OHC-COOH, OHC-C≡C-CHO, OHCC≡C-COOH; Y là axit cacboxylic no, đơn chức, mạch hở. Đun nóng m gam X với lượng dư dung dịch AgNO3 trong NH3, thu được 23,76 gam Ag. Nếu cho m gam X tác dụng với NaHCO3 dư thì thu được 0,07 mol CO2. Đốt cháy hoàn toàn hỗn hợp gồm m gam X và m gam Y cần 0,805 mol O2, thu được 0,785 mol CO2. Giá trị của m là:
Hướng dẫn:
Gọi số mol C trong X là x và số mol C trong Y là y
Ta có: \(n_{CO_2} = x + y = 0,785\ mol\)
Gọi số mol 4 chất trong X lần lượt là: a, b, c, d
nAg = 0,22 mol ⇒ nCHO = 0,22 = 2b + 4c + 2d ⇒ b + 2c + d = 0,11
Lại có: \(n_{CO_2} = n_{COOH} = 2a + b + d = 0,07\)
⇒ a + b + c + d = 0,09 mol = nX = 2nH
⇒ Trong X có: x mol C; 0,18 mol H; 0,29 mol O
Khi đốt cháy do Y no đơn hở ⇒ \(n_{CO_2} = n_{H_2O} = y\ mol\)
Bảo toàn khối lượng cho phản ứng cháy:
2(12x + 0,18 + 0,29 × 16) + 0,805 × 32 = 0,785 × 44 + 18(0,09 + y)
⇒ 24x – 18y = 2,04 g
⇒ x = 0,385 mol; y = 0,4 mol
⇒ m = 8,8 g
Bài 2:
Chia 10,4 gam hỗn hợp gồm hai anđehit đơn chức là đồng đẳng kế tiếp thành hai phần bằng nhau:
- Phần một tác dụng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 đun nóng, thu được 54 gam Ag.
- Phần hai tác dụng hoàn toàn với H2 dư (xúc tác Ni, t0), thu được hỗn hợp X gồm hai ancol Y và Z (MY < MZ). Đun nóng X với H2SO4 đặc ở 1400C, thu được 2,26 gam hỗn hợp ba ete. Biết hiệu suất phản ứng tạo ete của Z bằng 60%. Hiệu suất phản ứng tạo ete của Y bằng?
Hướng dẫn:
Nếu trong hỗn hợp không có H-CHO thì số mol trong phần 1 là 0,25 mol nên tổng là 1 mol ⇒ M trung bình = 20,8 ⇒ Loại
Vậy 2 andehit là HCHO (x mol) và CH3-CHO (y mol) (số mol trong hỗn hợp ban đầu)
Lập hệ ta có: 30x + 44y = 10,4; (4x + 2y)/2 = 0,5
⇒ x = 0,2; y = 0,1 mol
Vậy phần 2 có 0,1 mol HCHO; 0,05 mol CH3CHO tạo ra 0,1 mol CH3OH và phản ứng x mol; 0,05 mol CH3CH2OH và phản ứng 0,03 mol.
Số mol H2O = ½ tổng số mol ancol.
Bảo toàn khối lượng ta có:
\(\\ \frac{32.x + 46.0,03 - 18.(0,03 + x)}{2} = 2,26 \Rightarrow x = 0,05 \\ H = \frac{0,05}{0,1}=50 \ \%\)
3. Luyện tập Bài 46 Hóa học 11
Sau bài học cần nắm:
- Cấu tạo, Phân loại, Danh pháp Axit cacboxylic
- Tính chất và điều chế Axit cacboxylic
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 46 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. 9.
- B. 6.
- C. 7.
- D. 8.
-
- A. T cho được phản ứng tráng bạc
- B. X được điều chế trực tiếp từ ancol etylic
- C. Y tạo kết tủa trắng với nước brom
- D. Z tạo kết tủa trắng với dung dịch AgNO3
-
- A. 2.
- B. 4.
- C. 5.
- D. 3.
-
- A. HCOOCH3.
- B. CH3OH.
- C. C2H5OH.
- D. CH3CHO.
-
- A. 55,2.
- B. 80,36.
- C. 61,78.
- D. 21,6.
-
- A. CH3CHO.
- B. CH2(CHO)2.
- C. OHC-CHO.
- D. C2H4(CHO)2.
-
- A. 35,8%.
- B. 43,4%.
- C. 26,4%.
- D. 27,3%.
Câu 8-20: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 46.
Bài tập 1 trang 212 SGK Hóa học 11
Bài tập 2 trang 212 SGK Hóa học 11
Bài tập 3 trang 212 SGK Hóa học 11
Bài tập 4 trang 212 SGK Hóa học 11
Bài tập 5 trang 212 SGK Hóa học 11
Bài tập 6 trang 213 SGK Hóa học 11
Bài tập 7 trang 213 SGK Hóa học 11
Bài tập 8 trang 213 SGK Hóa học 11
Bài tập 9 trang 213 SGK Hóa học 11
Bài tập 10 trang 213 SGK Hóa học 11
Bài tập 46.1 trang 73 SBT Hóa học 11
Bài tập 46.2 trang 74 SBT Hóa học 11
Bài tập 46.3 trang 74 SBT Hóa học 11
Bài tập 46.4 trang 74 SBT Hóa học 11
Bài tập 46.5 trang 74 SBT Hóa học 11
Bài tập 46.6 trang 74 SBT Hóa học 11
Bài tập 46.7 trang 74 SBT Hóa học 11
Bài tập 46.8 trang 75 SBT Hóa học 11
Bài tập 46.9 trang 75 SBT Hóa học 11
Bài tập 46.10 trang 75 SBT Hóa học 11
Bài tập 46.11 trang 75 SBT Hóa học 11
Bài tập 46.12 trang 75 SBT Hóa học 11
Bài tập 46.13 trang 76 SBT Hóa học 11
Bài tập 46.14 trang 76 SBT Hóa học 11
Bài tập 46.15 trang 76 SBT Hóa học 11
Bài tập 46.16 trang 76 SBT Hóa học 11
Bài tập 46.17 trang 76 SBT Hóa học 11
Bài tập 1 trang 246 SGK Hóa học 11 nâng cao
Bài tập 2 trang 246 SGK Hóa học 11 nâng cao
Bài tập 3 trang 246 SGK Hóa học 11 nâng cao
Bài tập 4 trang 246 SGK Hóa học 11 nâng cao
Bài tập 5 trang 146 SGK Hóa học 11 nâng cao
Bài tập 6 trang 246 SGK Hóa học 11 nâng cao
Bài tập 7 trang 246 SGK Hóa học 11 nâng cao
Bài tập 8 trang 246 SGK Hóa học 11 nâng cao
Bài tập 9 trang 247 SGK Hóa học 11 nâng cao
Bài tập 10 trang 247 SGK Hóa học 11 nâng cao
Bài tập 11 trang 247 SGK Hóa học 11 nâng cao
Bài tập 12 trang 247 SGK Hóa học 11 nâng cao
Bài tập 1 trang 259 SGK Hóa học 11 nâng cao
Bài tập 2 trang 260 SGK Hóa học 11 nâng cao
Bài tập 3 trang 260 SGK Hóa học 11 nâng cao
Bài tập 4 trang 260 SGK Hóa học 11 nâng cao
Bài tập 5 trang 260 SGK Hóa học 11 nâng cao
Bài tập 6 trang 260 SGK Hóa học 11 nâng cao
Bài tập 7 trang 260 SGK Hóa học 11 nâng cao
Bài tập 8 trang 260 SGK Hóa học 11 nâng cao
Bài tập 9 trang 260 SGK nâng cao Hóa học 11
4. Hỏi đáp về Bài 46 Chương 9 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.


.PNG) R-CH2-OH
R-CH2-OH
.PNG)








