Bài học giúp các em nắm khái niệm Axit cacboxylic là gì, cách phân loại và gọi tên Axit cacboxylic. Biết về cấu tạo, tính chất hóa học hóa học đậc trưng và ứng dụng của Axit cacboxylic.
Tóm tắt lý thuyết
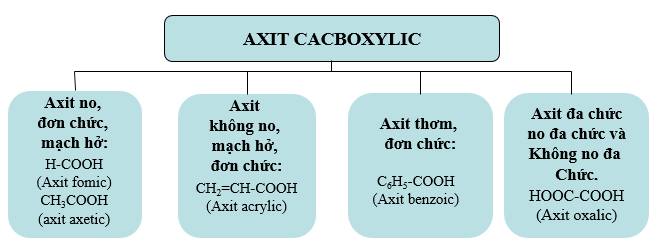
1.1. Định nghĩa, Phân loại, Danh pháp
a. Định nghĩa
- Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
- Ví dụ: H-COOH, CH3-COOH, C6H5-COOH, HOOC-COOH
b. Phân loại
- CTTQ axit no đơn chức mạch hở: CnH2n+1COOH (n≥0) hay CnH2nO2 (n ≥1)
c. Danh pháp
- Cách gọi tên thay thế của các axit no, đơn chức, mạch hở như sau:
- Bước 1: Chọn mạch C dài nhất chứa nhóm -COOH làm mạch chính.
- Bước 2: Đánh số từ Cacbon ở nhóm chức -COOH
- Bước 3: Axit + tên nhánh+vị trí nhánh+tên hidrocacbon no tương ứng với mạch chính + oic
- Ví dụ:
- Bảng 1: Tên gọi một số Axit cacboxylic thông dụng:
|
CTCT |
Tên thường |
Tên thay thế |
| HCOOH |
Axit fomic |
Axit metanoic |
|
CH3-COOH |
Axit axetic |
Axit etanoic |
|
CH3CH2COOH |
Axit propionic |
Axit propanoic |
|
(CH3)2CH-COOH |
Axit isobutiric |
Axit 2-metylpropanoic |
|
CH3(CH2)3COOH |
Axit valeric |
Axit pentanoic |
|
CH2=CH-COOH |
Axit acrylic |
Axit propenoic |
|
HOOC-COOH |
Axit oxalic |
Axit etanđioic |
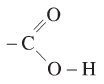
1.2. Đặc điểm cấu tạo
Nhóm cacboxyl có cấu tạo:
-
Nhóm C = O không giống trong anđehit và xeton
-
Nhóm – O – H phân cực hơn nhóm – O – H trong ancol và phenol
-
Tính axit lớn hơn ancol và phenol
1.3. Tính chất vật lí
-
Trạng thái: ở điều kiện thường, axit cacboxylic ở trạng thái lỏng hoặc rắn
-
Nhiệt độ sôi: cao hơn anđehit, xeton và ancol tương ứng có cùng số C
-
Tính tan: do có liên kết hidro với nước, các axit tan được trong nước.
-
Axit có vị chua
1.4. Tính chất hóa học
a. Tính axit
Trong dung dịch, axit cacboxylic phân li thuận nghịch: \(C{H_3}COOH\rightleftharpoons {H^ + } + O{H^ - }\)
b. Tác dụng với bazơ, oxit bazơ
\(\begin{array}{l} C{H_3}COOH + NaOH \to C{H_3}COONa + {H_2}O\\ 2C{H_3}COOH + ZnO \to {\left( {C{H_3}COO} \right)_2}Zn + {H_2}O \end{array}\)
c. Tác dụng với muối
- Các em chú ý quan sát thí nghiệm sau:
- Hiện tượng: Vỏ trứng gà tan ra, có sủi bọt khí không màu.
- Giải thích: \(2C{H_3}COOH + CaC{O_3} \to {\left( {C{H_3}COO} \right)_2}Ca + C{O_2} + {H_2}O\)
d. Tác dụng với kim loại đứng trước hidro
\(Zn{\rm{ }} + {\rm{ }}2C{H_3}COOH{\rm{ }} \to {\rm{ }}{\left( {C{H_3}COO} \right)_2}Zn + {\rm{ }}{H_2} \uparrow\)
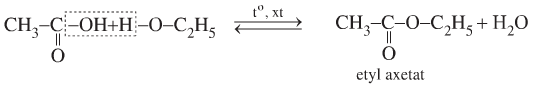
e. Phản ứng thế nhóm -OH
\(RCOOH + R'OH\)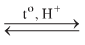
- H2SO4 đặc đóng vai trò là chất xúc tác cho phản ứng. H2SO4 đặc hút nước sinh ra để cân bằng dịch chuyển về phía tạo este.
- Phản ứng este hóa là phản ứng thuận nghịch.
1.5. Điều chế
a. Phương pháp lên men giấm
\({C_2}{H_5}OH + {O_2}\)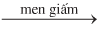
b. Oxi hóa anđehit axetic
\(C{H_3}CHO + {O_2}\overset{xt}{\rightarrow}C{H_3}COOH\)
c. Oxi hóa Ankan
\(2C{H_3}C{H_2}C{H_2}C{H_3} +5{O_2}\xrightarrow[180^{0}C, 50 atm]{xt}4C{H_3}COOH + 2{H_2}O\)
d. Từ metanol
\(C{H_3}OH + CO\overset{t^{0},xt}{\rightarrow}C{H_3}{\rm{COOH}}\)
1.6. Ứng dụng
Bài tập minh họa
2.1. Bài tập Axit Cacboxylic - Cơ bản
Bài 1:
Cho các phản ứng:
2CH3COOH + Ca(OH)2 → (CH3COO)2Ca + 2H2O (1)
2CH3COOH + Ca → (CH3COO)2Ca + H2 (2)
(CH3COO)2Ca + H2SO4 → 2CH3COOH + CaSO4 (3)
(CH3COO)2Ca + Na2CO3 → 2CH3COONa + CaCO3 (4)
Người ta dùng phản ứng nào để tách lấy axit axetic từ hỗn hợp gồm axit axetic và ancol etylic?
Hướng dẫn:
Phản ứng thỏa mãn:
2CH3COOH + Ca(OH)2 → (CH3COO)2Ca + 2H2O (1)
(CH3COO)2Ca + H2SO4 → 2CH3COOH + CaSO4 (3)
Bài 2:
Cho 5,76 gam axit hữu cơ X đơn chức mạch hở tác dụng hết với CaCO3 thu được 7,28 gam muối canxi hữu cơ. Vậy X là?
Hướng dẫn:
Dựa vào phương pháp tăng giảm khối lượng:
\(\Delta m=(40-2)a=7,28-5,76=1,52gam\)
vậy \(n_{Axit}=0,08(mol)\Rightarrow M_{X}=\frac{5,76}{0,08}=72(Axit\hspace{2pt} acrylic)\)
Bài 3:
Để trung hoà 10,6 gam hỗn hợp HCOOH, CH3COOH có tỉ lệ số mol 1:1 cần dùng V lít dung dịch NaOH 1M, Ba(OH)2 0,5M. Vậy giá trị của V là:
Hướng dẫn:
\(\\ n_{HCOOH} = n_{CH_{3}COOH} = 10,6: (46 + 60) = 0,1 \ mol \\ \Rightarrow n_{COOH} = n_{OH^-} = 0,2 \ mol\)
Mà nOH- = V + 2.0,5V = 2V
⇒ V = 0,1 lít = 100ml
Bài 4:
Hỗn hợp X gồm CH3COOH; C2H5COOH; HOOC-CH2-COOH. Để trung hòa hoàn toàn m gam X cần dùng 480ml dung dịch NaOH 1M. Mặt khác đốt cháy hoàn toàn m gam X thì thu được 43,12 gam CO2 và 15,48 gam nước. Giá trị của m là:
Hướng dẫn:
nNaOH = nCOOH = 0,48 mol
Bảo toàn O:
\(\\ 2n_{COOH(X) }+ 2n_{O_{2}} = 2n_{CO_{2}} + n_{H_{2}O} \\ \Rightarrow n_{O_{2}} = 0,93 \ mol\)
Bảo toàn khối lượng:
\(\\ m_{X} + m_{O_{2}} = m_{CO_{2}} + m_{H_{2}O} \\ \Rightarrow m_{X} = m = 28,84 \ g\)
2.2. Bài tập Axit Cacboxylic - Nâng cao
Bài 1:
Cho m gam hỗn hợp axit axetic, axit benzoic, axit adipic, axit oxalic tác dụng vừa đủ với dung dịch NaOH thu được a gam muối. Nếu cũng cho m gam hỗn hợp X nói trên tác dụng với Ca(OH)2 vừa đủ thì thu được b gam muối. Biểu thức liên hệ m, a, b là:
Hướng dẫn:
Cứ 1 mol COOH thì phản ứng tạo thành 1 mol COONa
⇒ x mol COOH sẽ tạo ra x mol COONa
⇒ mtăng = a – m = 23x – x = 22x (1)
Cứ 1 mol COOH phản ứng tạo 0,5 mol (COO)2Ca
Vật x mol COOH tạo 0,5x mol (COO)2Ca
⇒ mtăng = b – m = 0,5x.40 – x = 19x (2)
Từ (1) và (2) ⇒ x = 22(b – m) = 19(a – m)
⇒ 3m = 22b – 19a
Bài 2:
Đốt cháy hoàn toàn 26,72 gam hỗn hợp X gồm axit metacrylic, axit ađipic, axit axetic và glixerol (trong đó số mol axit metacrylic bằng số mol axit axetic) bằng O2 dư, thu được hỗn hợp Y gồm khí và hơi. Dẫn Y vào dung dịch chứa 0,76 mol Ba(OH)2, thu được 98,5 gam kết tủa và dung dịch Z. Đun nóng Z lại xuất hiện kết tủa. Cho 26,72 gam hỗn hợp X tác dụng với 140 ml dung dịch KOH 2M, sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được chất rắn khan có khối lượng là bao nhiêu?
Hướng dẫn:
X gồm C4H6O2; C2H4O2; C3H8O3; C6H10O4
Mà ta thấy do số mol axit metacrylic = số mol axit axetic và tổng số nguyên tử tùng nguyên tố của 2 chất này đúng bằng của axit adipic
⇒ Coi X gồm 2 chất: x mol C3H8O3; y mol C6H10O4
⇒ mX = 92x + 146y = 26,72 g (1)
Khi đốt X ,sau đó cho sản phẩm vào bazo thấy tạo kết tủa và nung nóng dung dịch cũng tạo kết tủa nên chứng tỏ kết tủa tan 1 phần
=> \(n_{CO_2} = n_{OH^-} - n_{BaCO_3}\) = 0,76 × 2 – 0,5 = 1,02 mol = 3x +6 y (2)
⇒ Từ 1 và 2 ⇒ x = 0,1 mol; y = 0,12 mol
Khi cho X + KOH thì chỉ có axit phản ứng
⇒ n KOH phản ứng = 2n axit = 0,24 mol (axit 2 chức)
⇒ n KOH dư = 0,04 mol
⇒ m rắn = m KOH dư + m \(\tiny C_6H_8O_4K_2\) = 28,88g
3. Luyện tập Bài 45 Hóa học 11
Sau bài học cần nắm:
- Khái niệm Axit cacboxylic là gì, cách phân loại và gọi tên Axit cacboxylic.
- Biết về cấu tạo, tính chất hóa học hóa học đậc trưng và ứng dụng của Axit cacboxylic.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 45 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Vôi tôi.
- B. Giấm ăn.
- C. Nước.
- D. Muối ăn.
-
- A. Dung dịch AgNO3/NH3.
- B. Quì tím.
- C. CaCO3.
- D. NaOH.
-
- A. 6 gam
- B. 12 gam
- C. 18 gam
- D. 15 gam
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 45.
Bài tập 1 trang 210 SGK Hóa học 11
Bài tập 2 trang 210 SGK Hóa học 11
Bài tập 3 trang 210 SGK Hóa học 11
Bài tập 4 trang 210 SGK Hóa học 11
Bài tập 5 trang 210 SGK Hóa học 11
Bài tập 6 trang 210 SGK Hóa học 11
Bài tập 7 trang 210 SGK Hóa học 11
Bài tập 45.1 trang 71 SBT Hóa học 11
Bài tập 45.2 trang 71 SBT Hóa học 11
Bài tập 45.3 trang 71 SBT Hóa học 11
Bài tập 45.4 trang 71 SBT Hóa học 11
Bài tập 45.5 trang 71 SBT Hóa học 11
Bài tập 45.6 trang 71 SBT Hóa học 11
Bài tập 45.7 trang 71 SBT Hóa học 11
Bài tập 45.8 trang 72 SBT Hóa học 11
Bài tập 45.9 trang 72 SBT Hóa học 11
Bài tập 45.10 trang 72 SBT Hóa học 11
Bài tập 45.11 trang 72 SBT Hóa học 11
Bài tập 45.12 trang 72 SBT Hóa học 11
Bài tập 45.13 trang 72 SBT Hóa học 11
Bài tập 45.14 trang 73 SBT Hóa học 11
Bài tập 45.15 trang 73 SBT Hóa học 11
Bài tập 45.16 trang 73 SBT Hóa học 11
Bài tập 1 trang 250 SGK Hóa học 11 nâng cao
Bài tập 2 trang 250 SGK Hóa học 11 nâng cao
Bài tập 3 trang 251 SGK Hóa học 11 nâng cao
Bài tập 4 trang 251 SGK Hóa học 11 nâng cao
Bài tập 5 trang 251 SGK Hóa học 11 nâng cao
Bài tập 1 trang 256 SGK Hóa học 11 nâng cao
Bài tập 2 trang 256 SGK Hóa học 11 nâng cao
Bài tập 3 trang 256 SGK Hóa học 11 nâng cao
Bài tập 4 trang 256 SGK Hóa học 11 nâng cao
Bài tập 5 trang 257 SGK Hóa học 11 nâng cao
Bài tập 6 trang 257 SGK Hóa học 11 nâng cao
Bài tập 7 trang 257 SGK Hóa học 11 nâng cao
Bài tập 8 trang 257 SGK Hóa học 11 nâng cao
Bài tập 9 trang 257 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 45 Chương 9 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.


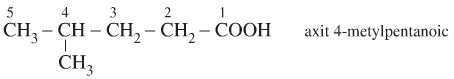
.PNG)