Nß╗Öi dung b├Āi hß╗Źc tr├¼nh b├Āy c├Īc phŲ░ŲĪng ph├Īp ─æ├Ż ─æŲ░ß╗Żc kiß╗ām chß╗®ng bß║▒ng thß╗▒c nghiß╗ćm ─æß╗ā ß╗®ng dß╗źng v├Āo viß╗ćc Nhß║Łn biß║┐t mß╗Öt sß╗æ ion trong dung dß╗ŗch bao gß╗ōm Cation (Na+, NH4+, Ba2+, Al3+, Fe2+, Fe3+, Cu2+) v├Ā Anion (NO3-, SO42-,Cl-,CO32-)
T├│m tß║»t l├Į thuyß║┐t
2.1. Nguy├¬n tß║»c nhß║Łn biß║┐t ion trong dung dß╗ŗch
Dung dß╗ŗch chß╗®a ion + Thuß╗æc thß╗Ł:
- Chß║źt kß║┐t tß╗¦a
- Sß║Żn phß║®m c├│ m├Āu
- Chß║źt kh├Ł kh├│ tan sß╗¦i bß╗Źt
- Chß║źt kh├Ł bay khß╗Åi dung dß╗ŗch
2.2. Nhß║Łn biß║┐t mß╗Öt sß╗æ Cation trong dung dß╗ŗch
a. Bß║Żng nhß║Łn biß║┐t
| Cation | Thuß╗æc thß╗Ł | Hiß╗ćn tŲ░ß╗Żng | Giß║Żi th├Łch |
| Na+ |
Thß╗Ł m├Āu ngß╗Źn lß╗Ła |
Ngß╗Źn lß╗Ła c├│ m├Āu v├Āng tŲ░ŲĪi |
Ion Na+ hß║¦u nhŲ░ kh├┤ng kß║┐t tß╗¦a vß╗øi c├Īc anion kh├Īc |
| NH4+ |
Dung dß╗ŗch kiß╗üm |
Tß║Īo kh├Ł NH3 c├│ m├╣i khai |
\({\rm{NH}}_{\rm{4}}^{\rm{ + }}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{N}}{{\rm{H}}_{\rm{3}}} \uparrow {\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) |
| Ba2+ |
Dung dß╗ŗch H2SO4 dŲ░ |
Kß║┐t tß╗¦a m├Āu trß║»ng | \({\rm{B}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + SO}}_{\rm{4}}^{{\rm{2 - }}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow\) |
| Al3+ |
Dd kiß╗üm hoß║Ęc NH3 |
Kß║┐t tß╗¦a keo trß║»ng tan trong OH- dŲ░ |
\({\rm{A}}{{\rm{l}}^{{\rm{3 + }}}}{\rm{ + 3O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{Al(OH}}{{\rm{)}}_{\rm{3}}} \downarrow\) \({\rm{Al(OH}}{{\rm{)}}_{\rm{3}}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{AlO}}_{\rm{2}}^{\rm{ - }}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) |
| Fe3+ |
Dung dß╗ŗch kiß╗üm |
Kß║┐t tß╗¦a n├óu ─æß╗Å |
\({\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + 3O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{Fe(OH}}{{\rm{)}}_{\rm{3}}} \downarrow\) |
| Fe2+ |
Dung dß╗ŗch kiß╗üm |
Kß║┐t tß╗¦a trß║»ng xanhŌåÆ─æß╗Å n├óu |
\({\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + 2O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{Fe(OH}}{{\rm{)}}_2} \downarrow\) \({\rm{4Fe(OH}}{{\rm{)}}_{\rm{2}}}{\rm{ + }}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{4Fe(OH}}{{\rm{)}}_{\rm{3}}} \downarrow\) |
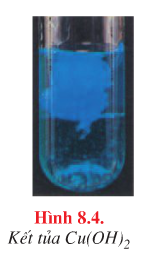
| Cu2+ |
Dung dß╗ŗch kiß╗üm |
Kß║┐t tß╗¦a xanh |
\({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2O}}{{\rm{H}}^{\rm{ - }}} \to {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \downarrow\) |
b. M├Āu sß║»c cß╗¦a mß╗Öt sß╗æ kß║┐t tß╗¦a
2.3. Nhß║Łn biß║┐t mß╗Öt sß╗æ Anion trong dung dß╗ŗch
a. Bß║Żng nhß║Łn biß║┐t
| Anion | Thuß╗æc thß╗Ł | Hiß╗ćn tŲ░ß╗Żng | Giß║Żi th├Łch |
|
NO3- |
Cu / H+ |
Dd c├│ m├Āu xanh, kh├Ł tho├Īt ra h├│a n├óu trong kh├┤ng kh├Ł. |
\({\rm{3Cu + 2NO}}_{\rm{3}}^{\rm{ - }}{\rm{ + 8}}{{\rm{H}}^{\rm{ + }}} \to{\rm{3C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2NO}} \uparrow {\rm{ + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) \({\rm{2NO + }}{{\rm{O}}_{\rm{2}}} \to {\rm{2N}}{{\rm{O}}_{\rm{2}}}\) nâu đỏ |
| SO42- |
Dd Ba2+/ H+ dŲ░ |
Kß║┐t tß╗¦a trß║»ng |
\({\rm{B}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + SO}}_{\rm{4}}^{{\rm{2 - }}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow\) |
| Cl- | Dung dß╗ŗch AgNO3 |
Kß║┐t tß╗¦a trß║»ng |
\({\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{ + C}}{{\rm{l}}^ - } \to {\rm{AgCl}} \downarrow\) |
| CO32- |
Dd axit mß║Īnh/ Ca(OH)2 |
Kß║┐t tß╗¦a trß║»ng |
\({\rm{CO}}_{\rm{3}}^{{\rm{2 - }}}{\rm{ + 2}}{{\rm{H}}^{\rm{ + }}} \to {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow {\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) \({\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{ + Ca(OH}}{{\rm{)}}_{\rm{2}}} \to {\rm{CaC}}{{\rm{O}}_{\rm{3}}} \downarrow {\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) |
B├Āi tß║Łp minh hß╗Źa
3.1. B├Āi tß║Łp Nhß║Łn biß║┐t mß╗Öt sß╗æ ion trong dung dß╗ŗch - CŲĪ bß║Żn
B├Āi 1:
C├│ c├Īc dung dß╗ŗch kh├┤ng m├Āu ─æß╗▒ng trong c├Īc lß╗Ź ri├¬ng biß╗ćt, kh├┤ng d├Īn nh├Żn: ZnSO4, Cu(NO3)2, Al(NO3)3. ─Éß╗ā ph├ón biß╗ćt c├Īc dung dß╗ŗch tr├¬n c├│ thß╗ā d├╣ng thuß╗æc thß╗Ł n├Āo? N├¬u c├Īc hiß╗ćn tŲ░ß╗Żng diß╗ģn ra.
HŲ░ß╗øng dß║½n:
Dùng dd Ba(OH)2 vì:
- ZnSO4 tß║Īo kß║┐t tß╗¦a m├Āu trß║»ng.
\({\rm{Ba(OH}}{{\rm{)}}_{\rm{2}}}{\rm{ + ZnS}}{{\rm{O}}_{\rm{4}}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow {\rm{ + Zn(OH}}{{\rm{)}}_{\rm{2}}}\)
- Cu(NO3)2 tß║Īo kß║┐t tß╗¦a m├Āu xanh.
\({\rm{Cu(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}{\rm{ + Ba(OH}}{{\rm{)}}_{\rm{2}}} \to {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \downarrow {\rm{ + Ba(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}\)
- Al(NO3)3 tß║Īo kß║┐t tß╗¦a keo.
\({\rm{Al(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{3}}}{\rm{ + Ba(OH}}{{\rm{)}}_{\rm{2}}} \to {\rm{Al(OH}}{{\rm{)}}_{\rm{3}}} \downarrow {\rm{ + Ba(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}\)
B├Āi 2:
Tr├¼nh b├Āy c├Īch nhß║Łn biß║┐t c├Īc dung dß╗ŗch trong suß╗æt, trong lß╗Ź mß║źt nh├Żn sau: HCl,HNO3, H2SO4 bß║▒ng phŲ░ŲĪng ph├Īp h├│a hß╗Źc?
HŲ░ß╗øng dß║½n:
Tr├Łch mß╗Śi chß║źt mß╗Öt ├Łt cho v├Āo 3 ß╗æng nghiß╗ćm kh├Īc nhau v├Ā ─æ├Īnh sß╗æ thß╗® tß╗▒ (1), (2), (3).
Lß║źy dung dß╗ŗch BaCl2 cho v├Āo 3 ß╗æng nghiß╗ćm, ß╗æng n├Āo cho kß║┐t tß╗¦a trß║»ng l├Ā H2SO4:
\({\rm{BaC}}{{\rm{l}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow {\rm{ + 2HCl}}\)
Lß║źy dung dß╗ŗch AgNO3 cho v├Āo hai ß╗æng c├▓n lß║Īi, ß╗æng n├Āo cho kß║┐t tß╗¦a trß║»ng sau h├│a ─æen ngo├Āi kh├┤ng kh├Ł l├Ā chß╗®a axit HCl.
\({\rm{AgN}}{{\rm{O}}_{\rm{3}}}{\rm{ + HCl}} \to {\rm{AgCl}} \downarrow {\rm{ + HN}}{{\rm{O}}_{\rm{3}}}\)
Dung dß╗ŗch c├▓n lß║Īi l├Ā HNO3.
B├Āi 3:
D├╣ng dung dß╗ŗch Ba(OH)2 ─æß╗ā ph├ón biß╗ćt 6 dung dß╗ŗch NaNO3, Fe(NO3)3, Al(NO3)3, Mg(NO3)2, NH4NO3, (NH4)2SO4 sau th├¼ hiß╗ćn tŲ░ß╗Żng diß╗ģn ra l├Ā g├¼?
HŲ░ß╗øng dß║½n:
- Fe(NO3)3 tß║Īo kß║┐t tß╗¦a m├Āu n├óu ─æß╗Å.
- Al(NO3)3 tß║Īo kß║┐t tß╗¦a keo.
- Mg(NO3)2 tß║Īo kß║┐t tß╗¦a trß║»ng.
- NH4NO3 tß║Īo kh├Ł m├╣i khai.
- (NH4)2SO4 tß║Īo kß║┐t tß╗¦a m├Āu trß║»ng ─æß╗ōng thß╗Øi c├│ kh├Ł m├╣i khai tho├Īt ra.
3.2. B├Āi tß║Łp Nhß║Łn biß║┐t mß╗Öt sß╗æ ion trong dung dß╗ŗch - N├óng cao
B├Āi 1:
C├│ 5 dung dß╗ŗch mß║źt nh├Żn : Na2S, BaCl2, AlCl3, MgCl2, Na2CO3. Nß║┐u kh├┤ng d├╣ng th├¬m thuß╗æc thß╗Ł th├¼ c├│ thß╗ā nhß║Łn biß║┐t ─æŲ░ß╗Żc tß╗æi ─æa sß╗æ dung dß╗ŗch l├Ā
HŲ░ß╗øng dß║½n:
Cho tß╗½ng cß║Ęp chß║źt trong b├¼nh phß║Żn ß╗®ng tß╗½ng ─æ├┤i mß╗Öt, ta c├│ bß║Żng sau:
|
|
Na2S |
BaCl2 |
AlCl3 |
MgCl2 |
Na2CO3 |
|
Na2S |
- |
- |
Ōåō keo trß║»ng Ōåæ m├╣i trß╗®ng thß╗æi |
Ōåō trß║»ng Ōåæ m├╣i trß╗®ng thß╗æi |
- |
|
BaCl2 |
- |
- |
- |
- |
Ōåō trß║»ng |
|
AlCl3 |
Ōåō keo trß║»ng Ōåæ m├╣i trß╗®ng thß╗æi |
- |
- |
- |
Ōåō keo trß║»ng Ōåæ kh├┤ng m├╣i |
|
MgCl2 |
Ōåō trß║»ng Ōåæ m├╣i trß╗®ng thß╗æi |
- |
- |
- |
Ōåō trß║»ng |
|
NaCO3 |
- |
|
Ōåō keo trß║»ng Ōåæ kh├┤ng m├╣i |
Ōåō trß║»ng |
- |
Vß║Ły c├│ thß╗ā nhß║Łn biß║┐t cß║Ż 5 chß║źt trong 5 lß╗Ź mß║źt nh├Żn.
4. Luyß╗ćn tß║Łp B├Āi 40 H├│a hß╗Źc 12
4.1. Trß║»c nghiß╗ćm
B├Āi kiß╗ām tra Trß║»c nghiß╗ćm Ho├Ī hß╗Źc 12 B├Āi 40 c├│ phŲ░ŲĪng ph├Īp v├Ā lß╗Øi giß║Żi chi tiß║┐t gi├║p c├Īc em luyß╗ćn tß║Łp v├Ā hiß╗āu b├Āi.
-
- A. HCl
- B. Q├╣y t├Łm
- C. NaOH
- D. BaCl2
-
- A. 1.
- B. 4.
- C. 2.
- D. 3.
-
- A. BaCl2
- B. NaHSO4.
- C. Ba(OH)2.
- D. NaOH.
-
- A. giß║źy quß╗│ t├Łm, dung dß╗ŗch bazŲĪ.
- B. muß╗æi tan Ba2+, Cu kim loß║Īi.
- C. Ba(OH)2 v├Ā dung dß╗ŗch muß╗æi tan cß╗¦a Ag+
- D. dd phenolphtalein, giß║źy quß╗│ t├Łm.
-
- A. Dung dß╗ŗch KOH.
- B. Dung dß╗ŗch Na2CO3.
- C. Dung dß╗ŗch AgNO3.
- D. Dung dß╗ŗch H2SO4.
-
- A. Dùng muối bari.
- B. D├╣ng quß╗│ t├Łm v├Ā muß╗æi bari.
- C. D├╣ng dung dß╗ŗch Ba(OH)2.
- D. D├╣ng dung dß╗ŗch AgNO3 v├Ā quß╗│ t├Łm.
-
- A. phŲ░ŲĪng ph├Īp ─æß╗æt n├│ng thß╗Ł m├Āu ngß╗Źn lß╗Ła.
- B. phŲ░ŲĪng ph├Īp nhiß╗ćt ph├ón ─æß╗ā tß║Īo kß║┐t tß╗¦a.
- C. thuß╗æc thß╗Ł ─æß╗ā tß║Īo vß╗øi ion mß╗Öt sß║Żn phß║®m kß║┐t tß╗¦a, bay hŲĪi hoß║Ęc c├│ sß╗▒ thay ─æß╗Ģi m├Āu.
- D. phŲ░ŲĪng ph├Īp th├Łch hß╗Żp ─æß╗ā tß║Īo ra sß╗▒ biß║┐n ─æß╗Ģi vß╗ü trß║Īng th├Īi, m├Āu sß║»c tß╗½ c├Īc ion trong dung dß╗ŗch.
C├óu 8-20: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
4.2. B├Āi tß║Łp SGK v├Ā N├óng cao
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung b├Āi hß╗Źc th├┤ng qua phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp Ho├Ī hß╗Źc 12 B├Āi 40.
B├Āi tß║Łp 1 trang 174 SGK H├│a hß╗Źc 12
B├Āi tß║Łp 2 trang 174 SGK H├│a hß╗Źc 122
B├Āi tß║Łp 3 trang 174 SGK H├│a hß╗Źc 122
B├Āi tß║Łp 4 trang 174 SGK H├│a hß╗Źc 12
B├Āi tß║Łp 5 trang 174 SGK H├│a hß╗Źc 12
B├Āi tß║Łp 6 trang 174 SGK H├│a hß╗Źc 12
B├Āi tß║Łp 1 trang 233 SGK H├│a 12 N├óng cao
B├Āi tß║Łp 2 trang 233 SGK H├│a 12 N├óng cao
B├Āi tß║Łp 3 trang 233 SGK H├│a 12 N├óng cao
B├Āi tß║Łp 4 trang 223 SGK H├│a 12 N├óng cao
B├Āi tß║Łp 5 trang 233 SGK H├│a 12 N├óng cao
B├Āi tß║Łp 1 trang 236 SGK H├│a 12 N├óng cao
B├Āi tß║Łp 2 trang 236 SGK H├│a 12 N├óng cao
B├Āi tß║Łp 3 trang 236 SGK H├│a 12 N├óng cao
B├Āi tß║Łp 40.1 trang 95 SBT H├│a hß╗Źc 12
B├Āi tß║Łp 4 trang 236 SGK H├│a 12 N├óng cao
B├Āi tß║Łp 40.2 trang 95 SBT H├│a hß╗Źc 12
B├Āi tß║Łp 40.3 trang 95 SBT H├│a hß╗Źc 12
B├Āi tß║Łp 40.4 trang 95 SBT H├│a hß╗Źc 12
B├Āi tß║Łp 40.5 trang 95 SBT H├│a hß╗Źc 12
B├Āi tß║Łp 40.6 trang 95 SBT H├│a hß╗Źc 12
B├Āi tß║Łp 40.7 trang 95 SBT H├│a hß╗Źc 12
5. Hß╗Åi ─æ├Īp vß╗ü B├Āi 40 ChŲ░ŲĪng 8 Ho├Ī hß╗Źc 12
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ bß║źt k├¼ thß║»c mß║»c g├¼, c├Īc em h├Ży ─æß╗ā lß║Īi lß╗Øi nhß║»n ß╗¤ mß╗źc Hß╗Åi ─æ├Īp ─æß╗ā c├╣ng cß╗Öng ─æß╗ōng H├│a HOC247 thß║Żo luß║Łn v├Ā trß║Ż lß╗Øi nh├®.


.PNG)
.PNG)
.PNG)