Nội dung bài Luyện tập: Nhận biết một số chất vô cơ chính là bài tổng ôn, ôn tập, hệ thống hóa lại kiến thức cũng như kĩ năng nhận biết một số ion trong dung dịch và chất khí.
Tóm tắt lý thuyết
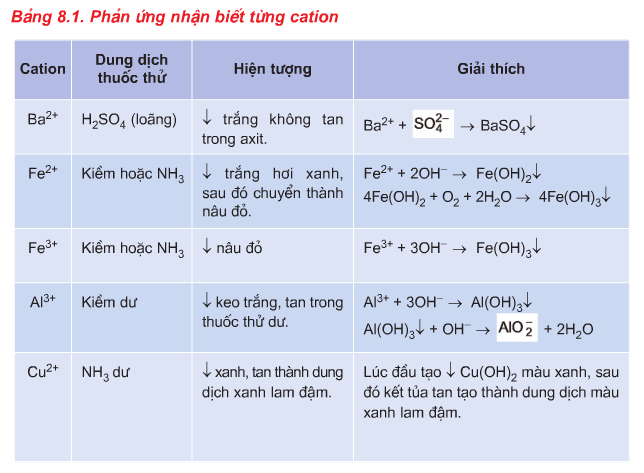
2.1. Phương pháp nhận biết Cation
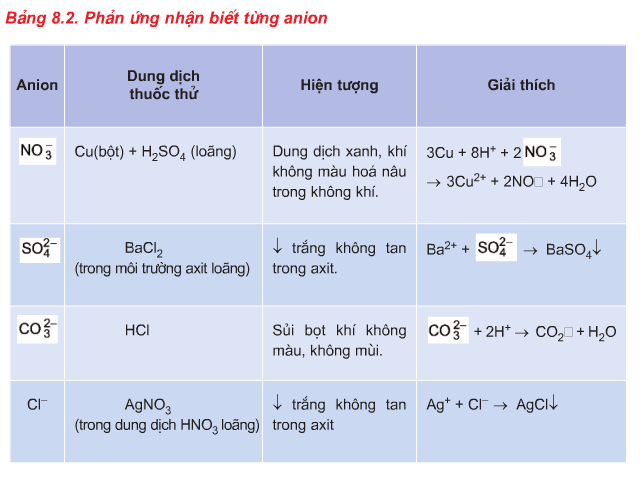
2.2. Phương pháp nhận biết Anion
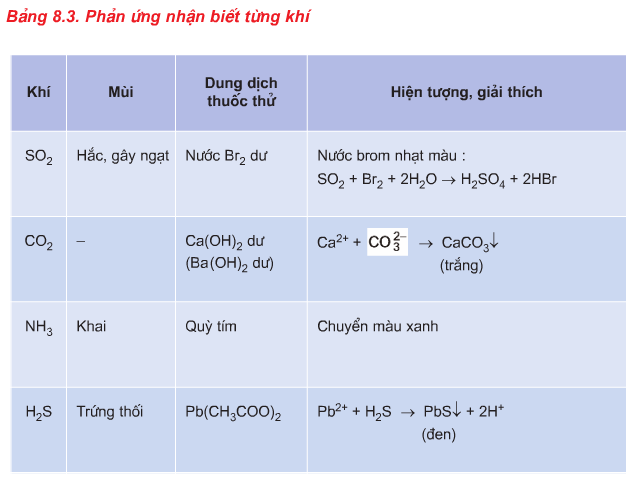
2.3. Phương pháp nhận biết chất khí
Bài tập minh họa
Bài tập Nhận biết một số chất vô cơ
Bài 1:
Có các dung dịch riêng biệt không dán nhãn: NH4Cl, AlCl3, FeCl3, (NH4)2SO4. Dung dịch thuốc thử cần thiết để nhận biết các dung dịch trên là:
Hướng dẫn:
Ion (OH)- tạo kết tủa hidroxit với ion kim loại → Nhận biết bằng màu sắc hidroxit. (Loại C, D)
Nhận xét dãy chất: NH4Cl, AlCl3, FeCl3, (NH4)2SO4
Nếu dùng Ba(OH)2 sẽ nhận biết
+NH4Cl : làm sủi bọt khí có mùi khai
\(Ba{\left( {OH} \right)_2} + 2N{H_4}Cl \to BaC{l_2} + 2N{H_3}^ \uparrow + 2{H_2}O\)
+AlCl3 : tạo kết tủa trắng sau đó kết tủa tan dần
\(\begin{array}{l} 3Ba{\left( {OH} \right)_2} + 2AlC{l_3} \to 3BaC{l_2} + 2Al{\left( {OH} \right)_3} \downarrow \\ 2Al{\left( {OH} \right)_3} + Ba{\left( {OH} \right)_2} \to Ba{\left( {Al{O_2}} \right)_2} + 4{H_2}O\\\end{array}\)
+FeCl3 : tạo kết tủa nâu đỏ
\(2FeC{l_3} + 3Ba{\left( {OH} \right)_2} \to 2Fe{\left( {OH} \right)_3} \downarrow + 3BaC{l_2}\)
+(NH4)2SO4 : tạo BaSO4 kết tủa trắng và thoát khí có mùi khai là NH3
\(Ba{\left( {OH} \right)_2} + {\left( {N{H_4}} \right)_2}S{O_4} \to BaS{O_4}_ \downarrow + 2N{H_3}^ \uparrow + 2{H_2}O\)
Bài 2:
Cho hai dd riêng biệt là Na2SO3 và K2CO3 . Cho các phương pháp nhận biết sau, hỏi phương pháp hóa học nào nhận biết nhanh và chính xác nhất?
(1) dd nước vôi trong dư
(2) đốt và quan sát ngọn lửa
(3) dd BaCl2
(4) dd nước brôm loãng
Hướng dẫn:
(1) Cả hai dd đều tạo ra kết tủa trắng
(2) Hợp chất của Na cho màu vàng , còn K cho ngọn lửa màu tím => Phương pháp vật lí (Loại)
(3) Cả hai dd đều tạo kết tủa trắng
(4) Na2SO3 +( HBr) Br2/H2O → NaBr + SO2 + H2O ,khí SO2 sinh ra mất màu nước brôm
K2CO3 + (HBr)Br2/H2O → NaBr + CO2 + H2O , khí sinh ra không làm mất màu nước brôm
4. Luyện tập Bài 42 Hóa học 12
Sau bài học cần nắm: kĩ năng nhận biết một số ion trong dung dịch và chất khí.
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hoá học 12 Bài 42 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Quì tím
- B. BaCO3.
- C. Al.
- D. Zn.
-
- A. dd NaOH.
- B. dd NH3.
- C. dd HCl.
- D. dd HNO3.
-
- A. NaOH
- B. AgNO3
- C. H2SO4
- D. Na2CO3
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hoá học 12 Bài 42.
Bài tập 1 trang 180 SGK Hóa học 12
Bài tập 2 trang 180 SGK Hóa học 12
Bài tập 3 trang 180 SGK Hóa học 12
Bài tập 4 trang 180 SGK Hóa học 12
Bài tập 5 trang 180 SGK Hóa học 12
Bài tập 1 trang 250 SGK Hóa 12 Nâng cao
Bài tập 2 trang 250 SGK Hóa 12 Nâng cao
Bài tập 3 trang 250 SGK Hóa 12 Nâng cao
Bài tập 42.1 trang 97 SBT Hóa học 12
Bài tập 42.2 trang 97 SBT Hóa học 12
Bài tập 42.3 trang 97 SBT Hóa học 12
Bài tập 42.4 trang 97 SBT Hóa học 12
Bài tập 42.5 trang 98 SBT Hóa học 12
Bài tập 42.6 trang 98 SBT Hóa học 12
Bài tập 42.7 trang 98 SBT Hóa học 12
Bài tập 42.8 trang 98 SBT Hóa học 12
Bài tập 42.9 trang 98 SBT Hóa học 12
Bài tập 42.10 trang 98 SBT Hóa học 12
Bài tập 42.11 trang 98 SBT Hóa học 12
5. Hỏi đáp về Bài 42 Chương 8 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.