Nội dung bài học trình bày cụ thể, tỉ mỉ về Kim loại kiềm và hợp chất quan trọng của kim loại kiềm, giúp các em học sinh biết được vị trí của kim loại kiềm trong Bảng hệ thống tuần hoàn các nguyên tố hóa học; cấu tạo nguyên tử, tính chất vật lí - hóa học và phương pháp điều chế. Biết được tính chất và ứng dụng của một số hợp chất quan trọng của Kim loại kiềm như NaOH (Natri hidroxit), NaHCO3 (Natri hidrocacbonat), Na2CO3 (Natri cacbonat), KNO3 (Kali nitrat)...
Tóm tắt lý thuyết
1.1. KIM LOẠI KIỀM
1.1.1. Vị trí trong Bảng tuần hoàn, cấu hình electron nguyên tử.
- Kim loại kiềm thuộc nhóm IA. Gồm các nguyên tố: liti (Li), natri (Na), kali (K), rubiđi (Rb), Xêsi (Cs) và Franxi (Fr).
- Cấu hình electron nguyên tử:
Li: [He]2s1
Na: [Ne]3s1
K: [Ar]4s1
Rb: [Kr]5s1
Cs: [Xe]6s1
1.1.2. Tính chất vật lí của kim loại kiềm
- Màu trắng bạc và có ánh kim, dẫn điện tốt, nhiệt độ nóng chảy và nhiệt độ sôi thấp, khối lượng riêng nhỏ, độ cứng thấp.
- Nguyên nhân: Kim loại kiềm có cấu trúc mạng tinh thể lập phương tâm khối, cấu trúc tương đối rỗng. Mặt khác, trong tinh thể các nguyên tử và ion liên kết với nhau bằng liên kết kim loại yếu.
1.1.3. Tính chất hóa học của kim loại kiềm
a. Tác dụng với phi kim (O2, Cl2...)
- Thí nghiệm natri với oxi
\(Na + {O_2}\overset{t^{0}}{\rightarrow}N{a_2}{O_2}\) ( Natrai peoxit)
\(Na + {O_2}\overset{t^{0}}{\rightarrow}N{a_2}O\) (Natri oxit)
- Thí nghiệm: \(Na+ Cl_{2}\overset{t^{0}}{\rightarrow}NaCl\)
b. Tác dụng với axit
Thí nghiệm của Natri với dung dịch HCl:
c. Tác dụng với nước
Thí nghiệm: Na với nước:
1.1.4. Ứng dụng, trạng thái thiên nhiên và điều chế
a. Ứng dụng
- Dùng chế tạo hợp kim có nhiệt độ ngoài cùng thấp.
- Hợp kim Li – Al siêu nhẹ, được dùng trong kĩ thuật hàng không.
- Cs được dùng làm tế bào quang điện.
b. Trạng thái tự nhiên
Tồn tại ở dạng hợp chất: NaCl (nước biển), một số hợp chất của kim loại kiềm ở dạng silicat và aluminat có ở trong đất.
c. Điều chế
Khử ion của kim loại kiềm trong hợp chất bằng cách điện phân nóng chảy hợp chất của chúng.
1.2. MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM
1.2.1. Natri hidroxit (NaOH)
a. Tính chất vật lí
- Chất rắn, không màu, dễ nóng chảy (tnc = 3220C), hút ẩm mạnh (dễ chảy rữa), tan nhiều trong nước.
- Khi tan trong nước, NaOH phân li hoàn toàn thành ion: NaOH → Na+ + OH-
b. Tính chất hóa học
- Tác dụng với axit:
HCl + NaOH → NaCl + H2O
- Tác dụng với oxit axit:
NaOH + CO2 → NaHCO3 (tỉ lệ số mol NaOH : CO2 là 1:1)
2NaOH + CO2 → Na2CO3 (tỉ lệ số mol NaOH : CO2 là 2:1)
- Tác dụng với dung dịch muối:
CuSO4 + 2NaOH → Cu(OH)2\(\downarrow\) + Na2SO4
c. Ứng dụng
Nấu xà phòng, chế phẩm nhuộm, tơ nhân tạo, tinh chế quặng nhôm trong công nghiệp luyện nhôm và dùng trong công nghiệp chế biến dầu mỏ.
1.2.2. Natri hidrocacbonat
a. Tính chất vật lí
Chất rắn, màu trắng, ít tan trong nước.
b. Tính chất hóa học
- Phản ứng phân hủy:
\(2NaHCO_{3}\overset{t^{0}}{\rightarrow}Na_{2}CO_{3}+CO_{2}\uparrow+H_{2}O\)
- NaHCO3 là hợp chất lưỡng tính:
\(NaHCO_{3}+HCl\rightarrow NaCl + CO_{2}\uparrow+H_{2}O\)
\(NaHCO_{3}+NaOH \rightarrow Na_{2}CO_{3}+H_{2}O\)
c. Ứng dụng
Dùng trong công nghiệp dược phẩm (chế thuốc đau dạ dày,…) và công nghiệp thực phẩm (làm bột nở,…)
1.2.3. Natri cacnonat (Na2CO3)
a. Tính chất vật lí
- Chất rắn màu trắng, tan nhiều trong nước.
- Ở nhiệt độ thường tồn tại dưới dạng muối ngậm nước Na2CO3.10H2O, ở nhiệt độ cao muối này mất dần nước trở thành Na2CO3 khan, nóng chảy ở 8500C
b. Tính chất hóa học
- Phản ứng với axit:
Na2CO3 + 2HCl → 2NaCl + CO2\(\uparrow\)+ H2O
- Phản ứng với kiềm:
Na2CO3 + Ba(OH)2 → BaCO3\(\downarrow\)+ 2NaOH
- Phản ứng với muối:
Na2CO3 + CaCl2 → CaCO3\(\downarrow\) + 2NaCl
c. Ứng dụng
Là hoá chất quan trọng trong công nghiệp thuỷ tinh, bột giặt, phẩm nhuộm, giấy, sợi,…
1.2.4. Kali nitrat
a. Tính chất vật lí
Là những tinh thể không màu, bền trong không khí, tan nhiều trong nước.
b. Tính chất hóa học
Bị phân huỷ ở nhiệt độ cao:
\(2KNO_{3}\overset{t^{0}}{\rightarrow}2KNO_{2}+O_{2}\)
C. Ứng dụng
- Dùng làm phân bón (phân đạm, phân kali) và chế tạo thuốc nổ. Thuốc nổ thông thường (thuốc súng) là hỗn hợp 68%KNO3, 15%S và 17%C (than)
- Phản ứng cháy của thuốc súng:
\(2KNO_{3}+3C+S\overset{t^{0}}{\rightarrow}N_{2}+3CO_{2}+K_{2}S\)
Bài tập minh họa
3.1. Bài tập về Kim loại kiềm và hợp chất quan trọng của kim loại kiềm - Cơ bản
Bài 1:
Kim loại Na ở nhiệt độ cao tác dụng với oxi khô và dư, tạo ra peoxit. Khi hợp chất này tác dụng với nước, thu được dung dịch NaOH . Người ta cũng có thể thu được dung dịch NaOH bằng cách cho kim loại Na tác dụng với nước. Viết các phương trình hóa học.
Hướng dẫn:
Phương trình hóa học:
\(Na + {O_2}\overset{t^{0}}{\rightarrow}N{a_2}{O_2}\)
\(\begin{array}{l} N{a_2}{O_2} + 2{H_2}O \to 2NaOH + {H_2}{O_2}\\ Na + 2{H_2}O \to 2NaOH + {H_2} \end{array}\)
Bài 2:
Hãy giải thích tại sao kim loại kiềm có khối lượng riêng nhỏ và nhiệt độ nóng chảy thấp.
Hướng dẫn:
- Kim loại kiềm có khối lượng riêng nhỏ là do nguyên tử của các kim loại kiềm có bán kính nguyên tử lớn và có cấu tạo mạng tinh thể kém đặc khít.
- Kim loại kiềm có nhiệt độ nóng chảy thấp do lực liên kết kim loại trong mạng tinh thể kim loại kiềm kém bền vững.
Bài 3:
Lấy 7,8 gam kali tác dụng hoàn toàn với nước thu được V lít khí (đktc). Giá trị của V là:
Hướng dẫn:
\({n_{{H_2}}} = \frac{{{n_K}}}{2} = 0,1\;mol \Rightarrow {V_{{H_2}}} = 2,24lit\)
Bài 4:
Nhỏ từ từ 62,5 ml dung dịch hỗn hợp Na2CO3 0,08M và KHCO3 0,12M vào 125 ml dung dịch HCl 0,1M và khuấy đều. Sau các phản ứng, thu được V ml khí CO2 (đktc). Giá trị của V là
Hướng dẫn:
- Ta có hệ pt sau: \(\left\{ \begin{array}{l} {n_{N{a_2}C{O_3}}}:{n_{NaHC{O_3}}} = 0,08:0,12\\ 2{n_{N{a_2}C{O_3}}} + {n_{NaHC{O_3}}} = 0,0125 \end{array} \right. \to \left\{ \begin{array}{l} {n_{N{a_2}C{O_3}}} = 3,{57.10^{ - 3}}\;mol\\ {n_{NaHC{O_3}}} = 5,{36.10^{ - 3}}\;mol \end{array} \right.\)
\(\Rightarrow {V_{C{O_2}}} = 22,4.({n_{N{a_2}C{O_3}}} + {n_{NaHC{O_3}}}) = 0,2\;(l) = 200ml\)
3.2. Bài tập về Kim loại kiềm và hợp chất quan trọng của kim loại kiềm - Nâng cao
Bài 1:
Hòa tan hoàn toàn a gam Na vào 100 ml dung dịch Y gồm H2SO4 0,5M và HCl 1M, thấy thoát ra 6,72 lít khí (đktc). Cô cạn dung dịch sau phản ứng thu được m gam chất rắn. Giá trị của m gần nhất với:
Hướng dẫn:
\({n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}} + {n_{HCl}} = 2.0,5.0,1 + 0,1 = 0,2\,mol\)
\(\Rightarrow {n_{{H_2}\left( {axit} \right)}} = \frac{{{n_{{H^ + }}}}}{2} = 0,1\,mol < {n_{{H_2}}} = 0,3\,mol\)
=> Có các phản ứng:
\(Na + HCl \to NaCl + \frac{1}{2}{H_2}^ \uparrow\)
\(2Na + {H_2}S{O_4} \to N{a_2}S{O_4} + {H_2}^ \uparrow\)
\(Na + {H_2}O \to NaOH + \frac{1}{2}{H_2}^ \uparrow\)
\(\Rightarrow {n_{NaOH}} = 2\left( {{n_{{H_2}}} - {n_{{H_2}\left( {axit} \right)}}} \right) = 0,4\,mol\)
Vậy khi cô cạn dung dịch thì có: 0,1 mol NaCl; 0,05 mol \(N{a_2}S{O_4}\) ; 0,4 mol NaOH
\(\Rightarrow m = 28,95g\)
Bài 2:
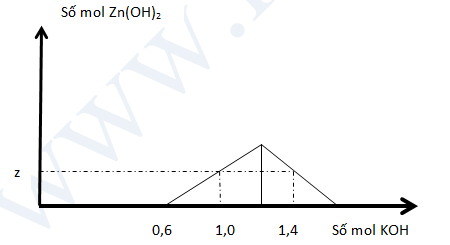
Khi nhỏ từ từ đến dư dung dịch KOH vào dung dịch hỗn hợp gồm X mol HCl và y mol ZnCl2, kết quả của thí nghiệm được biểu diễn theo đồ thị sau :
Tổng (x + y + z) là:
Hướng dẫn:
Với bài tập \(Z{n^{2 + }} + O{H^ - }\) thì
Nếu có hiện tượng kết tủa \(\Rightarrow {n_{OH}} = 4{n_{Z{n^{2 + }}}} - 2{n_{Zn{{\left( {OH} \right)}_2}}}\)
Tại \({n_{K{\rm{O}}H}} = 0,6\,mol\) thì bắt đầu có kết tủa => Khi đó HCl vừa bị trung hòa hết
\(\Rightarrow {n_{HCl}} = x = 0,6\,mol\)
Tại \({n_{K{\rm{O}}H}} = 1,0\,mol\) và 1,4 mol đều tạo cùng một lượng kết tủa
=> tại \({n_{K{\rm{O}}H}} = 1,0\,mol\) thì \(Z{n^{2 + }}\) dư \(\Rightarrow {n_{Zn{{\left( {OH} \right)}_2}}} = \frac{1}{2}.\left( {{n_{KOH}} - {n_{HCl}}} \right) = 0,2\,mol = z\)
Tại ml thì kết tủa tan 1 phần \(\Rightarrow {n_{KOH}} - {n_{HCl}} = 4{n_{ZnC{l_2}}} - 2{n_{Zn{{\left( {OH} \right)}_2}}}\)
\(\Rightarrow {n_{ZnC{l_2}}} = y = 0,3\,mol\)
\(\Rightarrow x + y + z = 0,6 + 0,3 + 0,1 = 1,1\,mol\)
4. Luyện tập Bài 25 Hóa học 12
Sau bài học cần nắm:
- Vị trí của kim loại kiềm trong Bảng hệ thống tuần hoàn các nguyên tố hóa học
- Cấu tạo nguyên tử, tính chất vật lí - hóa học và phương pháp điều chế.
- Tính chất và ứng dụng của một số hợp chất quan trọng của Kim loại kiềm như NaOH (Natri hidroxit), NaHCO3 (Natri hidrocacbonat), Na2CO3 (Natri cacbonat), KNO3 (Kali nitrat)...
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hoá học 12 Bài 25 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Fe
- B. Na
- C. Al
- D. Cu
-
- A. 1.
- B. 2.
- C. 3.
- D. 4.
-
- A. điện phân dung dịch NaCl. không có màng ngăn điện cực
- B. điện phân dung dịch NaNO3, không có màng ngăn điện cực
- C. điện phân dung dịch NaCl, có màng ngăn điện cực .
- D. điện phân NaCl nóng chảy
-
- A. 1.
- B. 4.
- C. 2.
- D. 3.
-
- A. Dùng chế tạo hợp kim có nhiệt độ nóng chảy thấp.
- B. Dùng làm chất xúc tác trong nhiều phản ứng hữu cơ.
- C. Dùng làm chất trao đổi nhiệt trong các lò phản ứng hạt nhân.
- D. Điều chế kim loại hoạt động yếu hơn bằng phương pháp nhiệt luyện.
-
- A. CaCl2.
- B. Na2S.
- C. NaOH.
- D. NaOH.
-
- A. Al2O3, Na2CO3, AlCl3
- B. Al, NaHCO3, Al(OH)3
- C. NaAlO2, Na2CO3, NaCl
- D. Al, FeCl2, FeCl3
-
- A. nước.
- B. dầu hỏa.
- C. phenol lỏng.
- D. ancol etylic.
-
- A. 3.
- B. 4.
- C. 5.
- D. 6.
-
- A. NaCl.
- B. NaOH.
- C. NaOH.
- D. HCl.
Câu 11-30: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hoá học 12 Bài 25.
Bài tập 1 trang 111 SGK Hóa học 12
Bài tập 2 trang 111 SGK Hóa học 12
Bài tập 3 trang 111 SGK Hóa học 12
Bài tập 4 trang 111 SGK Hóa học 12
Bài tập 5 trang 111 SGK Hóa học 12
Bài tập 6 trang 111 SGK Hóa học 12
Bài tập 7 trang 111 SGK Hóa học 12
Bài tập 8 trang 111 SGK Hóa học 12
Bài tập 1 trang 152 SGK Hóa 12 Nâng cao
Bài tập 2 trang 152 SGK Hóa 12 Nâng cao
Bài tập 4 trang 153 SGK Hóa học 12 nâng cao
Bài tập 5 trang 153 SGK Hóa học 12 nâng cao
Bài tập 6 trang 153 SGK Hóa học 12 nâng cao
Bài tập 1 trang 157 SGK Hóa 12 Nâng cao
Bài tập 2 trang 157 SGK Hóa 12 Nâng cao
Bài tập 3 trang 157 SGK Hóa 12 Nâng cao
Bài tập 4 trang 157 SGK Hóa 12 Nâng cao
Bài tập 5 trang 157 SGK Hóa học 12 nâng cao
Bài tập 6 trang 157 SGK Hóa 12 Nâng cao
Bài tập 25.1 trang 54 SBT Hóa học 12
Bài tập 25.2 trang 54 SBT Hóa học 12
Bài tập 25.3 trang 54 SBT Hóa học 12
Bài tập 25.4 trang 54 SBT Hóa học 12
Bài tập 25.5 trang 55 SBT Hóa học 12
Bài tập 25.10 trang 55 SBT Hóa học 12
Bài tập 25.6 trang 55 SBT Hóa học 12
Bài tập 25.12 trang 56 SBT Hóa học 12
Bài tập 25.13 trang 56 SBT Hóa học 12
Bài tập 25.7 trang 55 SBT Hóa học 12
Bài tập 25.8 trang 55 SBT Hóa học 12
Bài tập 25.9 trang 55 SBT Hóa học 12
Bài tập 25.11 trang 56 SBT Hóa học 12
Bài tập 25.14 trang 56 SBT Hóa học 12
Bài tập 25.15 trang 56 SBT Hóa học 12
Bài tập 25.16 trang 57 SBT Hóa học 12
Bài tập 25.17 trang 57 SBT Hóa học 12
Bài tập 25.18 trang 57 SBT Hóa học 12
5. Hỏi đáp về Bài 25 Chương 6 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.