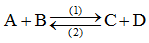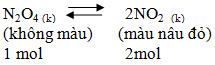Bài giảng trình bày cụ thể thế nào là Cân bằng hóa học và sự chuyển dịch cân bằng hóa học; Vận dụng được nguyên lí Sơ-sa-tơ-li-ê để xét đoán sự chuyển dịch hóa học.
Tóm tắt lý thuyết
1.1. Phản ứng một chiều, Phản ứng thuận nghịch, Cân bằng hóa học
a) Phản ứng một chiều
- Là phản ứng xảy ra theo chiều xác định từ trái sang phải (dùng 1 mũi tên chỉ chiều phản ứng)
- Ví dụ: KClO3 \(\xrightarrow[t^{0}]{MnO_{2}}\) KCl + O2
b) Phản ứng thuận nghịch
- Là phản ứng xảy ra 2 chiều trái ngược nhau (dùng mũi tên 2 chiều chỉ phản ứng) (cùng điều kiện)
- Ví dụ: Cl2 + H2O \(\rightleftharpoons\) HCl + HClO
C) Cân bằng hóa học
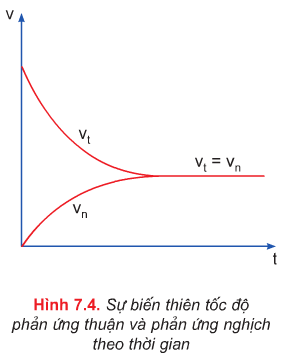
- Tốc độ phản ứng xảy ra chiều (1) (thuận): Vt
- Tốc độ phản ứng xảy ra chiều (2) (nghịch): Vn
- Đến thời điểm Vt = Vn: cân bằng hoá học
- Cân bằng hóa học là cân bằng động.
⇒ Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
1.2. Sự chuyển dịch cân bằng
a) Thí nghiệm chuyển dịch cân bằng giữa NO2 và N2O4
b) Định nghĩa
Sự chuyển dịch cân bằng hóa học là sự di chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động cùa các yếu tố từ bên ngoài lên cân bằng.
1.3. Các yếu tố ảnh hưởng đến cân bằng hóa học.
Nguyên lí chuyển dịch cân bằng Lơ-sa-tơ-li-ê: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
a) Ảnh hưởng của nồng độ
- Thí nghiệm:
-
Khi tăng nồng độ của CO2 → Cân bằng chuyển dịch theo chiều thuận (nhằm làm giảm nồng độ CO2)
-
Khi giảm nồng độ của CO2 → Cân bằng chuyển dịch theo chiều nghịch (nhằm làm tăng nồng độ CO2)
-
- Kết luận: Khi tăng nồng độ của một chất cân bằng hóa học chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
b) Ảnh hưởng của áp suất
- Thí nghiệm:
-
Khi tăng áp suất→Cân bằng chuyển dịch theo chiều nghịch (nhằm làm giảm áp suất tức làm giảm số mol khí)
-
Khi giảm áp suất→Cân bằng chuyển dịch theo chiều thuận (nhằm làm tăng áp suất tức tăng số mol khí)
-
-
Kết luận: Khi tăng áp suất của hệ cân bằng hóa học chuyển dịch theo chiều làm giảm áp suất (tức làm giảm số mol khí) và ngược lại.
c) Ảnh hưởng của nhiệt độ
Phản ứng thu nhiệt : ∆H >0 (làm nhiệt độ giảm)
Phản ứng tỏa nhiệt : ∆H <0 (làm nhiệt độ tăng)
- Thí nghiệm:
- Khi tăng nhiệt độ→Cân bằng chuyển dịch theo chiều thuận (chiều thu nhiệt nhằm làm giảm nhiệt độ).
-
Khi giảm nhiệt độ→Cân bằng chuyển dịch theo chiều nghịch (chiều tỏa nhiệt nhằm làm tăng nhiệt độ).
- Kết luận:
- Khi tăng nhiệt độ cân bằng hóa học chuyển dịch theo chiều thu nhiệt (nhằm làm giảm nhiệt độ).
-
Khi giảm nhiệt độ cân bằng hóa học chuyển dịch theo chiều tỏa nhiệt (nhằm làm tăng nhiệt độ).
d) Vai trò của chất xúc tác
Chất xúc tác làm tăng tốc độ phản ứng thuận và nghịch với số lần bằng nhau nên không ảnh hưởng đến cân bằng hóa học.
1.4. Ý nghĩa của tốc độ phản ứng và cân bằng hóa học
Ví dụ 1:
- Tăng nồng độ O2 bằng cách dùng dư không khí.
- Nếu giảm nhiệt độ thì tốc độ phản ứng xảy ra chậm do đó phải thực hiện ở nhiệt độ hợp lí là 450-5000C và dùng thêm chất xúc tác là V2O5
Ví dụ 2:
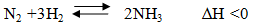
- Thực hiện ở áp suất cao.
- Nếu giảm nhiệt độ thì tốc độ phản ứng xảy ra chậm do đó phải thực hiện ở nhiệt độ hợp lí là 450-5000C và dùng thêm chất xúc tác là Fe, K2O và Al2O3.
1.5. Tổng kết
Bài tập minh họa
2.1. Bài tập cân bằng hóa học - Cơ bản
Bài 1:
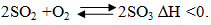
Cho cân bằng hóa học sau: 2SO2 (k) + O2 (k) ⇄ 2SO3 (k); ∆H < 0
Cho các biện pháp: (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác V2O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng. Những biện pháp nào làm cân bằng trên chuyển dịch theo chiều thuận?
Hướng dẫn:
2SO2 (k) + O2 (k) \(\rightleftarrows\) 2SO3 (k), ∆H < 0
Phản ứng theo chiều thuận là tỏa nhiệt, để cân bằng chuyển dịch theo chiều thuận:
- Hạ nhiệt độ.
- Tăng áp suất.
- Tăng nồng độ của SO2, O2 hoặc giảm nồng độ SO3.
Bài 2:
Cho các cân bằng hóa học sau:
(1) 2HI (k) \(\rightleftharpoons\) H2 (k) + I2 (k)
(2) CaCO3 (r) \(\rightleftharpoons\) CaO (r) + CO2 (k)
(3) FeO (r) + CO (k) \(\rightleftharpoons\) Fe (r) + CO2 (k)
(4) 2SO2 (k) + O2 (k) \(\rightleftharpoons\) 2SO3 (k)
Khi tăng áp suất của hệ, số cân bằng bị chuyển dịch theo chiều thuận là:
Hướng dẫn:
Khi tăng áp suất của hệ, cân bằng dịch chuyển theo chiều giảm số mol khí ⇒ Để phản ứng theo chiều thuận ⇒ số mol khí vế trái lớn hơn vế phải ⇒ cân bằng: (4)
Bài 3:
Cho các cân bằng:
H2 (k) + I2 (k) \(\rightleftarrows\) 2HI (k) (1)
2NO(k) + O2 (k) \(\rightleftarrows\) 2NO2 (k) (2)
CO(k) + Cl2 (k) \(\rightleftarrows\) COCl2 (k) (3)
CaCO3 (r) \(\rightleftarrows\) CaO (r) + CO2 (k) (4)
3Fe (r) + 4H2O(k) \(\rightleftarrows\) Fe3O4 (r) + 4H2 (k) (5)
Các cân bằng chuyển dịch theo chiều thuận khi tăng áp suất là:
Hướng dẫn:
Cân bằng chuyển dịch theo chiều thuận khi tăng áp suất nếu tổng số mol khí sau phản ứng nhỏ hơn tổng số mol các chất khí phản ứng ban đầu.
2.2. Bài tập Cân bằng hóa học - Nâng cao
Bài 1:
Tốc độ của phản ứng A + B →C sẽ tăng lên bao nhiêu lần khi tăng nhiệt độ phản ứng từ 250C lên 550C, biết rằng khi tăng nhiệt độ lên 100C thì tốc độ phản ứng tăng lên 3 lần?
Hướng dẫn:
Ta có công thức tính tốc độ phản ứng Van’t Hoff như sau:
\(\gamma ^n=\frac{v_2}{v_1}\); trong đó \(n=\frac{t_2-t_1}{10}\); \(\gamma\) có giá trị từ 2 đến 4.
Áp dụng công thức trên ta có:
Khi tăng 100 thì v tăng 3 lần ⇒ \(\gamma\) = 3.
⇒ Khi tăng nhiệt độ từ 250C lên 550C ⇒ tốc độ phản ứng tăng 33 = 27 lần
3. Luyện tập Bài 38 Hóa học 10
Sau bài học cần nắm:
- Cân bằng hóa học và sự chuyển dịch cân bằng hóa học
- Vận dụng được nguyên lí Sơ-sa-tơ-li-ê để xét đoán sự chuyển dịch hóa học.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 38 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Nhiệt độ.
- B. Xúc tác.
- C. Nồng độ.
- D. Áp suất.
-
- A. 2 và 4.
- B. 1 và 4.
- C. 1 và 2.
- D. 2 và 3.
-
- A. 4.
- B. 2.
- C. 3.
- D. 5.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 38.
Bài tập 1 trang 162 SGK Hóa học 10
Bài tập 2 trang 162 SGK Hóa học 10
Bài tập 3 trang 163 SGK Hóa học 10
Bài tập 4 trang 163 SGK Hóa học 10
Bài tập 5 trang 163 SGK Hóa học 10
Bài tập 6 trang 163 SGK Hóa học 10
Bài tập 7 trang 163 SGK Hóa học 10
Bài tập 8 trang 163 SGK Hóa học 10
Bài tập 38.1 trang 82 SBT Hóa học 10
Bài tập 38.2 trang 82 SBT Hóa học 10
Bài tập 38.3 trang 82 SBT Hóa học 10
Bài tập 38.4 trang 83 SBT Hóa học 10
Bài tập 38.5 trang 83 SBT Hóa học 10
Bài tập 38.6 trang 83 SBT Hóa học 10
Bài tập 38.7 trang 83 SBT Hóa học 10
Bài tập 38.8 trang 83 SBT Hóa học 10
Bài tập 38.9 trang 84 SBT Hóa học 10
Bài tập 38.10 trang 84 SBT Hóa học 10
Bài tập 38.11 trang 84 SBT Hóa học 10
Bài tập 38.12 trang 84 SBT Hóa học 10
Bài tập 38.13 trang 85 SBT Hóa học 10
Bài tập 38.14 trang 85 SBT Hóa học 10
Bài tập 1 trang 212 SGK Hóa học 10 nâng cao
Bài tập 2 trang 212 SGK Hóa học 10 nâng cao
Bài tập 3 trang 212 SGK Hóa học 10 nâng cao
Bài tập 4 trang 213 SGK Hóa học 10 nâng cao
Bài tập 5 trang 213 SGK Hóa học 10 nâng cao
Bài tập 6 trang 213 SGK Hóa học 10 nâng cao
Bài tập 7 trang 213 SGK Hóa học 10 nâng cao
Bài tập 8 trang 213 SGK Hóa học 10 nâng cao
Bài tập 9 trang 213 SGK Hóa học 10 nâng cao
Bài tập 10 trang 213 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 38 Chương 7 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.