Hướng dẫn giải bài tập SGK Hoá học 12 Bài 26 Kim loại kiềm thổ và hợp chất quan trọng của chúng giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức môn hoá.
-
Bài tập 1 trang 118 SGK Hóa học 12
Xác định kim loại kiềm thổ theo chiều tăng dần của điện tích hạt nhân, thì:
A. Bán kính nguyên tử giảm dần.
B. Năng lượng ion hóa giảm dần.
C. Tính khử giảm dần.
D. Khả năng tác dụng với nước giảm dần.
-
Bài tập 2 trang 118 SGK Hóa học 12
Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 sẽ:
A. Có kết tủa trắng.
B. Có bọt khí thoát ra.
C. Có kết tử trắng và bọt khí.
D. Không có hiện tượng gì.
-
Bài tập 3 trang 119 SGK Hóa học 12
Cho 2,84 gam hỗn hợp CaCO3 và MgCO3 tác dụng hết với dung dịch HCl thấy bay ra 672 ml khí CO2 (đktc). Phần trăm khối lượng của 2 muối (CaCO3, MgCO3) trong hỗn hợp là:
A. 35,2% và 64,8%.
B. 70,4% và 29,6%.
C. 85,49% và 14,51%.
D. 17,6% và 82,4%.
-
Bài tập 4 trang 119 SGK Hóa học 12
Cho 2 gam một kim loại thuộc nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55 gam muối clorua. Kim loại đó là kim loại nào sau đây?
A. Be
B. Mg
C. Ca
D. Ba.
-
Bài tập 5 trang 119 SGK Hóa học 12
Cho 2,8 gam CaO tác dụng với một lượng nước lấy dư thu được dung dịch A. Sục 1,68 lít CO2 (đktc) vào dung dịch A.
a) Tính khối lượng kết tủa thu được.
b) Khi đun nóng dung dịch A thì khối lượng kết tủa thu được tối đa là bao nhiêu?
-
Bài tập 6 trang 119 SGK Hóa học 12
Khi lấy 14,25 gam muối clorua của một kim loại chỉ có hóa trị II và một khối lượng muối nitrat của kim loại đó có số mol bằng số mol muối clorua thì thấy khác nhau 7,95 gam. Xác định tên kim loại.
-
Bài tập 7 trang 119 SGK Hóa học 12
Hòa tan 8,2 gam hỗn hợp bột CaCO3 và MgCO3 trong nước cần 2,016 lít CO2 (đktc). Xác định khối lượng mỗi muối trong hỗn hợp?
-
Bài tập 8 trang 119 SGK Hóa học 12
Trong một cốc nước có chứa 0,01 mol Na+, 0,02 mol Ca2+, 0,01 mol Mg2+, 0,05 mol HCO3–, 0,02 mol Cl-. Nước trong cốc thuộc loại nào?
A. Nước cứng có tính cứng tạm thời.
B. Nước cứng có tính cứng vĩnh cửu.
C. Nước cứng có tính cứng toàn phần.
D. Nước mềm.
-
Bài tập 9 trang 119 SGK Hóa học 12
Viết phương trình hóa học của phản ứng để giải thích việc dùng Na3PO4 làm mềm nước cứng có tính cứng toàn phần?
-
Bài tập 1 trang 161 SGK Hóa 12 Nâng cao
So với nguyên tử Canxi, nguyên tử Kali có:
A. Bán kính nguyên tử lớn hơn và độ âm điện lớn hơn.
B. Bán kính nguyên tử lớn hơn và độ âm điện nhỏ hơn.
C. Bán kính nguyên tử nhỏ hơn và độ âm điện nhỏ hơn.
D. Bán kính nguyên tử nhỏ hơn và độ âm điện lớn hơn.
-
Bài tập 2 trang 161 SGK Hóa 12 Nâng cao
Điều chế kim loại Mg bằng cách điện phân MgCl2 nóng chảy, phản ứng nào xảy ra ở catot (cực âm)?
A. Mg → Mg2+ + 2e
B. Mg2+ +2e → Mg
C. 2Cl- → Cl2 + 2e
D. Cl2 + 2e → 2Cl-
-
Bài tập 3 trang 161 SGK Hóa 12 Nâng cao
Các đại lượng hoặc tính chất sau đây của kim loại kiềm thổ biến đổi như thế nào khi điện tích hạt nhân nguyên tử tăng dần?
a. Bán kính nguyên tử
b. Năng lượng ion hóa
c. Thế điện cực chuẩn E0
d. Tính khử
-
Bài tập 4 trang 161 SGK Hóa học 12 nâng cao
Nhóm IIA trong bảng tuần hoàn có những nguyên tố Ba, Be, Ca, Ma, Sr.
a. Hãy viết các cặp oxi hóa - khử của các nguvên tố này và sắp xếp theo chiều thế điện cực chuẩn tăng dần.
b. Viết cấu hình electron nguyên tử đầy đủ của hai nguyên tố tùy chọn.
c. Vì sao các kim loại kiềm thổ có số oxi hóa là +2 mà không là +1 hoặc +3?
-
Bài tập 5 trang 161 SGK Hóa học 12 nâng cao
Năng lượng ion hóa và thế điện cực chuẩn của các kim loại kiềm thổ liên quan như thế nào đến tính khứ của kim loại này?
-
Bài tập 6 trang 161 SGK Hóa 12 Nâng cao
Câu nào sau đây diễn tả đúng tính chất của kim loại kiềm thổ?
A. Tính khử của kim loại tăng theo chiều tăng năng lượng ion hóa.
B. Tính khử của kim loại tăng theo chiều giảm năng lượng ion hóa.
C. Tính khử của kim loại tăng theo chiều tăng của thế điện cực chuẩn.
D. Tính khử của kim loại tăng theo chiều tăng của độ âm điện.
-
Bài tập 7 trang 161 SGK Hóa 12 Nâng cao
Cho 10 gam một kim loại kiềm thổ tác dụng với nước, thu được 6,11 lít khí H2 (250C và 1 atm). Hãy xác định kim loại kiềm thổ đã dùng.
-
Bài tập 1 trang 167 SGK Hóa 12 Nâng cao
Chất nào sau đây không bị thủy phân khi nung nóng?
A. Mg(NO3)2
B. CaCO3
C. CaSO4
D. Mg(OH)2
-
Bài tập 2 trang 167 SGK Hóa học 12 nâng cao
Theo thuyết Brón-stet, ion nào sau đây (trong dung dịch) có tính lưỡng tính?
A. CO32-
B. OH-
C. Ca2+
D. HCO3-
-
Bài tập 3 trang 167 SGK Hóa 12 Nâng cao
Nước tự nhiên có chứa ion nào dưới đây được gọi là nước có tính cứng tạm thời?
A. Ca2+, Mg2+, Cl-
B. Ca2+, Mg2+, SO42-
C. Cl-, SO42-, HCO3-, Ca2+
D. HCO3-, Ca2+, Mg2+
-
Bài tập 4 trang 167 SGK Hóa 12 Nâng cao
Một loại nước cứng khi đun sôi thì mất tính cứng, trong loại nước cứng này có hòa tan những chất nào sau đây?
A. Ca(HCO3)2, MgCl2
B. Ca(HCO3)2, Mg(HCO3)2
C. Mg(HCO3)2, CaCl2
D. MgCl2, Ca2SO4
-
Bài tập 5 trang 167 SGK Hóa 12 Nâng cao
Cho các chất:
A. NaCl
B. Ca(OH)2
C. Na2CO3
D. HCl
E. BaCl2
F. Na2SO4
Những chất nào có thể:
a. Làm mềm nước có tính cứng tạm thời
b. Làm mềm nước có tính cứng vĩnh cửu
Viết phương tình hóa học.
-
Bài tập 6 trang 167 SGK Hóa 12 Nâng cao
a. Có 4 chất rắn đựng trong 4 lọ riêng biệt: Na2CO3, CaCO3, Na2SO4, CaSO4.2H2O. Bằng cách nào để nhận biết 4 chất, nếu ta chỉ dùng nước và dung dịch axit.
b. Có 3 chất rắn đựng trong 3 lọ riêng biệt: NaCl, CaCl2 và MgCl2. Hãy trình bày phương pháp hóa học để nhận biết mỗi chất (có đủ dụng cụ và những hóa chất cần thiết).
-
Bài tập 7 trang 167 SGK Hóa 12 Nâng cao
Trong tự nhiên các nguyên tố magie và canxi có trong quặng đôlômit: CaCO3.MgCO3. Từ quặng này hãy trình bày phương pháp điều chế:
a. Hai chất riêng biệt là CaCO3 và MgCO3
b. Hai kim loại riêng biệt là Ca và Mg
Viết các phương trình hóa học.
-
Bài tập 8 trang 168 SGK Hóa học 12 nâng cao
Dựa vào bảng tính tan của một số hợp chất kim loại kiềm thổ (xem phần tư liệu), hãv xét xem phản ứng nào sau đây xảy ra:
Mg(OH)2 + Ca2+ → Ca(OH)2 + Mg2+.
Ca(OH)2 + Mg2+ → Mg(OH)2 + Ca2+
-
Bài tập 9 trang 168 SGK Hóa học 12 nâng cao
Cho 10 lít (đktc) hỗn hợp khí gồm N2 và CO2 tác dụng với 2 lít dung dịch Ca(OH)2 0,02 mol/l, thu được 1 gam chất kết tủa. Hãy xác định thành phần % theo thể tích của mỗi khí trong hỗn hợp ban đầu?
-
Bài tập 10 trang 168 SGK Hóa học 12 nâng cao
Có ba cốc đựng lần lượt: nước mưa, nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu. Hãy nhận biết nước đựng trong mỗi cốc bằng phương pháp hóa học. Viết phương trình phản ứng.
-
Bài tập 11 trang 168 SGK Hóa 12 Nâng cao
Cần dùng bao nhiêu gam Na2CO3 vừa đủ để làm mềm lượng nước cứng, biết lượng CaSO4 có trong nước cứng trên là 6.10-5 mol.
-
Bài tập 12 trang 168 SGK Hóa 12 Nâng cao
Tính tổng khối lượng theo mg/lit của các ion Ca2+ và Mg2+ có trong một loại nước tự nhiên. Biết rằng nước này có chứa đồng thời các muối Ca(HCO3)2, Mg(HCO3)2 và CaSO4 với khối lượng tương ứng là 112,5 mg/l, 119 mg/l và 54,5 mg/l.
-
Bài tập 26.1 trang 57 SBT Hóa học 12
Ở trạng thái cơ bản, nguyên tử kim loại kiém thổ có số electron hoá trị là
A. 1e.
B. 2e.
C. 3e.
D. 4e.
-
Bài tập 26.2 trang 57 SBT Hóa học 12
Chỉ dùng thêm thuốc thử nào cho dưới đây có thể nhận biết được 3 lọ mất nhãn chứa các dung dịch: H2SO4, BaCl2, Na2SO4?
A. Quỳ tím.
B. Bột kẽm.
C. Na2CO3.
D. Quỳ tím hoặc bột kẽm hoặc Na2CO3.
-
Bài tập 26.3 trang 57 SBT Hóa học 12
Cho các chất: Ca, Ca(OH)2, CaCO3, CaO. Dựa vào mối quan hệ giữa các hợp chất vô cơ, dãy biến đổi nào sau đây có thể thực hiện được ?
A. Ca → CaCO3 → Ca(OH)2 → CaO
B. Ca → CaO → Ca(OH)2 → CaCO3
C. CaCO3 → Ca → CaO → Ca(OH)2
D. CaCO3 →Ca(OH)2 → Ca→ CaO
-
Bài tập 26.4 trang 58 SBT Hóa học 12
Có thể dùng chất nào sau đây để làm mềm nước có tính cứng tạm thời ?
A. NaCl
B. H2SO4
C. Na2CO3
D. KNO3
-
Bài tập 26.5 trang 58 SBT Hóa học 12
Anion gốc axit nào sau đây có thể làm mềm nước cứng ?
A. NO3-
B. SO42-
C. ClO4-
D. PO43-
-
Bài tập 26.6 trang 58 SBT Hóa học 12
Trong một dung dịch có a mol Ca2+, b mol Mg2+, c mol Cl , d mol HCO3. Biểu thức liên hệ giữa a, b, c, d là
A. a + b = c + d
B. 2a + 2b = c + d
C. 3a + 3b = c + d
D. 2a + c = b + d
-
Bài tập 26.7 trang 58 SBT Hóa học 12
Trong nước tự nhiên thường có lẫn một lượng nhỏ các muối Ca(NO3)2, Mg(NO3)2, Ca(HCO3)2, Mg(HCO3)2. Có thể dùng dung dịch nào sau đây để loại đồng thời các cation trong các muối trên ra khỏi nước ?
A. Dung dịch NaOH
B. Dung dịch K2SO4
C. Dung dịch Na2CO3
D. Dung dịch NaNO3
-
Bài tập 26.8 trang 58 SBT Hóa học 12
Có thể loại bỏ tính cứng tạm thời của nước bằng cách đun sôi vì lí do nào sau đây?
A. Nước sôi ở nhiệt độ cao (ở 100°c, áp suất khí quyển).
B. Khi đun sôi đã làm tăng độ tan của các chất kết tủa.
C. Khi đun sôi các chất khí hoà tan trong nước thoát ra.
D. Các muối hiđrocacbonat của canxi và magie bị phân huỷ bởi nhiệt để tạo kết tủa.
-
Bài tập 26.9 trang 58 SBT Hóa học 12
Để oxi hoá hoàn toàn một kim loại M hoá trị II thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. Kim loại M là
A. Zn.
B. Mg.
C. Ca.
D. Ba.
-
Bài tập 26.10 trang 58 SBT Hóa học 12
Nung hỗn hợp muối cacbonat của hai kim loại kế tiếp nhau trong nhóm IIA tới khối lượng không đổi thu được 2,24 lít C02 (đktc) và 4,64 g hỗn hợp hai oxit. Hai kim loại đó là
A. Mg và Ca.
B. Be và Mg.
C. Ca và Sr.
D. Sr và Ba.
-
Bài tập 26.11 trang 59 SBT Hóa học 12
Để trung hoà dung dịch hỗn hợp X chứa 0,1 mol NaOH và 0,15 mol Ba(OH)2 cần bao nhiêu lít dung dịch hỗn hợp Y chứa HCl 0,1M và H2SO4 0,05M ?
A. 1 lít
B. 2 lít
C. 3 lít
D. 4 lít
-
Bài tập 26.12 trang 59 SBT Hóa học 12
Cho hỗn hợp 2 muối cacbonat của kim loại hoá trị II trong dung dịch HCl dư thu được 6,72 lít khí (đktc). Cô cạn dung dịch sau phản ứng thấy khối lượng muối khan thu được nhiều hơn khối lượng hai muối cacbonat ban đầu là
A. 3,0 g.
B. 3,1 g.
C. 3,2 g.
D. 3,3 g.
-
Bài tập 26.13 trang 59 SBT Hóa học 12
Cho a gam hỗn hợp BaCO3 và CaCO3 tác dụng hết với V lít dung dịch HCl 0,4M thấy giải phóng 4,48 lít C02 (đktc), dẫn khí thu được vào dung dịch Ca(OH)2 dư.
a) Khối lượng kết tủa thu được là
A. 10 g.
B. 15 g
C. 20 g
D. 25 g.
b) Thể tích dung dịch HCl cần dùng là
A. 1,0 lít. B. 1,5 lít.
C. 1,6 lít. D. 1,7 lít.
c) Giá trị của a nằm trong khoảng nào dưới đây ?
A. 10 g < a
B. a < 40 g
C. 20 g < a < 39,4 g
D. 20 g < a < 40 g
-
Bài tập 26.14 trang 59 SBT Hóa học 12
Trong một cốc nước có chứa 0,O3 mol Na+ 0,01 mol Ca2+ ; 0,01 mol Mg2+ ; 0,04 mol HCO3- 0,01 mol Cl ; 0,01 mol SO42-. Nước trong cốc thuộc loại
A. nước cứng tạm thời.
B. nước cứng vĩnh cửu.
C. nước cứng toàn phần.
D. nước mềm.
-
Bài tập 26.15 trang 60 SBT Hóa học 12
Trong một cốc nước chứa 0,02 mol Ca2+ ; 0,01 mol Mg2+ ; 0,04 mol HCO3- ; 0,02 mol Cl-. Nước trong cốc thuộc loại
A. nước cứng tạm thời
C. nước cứng toàn phần
B. nước cứng vĩnh cửu.
D. nước mềm.
-
Bài tập 26.16 trang 60 SBT Hóa học 12
Trong các phương pháp sau, phương pháp chỉ khử được tính cứng tạm thời của nước là
A. phương pháp hoá học (sử dụng Na2CO3, Na3PO4).
B. phương pháp nhiệt (đun sôi)
C. phương pháp lọc.
D. phương pháp trao đổi ion.
-
Bài tập 26.17 trang 60 SBT Hóa học 12
Vì sao tính chất vật lí của kim loại nhóm IIA không biến đổi theo một quy luật nhất định ?
-
Bài tập 26.18 trang 60 SBT Hóa học 12
So sánh kim loại Mg và Ca về các mặt:
a) Cấu hình electron của nguyên tử.
b) Tác dụng với nước.
c) Phương pháp điều chế các đơn chất.
-
Bài tập 26.19 trang 60 SBT Hóa học 12
Hãy dẫn ra những phản ứng để chứng tỏ rằng từ Be đến Ca, tính kim loại của các nguyên tố tăng dần.
-
Bài tập 26.20 trang 60 SBT Hóa học 12
Sục hỗn hợp khí CO2 và CO vào dung dịch Ca(OH)2 thấy có kết tủa. Lọc bỏ kết tủa, thu được dung dịch nước lọc. Đổ dung dịch NaOH vào nước lọc thấy xuất hiện kết tủa. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm trên.
-
Bài tập 26.21 trang 60 SBT Hóa học 12
Nước trong vùng có núi đá vôi thuộc loại nước cứng. Viết phương trình hoá học của các phản ứng mô tả sự tạo thành nước cứng.
-
Bài tập 26.22 trang 60 SBT Hóa học 12
Về mặt hoá học thì nước có tính cứng tạm thời và nước có tính cứng vĩnh cửu khác nhau ở điểm nào ?
-
Bài tập 26.23 trang 60 SBT Hóa học 12
Có 4 cốc đựng riêng biệt các loại nước: nước cất, nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần. Hãy xác định loại nước đựng trong 4 cốc trên bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng đã dùng.
-
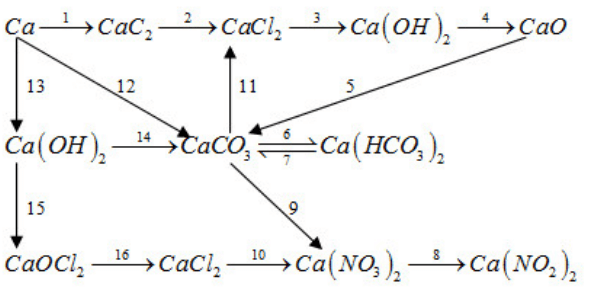
Bài tập 26.24 trang 61 SBT Hóa học 12
Viết PTHH của các phản ứng trong sơ đồ biến hoá sau :
-
Bài tập 26.25 trang 61 SBT Hóa học 12
Viết phương trình phản ứng trong sơ đồ biến hóa sau:
MgCl2 (1) → Mg (2) → MgO (3) → Mg(NO3)2 (4) → MgO (5) → MgCl2 (6) → Mg(OH)2 (7) → MgO (8) → MgSO4 (9) → MgCO3 (10) → Mg(HCO3)2
-
Bài tập 26.26 trang 61 SBT Hóa học 12
Hỗn hợp X chứa K20, NH4Cl, NaHCO3 và BaCl2 có số mol mỗi chất đều bằng nhau. Cho hỗn hợp X vào nước dư, đun nóng thu được dung dịch Y. Xác định các ion có trong dung dịch Y.
-
Bài tập 26.27 trang 61 SBT Hóa học 12
Cho 8 g hỗn hợp gồm một kim loại kiềm thổ và oxit của nó tác dụng vừa đủ với 1 lít dung địch HCl 0,5M. Xác định kim loại kiềm thổ.
-
Bài tập 26.28 trang 61 SBT Hóa học 12
Khi lấy 11,1 g muối clorua của một kim loại chỉ có hoá trị II và một lượng muối sunfat của kim loại đó có cùng số mol, thấy khác nhau 2,5 g. Xác định công thức hoá học của hai muối.
-
Bài tập 26.29 trang 61 SBT Hóa học 12
Sục V lít khí CO2 (đktc) vào bình đựng 2 lít dung dịch Ca(OH)2 0,0IM, thu được 1 g kết tủa. Xác định V
-
Bài tập 26.30 trang 61 SBT Hóa học 12
Chỉ dùng nước và dung dịch HCl hãy trình bày cách nhận biết 4 chất rắn (đựng trong 4 lọ riêng biệt): Na2CO3, CaCO3, Na2SO4, CaSO4.2H2O.
-
Bài tập 26.31 trang 61 SBT Hóa học 12
Hoà tan 23,9 g hỗn hợp bột BaCO3 và MgCO3 trong nước cần 3,36 lít CO2 (đktc). Xác định khối lượng của mỗi muối trong hỗn hợp?