Nß╗Öi dung b├Āi giß║Żng Luyß╗ćn tß║Łp: Li├¬n kß║┐t h├│a hß╗Źc cß╗¦ng cß╗æ lß║Īi kiß║┐n thß╗®c vß╗ü c├Īc loß║Īi li├¬n kß║┐t h├│a hß╗Źc ch├Łnh ─æß╗ā vß║Łn dß╗źng, giß║Żi th├Łch sß╗▒ h├¼nh th├Ānh mß╗Öt sß╗æ loß║Īi ph├ón tß╗Ł. ─Éß║Ęc ─æiß╗ām cß║źu tr├║c v├Ā ─æß║Ęc ─æiß╗ām li├¬n kß║┐t cß╗¦a ba loß║Īi tinh thß╗ā. R├©n k─® n─āng x├Īc ─æß╗ŗnh h├│a trß╗ŗ v├Ā sß╗æ oxi h├│a cß╗¦a nguy├¬n tß╗æ trong ─æŲĪn chß║źt v├Ā hß╗Żp chß║źt.
T├│m tß║»t l├Į thuyß║┐t
1.1. So s├Īnh li├¬n kß║┐t ion v├Ā li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ
| Loß║Īi li├¬n kß║┐t |
Liên kết ion |
Li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ |
|
|
Không cực |
Có cực | ||
|
─Éß╗ŗnh ngh─®a |
Li├¬n kß║┐t ion l├Ā li├¬n kß║┐t ─æŲ░ß╗Żc h├¼nh th├Ānh bß╗¤i lß╗▒c h├║t t─®nh ─æiß╗ćn giß╗»a c├Īc ion mang ─æiß╗ćn t├Łch tr├Īi dß║źu. |
Li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ l├Ā li├¬n kß║┐t ─æŲ░ß╗Żc tß║Īo n├¬n giß╗»a hai nguy├¬n tß╗Ł bß║▒ng mß╗Öt hay nhiß╗üu cß║Ęp electron chung. |
|
|
Bß║Żn chß║źt cß╗¦a li├¬n kß║┐t |
Cho v├Ā nhß║Łn electron |
─É├┤i electron chung kh├┤ng lß╗ćch vß╗ü nguy├¬n tß╗Ł n├Āo. |
─É├┤i e chung lß╗ćch vß╗ü nguy├¬n tß╗Ł n├Āo c├│ ─æß╗Ö ├óm ─æiß╗ćn lß╗øn hŲĪn. |
| Hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn |
Ōēź 1,7 |
0 ŌåÆ 0,4 |
0,4 ŌåÆ < 1,7 |
1.2. So s├Īnh tinh thß╗ā ion, tinh thß╗ā nguy├¬n tß╗Ł, tinh thß╗ā ph├ón tß╗Ł
| Tinh thß╗ā ion | Tinh thß╗ā nguy├¬n tß╗Ł | Tinh thß╗ā ph├ón tß╗Ł | |
| Kh├Īi niß╗ćm | C├Īc cation v├Ā anion ─æŲ░ß╗Żc ph├ón bß╗æ lu├ón phi├¬n ─æß╗üu ─æß║Ęn ß╗¤ c├Īc ─æiß╗ām n├║t cß╗¦a mß║Īng tinh thß╗ā ion | ß╗× c├Īc ─æiß╗ām n├║t mß║Īng tinh thß╗ā nguy├¬n tß╗Ł l├Ā nhß╗»ng nguy├¬n tß╗Ł | ß╗× c├Īc ─æiß╗ām n├║t cß╗¦a mß║Īng tinh thß╗ā ph├ón tß╗Ł l├Ā c├Īc ph├ón tß╗Ł |
| Lß╗▒c li├¬n kß║┐t | C├Īc ion mang ─æiß╗ćn t├Łch tr├Īi dß║źu h├║t nhau bß║▒ng lß╗▒c h├║t t─®nh ─æiß╗ćn, lß╗▒c n├Āy lß╗øn. | C├Īc nguy├¬n tß╗Ł li├¬n kß║┐t vß╗øi nhau bß║▒ng lß╗▒c li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ. Lß╗▒c n├Āy rß║źt lß╗øn. | C├Īc ph├ón tß╗Ł li├¬n kß║┐t vß╗øi nhau bß║▒ng lß╗▒c h├║t giß╗»a c├Īc ph├ón tß╗Ł, yß║┐u hŲĪn nhiß╗üu lß╗▒c h├║t t─®nh ─æiß╗ćn giß╗»a c├Īc ion v├Ā lß╗▒c li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ |
| ─Éß║Ęc t├Łnh | Bß╗ün, kh├Ī rß║»n, kh├│ bay hŲĪi, kh├│ n├│ng chß║Ży | Bß╗ün, kh├Ī cß╗®ng, kh├│ n├│ng chß║Ży, kh├│ bay hŲĪi | Kh├┤ng bß╗ün, dß╗ģ n├│ng chß║Ży, dß╗ģ bay hŲĪi |
B├Āi tß║Łp minh hß╗Źa
B├Āi 1:
Dß╗▒a v├Āo gi├Ī trß╗ŗ hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn cß╗¦a 2 nguy├¬n tß╗Ł, h├Ży x├Īc ─æß╗ŗnh loß║Īi li├¬n kß║┐t trong c├Īc ph├ón tß╗Ł sau:
|
Ph├ón tß╗Ł |
Hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn |
Loß║Īi li├¬n kß║┐t |
|
H2S |
||
|
NH3 |
||
|
CaS |
||
|
H2O |
||
|
BaF2 |
||
|
Cl2 |
Cho biß║┐t gi├Ī trß╗ŗ ─æß╗Ö ├óm ─æiß╗ćn cß╗¦a c├Īc nguy├¬n tß╗æ nhŲ░ sau:
| Ca | Ba | H | S | N | Cl | O | F |
| 1,0 | 0,89 | 2,2 | 2,58 | 3,04 | 3,16 | 3,44 | 3,98 |
HŲ░ß╗øng dß║½n:
|
Ph├ón tß╗Ł |
Hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn |
Loß║Īi li├¬n kß║┐t |
|
H2S |
2,58 ŌĆō 2,2 = 0,38 <0,4 |
Li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ kh├┤ng cß╗▒c |
|
NH3 |
3,04 - 2,2 = 0,84 > 0,4 |
Li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ c├│ cß╗▒c |
|
CaS |
2,58 ŌĆō 1,0 = 1,58 >0,4 |
Li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ c├│ cß╗▒c |
|
H2O |
3,44 ŌĆō 2,2 = 1,24 >0,4 |
Li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ c├│ cß╗▒c |
|
BaF2 |
3,98 ŌĆō0,89 =3,09 >1,7 |
Liên kết ion |
|
Cl2 |
0 |
Li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ kh├┤ng cß╗▒c |
B├Āi 2:
X├Īc ─æß╗ŗnh sß╗æ oxi h├│a cß╗¦a nguy├¬n tß╗æ trung t├óm trong c├Īc hß╗Żp chß║źt sau: HNO3, H2S, NaNO3, K2SO4, KMnO4, K2Cr2O7
HŲ░ß╗øng dß║½n:
HNO3: N c├│ sß╗æ oxi h├│a l├Ā +5
H2S: S c├│ sß╗æ oxi h├│a l├Ā -2
NaNO3: N c├│ sß╗æ oxi h├│a l├Ā +5
K2SO4: S c├│ sß╗æ oxi h├│a l├Ā +6
KMnO4: Mn c├│ sß╗æ oxi h├│a l├Ā +7
K2Cr2O7: Cr c├│ sß╗æ oxi h├│a l├Ā +6
3. Luyß╗ćn tß║Łp B├Āi 16 H├│a hß╗Źc 10
Sau b├Āi hß╗Źc cß║¦n nß║»m:
- Kiß║┐n thß╗®c vß╗ü c├Īc loß║Īi li├¬n kß║┐t h├│a hß╗Źc ch├Łnh ─æß╗ā vß║Łn dß╗źng, giß║Żi th├Łch sß╗▒ h├¼nh th├Ānh mß╗Öt sß╗æ loß║Īi ph├ón tß╗Ł.
- ─Éß║Ęc ─æiß╗ām cß║źu tr├║c v├Ā ─æß║Ęc ─æiß╗ām li├¬n kß║┐t cß╗¦a ba loß║Īi tinh thß╗ā.
- X├Īc ─æß╗ŗnh h├│a trß╗ŗ v├Ā sß╗æ oxi h├│a cß╗¦a nguy├¬n tß╗æ trong ─æŲĪn chß║źt v├Ā hß╗Żp chß║źt.
3.1. Trß║»c nghiß╗ćm
B├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 10 B├Āi 16 c├│ phŲ░ŲĪng ph├Īp v├Ā lß╗Øi giß║Żi chi tiß║┐t gi├║p c├Īc em luyß╗ćn tß║Łp v├Ā hiß╗āu b├Āi.
-
- A. -1, +1, +5, +1, +7
- B. -1, +1, +3, +1, +5
- C. -1, -1, +5, +1, +7
- D. -1, +1, +7, +1, +5
-
-
A.
-
B.
-
C.
-
D.
-
A.
-
- A. ion.
- B. cß╗Öng ho├Ī trß╗ŗ ph├ón cß╗▒c.
- C. cß╗Öng ho├Ī trß╗ŗ kh├┤ng ph├ón cß╗▒c.
- D. phß╗æi tr├Ł.
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK v├Ā N├óng cao
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung b├Āi hß╗Źc th├┤ng qua phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 10 B├Āi 16.
B├Āi tß║Łp 1 trang 76 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 2 trang 76 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 3 trang 76 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 4 trang 76 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 5 trang 76 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 6 trang 76 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 8 trang 76 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 9 trang 76 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 7 trang 76 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 16.1 trang 37 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.2 trang 37 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.3 trang 37 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.4 trang 37 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.5 trang 37 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.6 trang 38 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.7 trang 38 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.8 trang 38 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.9 trang 38 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.10 trang 38 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.11 trang 39 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.12 trang 39 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.13 trang 39 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.14 trang 39 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.15 trang 39 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.16 trang 39 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.17 trang 39 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.18 trang 39 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.19 trang 39 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 16.20 trang 39 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 1 trang 87 SGK H├│a hß╗Źc 10 n├óng cao
B├Āi tß║Łp 2 trang 87 SGK H├│a hß╗Źc 10 n├óng cao
B├Āi tß║Łp 3 trang 87 SGK H├│a hß╗Źc 10 n├óng cao
B├Āi tß║Łp 4 trang 87 SGK H├│a hß╗Źc 10 n├óng cao
B├Āi tß║Łp 5 trang 87 SGK H├│a hß╗Źc 10 n├óng cao
4. Hß╗Åi ─æ├Īp vß╗ü B├Āi 16 ChŲ░ŲĪng 3 H├│a hß╗Źc 10
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ bß║źt k├¼ thß║»c mß║»c g├¼, c├Īc em h├Ży ─æß╗ā lß║Īi lß╗Øi nhß║»n ß╗¤ mß╗źc Hß╗Åi ─æ├Īp ─æß╗ā c├╣ng cß╗Öng ─æß╗ōng H├│a HOC247 thß║Żo luß║Łn v├Ā trß║Ż lß╗Øi nh├®.


.PNG)
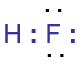

.PNG)









