Những hợp chất khí nào là nguyên nhân gây ra mưa axit? Có hợp chất của nitơ là NO2, kết hợp với nước tạo nên một loại axit, axit này có những tính chất gì mà có thể gây hại đến những công trình xây dựng... Hôm nay chúng ta sẽ tìm hiểu nội dung bài học Axit nitric và muối nitrat.
Tóm tắt lý thuyết
1.1. AXIT NITRIC
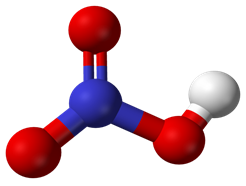
1.1.1. Cấu tạo phân tử
Hình 1: Công thức cấu tạo HNO3
Hình 2: Mô hình phân tử HNO3
-
Trong ptử HNO3: N có số oxi hóa là +5
1.1.2. Tính chất vật lí
- Axit nitric tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm.
- Axit nitric kém bền. Ngay ở điều kiện thường, khi có ảnh sáng, dung dịch axit nitric bị phân hủy một phần giải phóng nitơ đioxit. Khí này tan trong dung dịch axit làm dung dịch có màu vàng.
Hình 3: Sự phân hủy HNO3 dưới tác dụng của ánh sáng
- Axit nitric tan trong nước ở bất kì tỉ lệ nào. Trong phòng thí nghiệm thường có loại HNO3 nồng độ 68%.
1.1.3. Tính chất hóa học
-
HNO3 phân li tạo H+ và NO3- ⇒ là axit mạnh
-
\(H\mathop N\limits^{ + 5} {O_3}\) với N có số oxi hóa cao nhất ⇒ tính oxi hóa
Hình 4: N trong axit nitric nhận e thể hiện tính oxi hóa
Tính axit
HNO3 là axít mạnh
- Quỳ tím hoá đỏ
- Tác dụng với oxít bazơ, bazơ, muối của các axít yếu tạo muối nitrat.
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 +Ca(OH)2 → Ca(NO3)2+2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + CO2 + H2O
- Các em chú ý quan sát thí nghiệm sau đây:
Video 1: phản ứng giữa Na2CO3 và HNO3
- Hiện tượng: Bột Na2CO3 tan ra. xuất hiện khí không màu
- Giải thích: Phản ứng giữa Na2CO3 và HNO3 diễn ra, tạo khí không màu là CO2
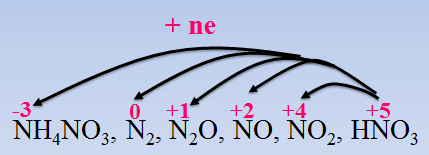
Tính oxi hoá
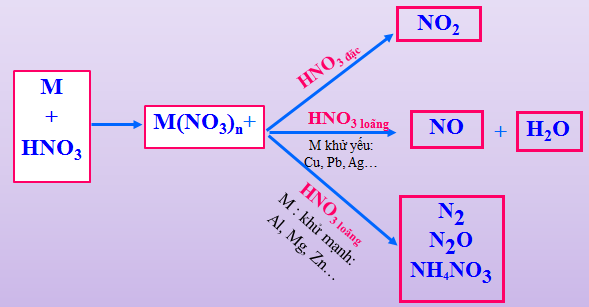
HNO3 có số oxi hóa +5 có thể bị khử thành: \(\mathop {{N_2}}\limits^0 ,{\rm{ }}\mathop {{N_2}}\limits^{ + 1} O,{\rm{ }}\mathop N\limits^{ + 2} O,{\rm{ }}\mathop N\limits^{ + 4} {O_2},{\rm{ }}\mathop N\limits^{ - 3} {H_4}\mathop N\limits^{ + 5} {O_3}\)tuỳ theo nồng độ HNO3 và khả năng khử của chất tham gia.
Tác dụng với kim loại
Hình 5: Các sản phẩm khử của HNO3
Với M là kim loại, n là hóa trị cao nhất của M
*Lưu ý:
N2O là khí vui, khí gây cười.
N2 không duy trì sự sống, sự cháy
NH4NO3 không sinh ra ở dạng khí, nhưng khi cho kiềm vào dd, thấy có khí mùi khai.
- Oxi hoá hầu hết kim loại (trừ Au, Pt).
3Cu +8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3đ → Cu(NO3)2 + 2NO2 + 2H2O
- Fe, Al, Cr thụ động hoá với HNO3 đặc, nguội.
- Các em chú ý quan sát các thí nghiệm sau đây:
Video 2: Phản ứng của đồng tiền (Đồng) và axit nitric
- Hiện tượng: Đồng tiền với chất liệu bằng đồng tan ra, sủi bọt khí không màu, sau đó hóa nâu trong không khí, dung dịch chuyển thành màu xanh
- Giải thích: Đồng phản ứng với dung dịch axit nitric tạo dung dịch Cu2+ có màu xanh đặc trưng, thoát ra khí NO, khí NO phản ứng với oxi không khí tạo ra NO2 có màu nâu đỏ.
Tác dụng với phi kim
HNO3 đặc, nóng oxi hóa được một số phi kim C,S,P,... tạo NO2
\(\begin{array}{l} \mathop C\limits^0 + 4H\mathop N\limits^{ + 5} {O_3} \to \mathop C\limits^{ + 4} {O_2} + 4\mathop N\limits^{ + 4} {O_2} + 2{H_2}O\\ \mathop S\limits^0 + H\mathop N\limits^{ + 5} {O_3} \to {H_2}\mathop S\limits^{ + 6} {O_4} + 6\mathop N\limits^{ + 4} {O_2} + 2{H_2}O \end{array}\)
Video 3: Phản ứng giữa HNO3 và S
- Hiện tượng: Bột lưu huỳnh tan ra một phần, có khí thoát ra. Khi thử dung dịch tạo thành bằng dung dịch BaCl2 thấy có kết tủa trắng
- Giải thích: HNO3 phản ứng với S tạo khí NO2. Sản phẩm tạo thành có chứa H2SO4 nên khi thử dung dịch bằng BaCl2 thấy có kết tủa trắng BaSO4
Tác dụng với hợp chất
- HNO3 đặc oxi hoá nhiều hợp chất vô cơ và hữu cơ
\(\mathop {Fe}\limits^{ + 2} O + H\mathop N\limits^{ + 5} {O_3} \to \mathop {Fe}\limits^{ + 3} {(N{O_3})_3} + \mathop N\limits^{ + 4} {O_2} + 2{H_2}O\)
- Vải, giấy, mùn cưa, dầu thông….bị phá huỷ khi tiếp xúc HNO3 đặc
1.1.4. Ứng dụng
Hình 5: Ứng dụng axit nitric và muối nitrat
1.1.5. Điều chế
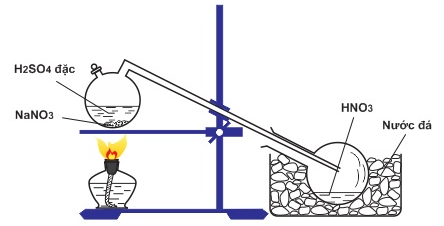
Trong phòng thí nghiệm
Cho tinh thể NaNO3 (hoặc KNO3) tác dụng với H2SO4 đặc, đun nóng
NaNO3 + H2SO4(đ) .PNG)
Hình 6: Điều chế HNO3 trong phòng thí nghiệm
Trong Công nghiệp
Sản xuất HNO3 từ NH3, không khí: Gồm 3 giai đoạn
- Oxi hoá khí NH3 bằng oxi kk thành NO:
4NH3+ 5O2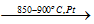
- Oxi hoá NO thành NO2 bằng oxi kk ở điều kiện thường :
2NO + O2 → 2NO2
- NO2 tác dụng với nước và oxi không khí tạo HNO3:
4NO2 + O2 + 2H2O → 4HNO3
Dung dịch HNO3 có nồng độ 52 – 68 %
→ Để HNO3 có nồng độ cao hơn: Chưng cất với H2SO4 đậm đặc.
1.2. MUỐI NITRAT M(NO3)n
1.2.1. Tính chất của muối nitrat
Tính chất vật lý
Tất cả các muối nitrat đều tan trong nước và là chất điện li mạnh.
Ca(NO3)2 → Ca 2+ + 2NO3-
KNO3 → K+ + NO3-
Tính chất hoá học
Các muối nitrat đều kém bền bởi nhiệt, khi đun nóng muối nitrat có tính OXH mạnh.
Sản phẩm phân huỷ phụ thuộc vào bản chất của cation kim loại:
- Kim loại đứng trước Mg
muối Nitrit + O2
Ví dụ: 2KNO3 .PNG)
-
Từ Mg đến Cu
Oxit kim loại + NO2 + O2
Ví dụ: 2Cu(NO3)2 .PNG)
-
Kim loại sau Cu
Kim loại + NO2 + O2
Ví dụ: 2AgNO3 .PNG)
1.2.2. Ứng dụng của muối nitrat
- Phân đạm trong nông nghiệp như NH4NO3, NaNO3, KNO3, Ca(NO3)2, ...
- Kali nitrat còn được sử dụng làm thuốc nổ đen (thuốc nổ có khói)
1.3. CHU TRÌNH CỦA NITƠ TRONG TỰ NHIÊN
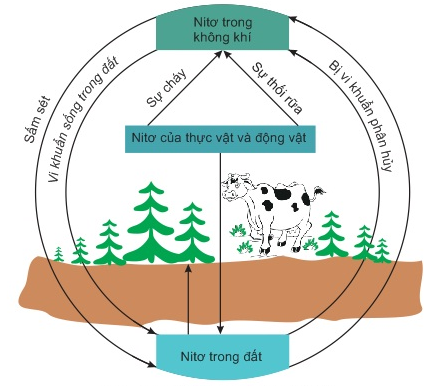
Hình 7: Chu trình của Nitơ trong tự nhiên
(1). Cây xanh đồng hóa nitơ chủ yếu ở dạng muối nitrat và muối amoni, chuyển hóa thành protein thực vật. Động vật đồng hóa protein thực vật, tạo ra protein động vật. Các chất hữu cơ do động vật bài tiết ra (phân, nước tiểu,...) cũng như xác động vật lại chuyển thành hợp chất hữu cơ chứa nitơ. Nhờ những loại vi khuẩn khác nhau có trong đất, một phần các hợp chất này chuyển hóa thành amoniac, rồi thành muối nitrat, phần còn lại thoát ra ở dạng nitơ tự do bay vào khí quyển. Khi các chất hữu cơ (than gỗ, than đá, than bùn,...) bị đốt cháy, nitơ tự do cũng được thoát ra.
(2). Trên thực tế, có một số quá trình tự nhiên cho phép bù lại một phần lượng nitơ bị mất.
- Trong mưa giông, khi có sự phóng điện do sấm sét một phần nitơ tự do trong khí quyển kết hợp với oxi tạo thành khí NO, rồi chuyển hóa thành HNO3 và theo nước mưa thấm vào đất. HNO3 chuyển thành muối nitrat khi kết hợp với muối cacbonat, thí dụ canxi cacbonat có trong đất.
- Một số loại vi khuẩn, đặc biệt là các vi khuẩn cố định đạm sống ở rễ cây họ đậu có khả năng hấp thụ nitơ từ khí quyển và chuyển hóa thành các hợp chất chứa nitơ.
(3). Để tăng năng suất mùa màng, lượng nitơ chuyển từ khí quyển vào đất vẫn không thể đủ. Người ta ước tính lượng nitrat tái sinh tự nhiên chỉ bằng một nửa lượng nitrat bị hấp thụ. Do đó, cần phải bón vào đất những hợp chất chứa nitơ dưới dạng các loại phân bón hữu cơ và vô cơ.
Bài tập minh họa
Bài 1:
Cho hỗn hợp rắn gồm Mg, MgCO3 vào dung dịch HNO3 dư thu được một chất khí duy nhất và dung dịch X. Nhỏ dung dịch NaOH dư vào dung dịch X thu được kết tủa và khí thoát ra. Sản phẩm khử HNO3 là
Hướng dẫn:
MgCO3 khi phản ứng với axit tạo khí CO2 ⇒ chính là khí duy nhất trong bài.
Vậy Mg + HNO3 tạo sản phẩm khử không phải là khí ⇒ chỉ có thể là NH4NO3.
Bài 2:
Cho 11 gam hỗn hợp Al và Fe vào dung dịch HNO3 loãng dư thì có 6,72 lit khí NO bay ra (đkc). Tính khối lượng mỗi kim loại trong hỗn hợp?
Hướng dẫn:
Gọi x, y lần lượt là số mol Al và Fe trong hỗn hợp, ta có: 27x + 56y = 11 (1)
PTPƯ:
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
x mol x mol
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
y mol y mol
Tổng số mol khí thu được:
\({n_{NO}} = x + y = \frac{{6,72}}{{22,4}} = 0,3(mol)\) (2)
Từ (1) và (2) ta có hệ phương trình:
\(\left\{ \begin{array}{l} 27x + 56y = 11\\ x + y = 0,3 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} x = 0,2\\ y = 0,1 \end{array} \right.\)
Khối lượng Al=27.0,2=5,4 (g)
Khối lượng Fe= 11-5,4=5,6 (g)
Bài 3:
Hoà tan hoàn toàn 2,32 gam hỗn hợp FeO và Fe2O3 vào dung dịch HNO3 đặc, dư thì thu được 0,224 lít khí NO2 (đtc). Tính khối lượng muối Fe(NO3)2 tạo thành sau phản ứng?
Hướng dẫn:
Số mol khí = \(\frac{{0,224}}{{22,4}} = 0,01(mol)\)
FeO+ 4HNO3 → Fe(NO3)3 +NO2 + 2H2O
0,01mol 0,01mol 0,01mol
Khối lượng Fe2O3= 2,32-72.0,01=1,6 (g)
→ \({n_{F{e_2}{O_3}}} = \frac{{1,6}}{{160}} = 0,01(mol)\)
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,01mol 0,02mol
Khối lượng muối=242.0,03=7,26 (g)
3. Luyện tập Bài 9 Hóa học 11
Sau bài học cần nắm:
- Cấu tạo phân tử, tính chất vật lí (trạng thái, màu sắc, khối lượng riêng, tính tan), ứng dụng của HNO3.
- Cách điều chế HNO3 trong phòng thí nghiệm và trong công nghiệp (từ amoniac).
- Phản ứng đặc trưng của ion NO3- với Cu trong môi trường axit.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 9 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. CO2
- B. NO2
- C. Hỗn hợp CO2 và NO2
- D. Không có khí bay ra
-
- A. Fe(NO3)3 và Fe(NO3)2
- B. Fe(NO3)2 và Cu(NO3)2
- C. Fe(NO3)3 và Cu(NO3)2
- D. Fe(NO3)2
-
- A. HNO3 là axit yếu hơn H2SO4 nên bị đẩy ra khỏi muối
- B. HNO3 được sinh ra dưới dạng hơi nên cần làm lạnh để ngưng tụ
- C. Đốt nóng bình cầu bằng đèn cồn để phản ứng xảy ra nhanh hơn
- D. HNO3 có nhiêt độ sôi thấp (830C) nên dễ bị bay hơi khi đun nóng
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 9.
Bài tập 1 trang 45 SGK Hóa học 11
Bài tập 2 trang 45 SGK Hóa học 11
Bài tập 3 trang 45 SGK Hóa học 11
Bài tập 4 trang 45 SGK Hóa học 11
Bài tập 5 trang 45 SGK Hóa học 11
Bài tập 6 trang 45 SGK Hóa học 11
Bài tập 7 trang 45 SGK Hóa học 11
Bài tập 9.1 trang 14 SBT Hóa học 11
Bài tập 9.2 trang 14 SBT Hóa học 11
Bài tập 9.3 trang 14 SBT Hóa học 11
Bài tập 9.4 trang 14 SBT Hóa học 11
Bài tập 9.5 trang 14 SBT Hóa học 11
Bài tập 9.6 trang 15 SBT Hóa học 11
Bài tập 9.7 trang 15 SBT Hóa học 11
Bài tập 9.8 trang 15 SBT Hóa học 11
Bài tập 9.9 trang 15 SBT Hóa học 11
Bài tập 9.10 trang 15 SBT Hóa học 11
Bài tập 9.11 trang 15 SBT Hóa học 11
Bài tập 9.12 trang 16 SBT Hóa học 11
Bài tập 9.13 trang 16 SBT Hóa học 11
Bài tập 9.14 trang 16 SBT Hóa học 11
Bài tập 1 trang 55 SGK Hóa học 11 nâng cao
Bài tập 2 trang 55 SGK Hóa học 11 nâng cao
Bài tập 3 trang 55 SGK Hóa học 11 nâng cao
Bài tập 4 trang 55 SGK Hóa học 11 nâng cao
Bài tập 5 trang 55 SGK Hóa học 11 nâng cao
Bài tập 6 trang 55 SGK Hóa học 11 nâng cao
Bài tập 7 trang 55 SGK Hóa học 11 nâng cao
Bài tập 8 trang 55 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 9 Chương 2 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.


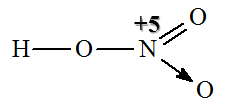


.PNG)











