Giải bài 4 tr 19 sách GK Hóa lớp 9
Bảng dưới đây cho biết kết quả của 6 thí nghiệm xảy ra giữa Fe và dung dịch H2SO4 loãng. Trong mỗi thí nghiệm người ta dùng 0,2 gam Fe tác dụng với thể tích bằng nhau của axit, nhưng có nồng độ khác nhau.
.jpg)
Những thí nghiệm nào chứng tỏ rằng:
a) Phản ứng xảy ra nhanh hơn khi tăng nhiệt độ?
b) Phản ứng xảy ra nhanh hơn khi tăng diện tích tiếp xúc?
c) Phản ứng xảy ra nhanh hơn khi tăng nồng độ axit?
Gợi ý trả lời bài 4
So sánh các điều kiện: nồng độ axit, nhiệt độ của dung dịch H2SO4 loãng và trạng thái của sắt với thời gian phản ứng để rút ra:
a) Thí nghiệm 4 và thí nghiệm 5 chứng tỏ phản ứng xảy ra nhanh hơn khi tăng nhiệt độ của dung dịch H2SO4 .
b) Thí nghiệm 3 và thí nghiệm 5 chứng tỏ phản ứng xảy ra nhanh hơn khi tăng diện tích tiếp xúc.
c) Thí nghiệm 4 và thí nghiệm 6 chứng tỏ phản ứng xảy ra nhanh hơn khi tăng nồng độ của dung dịch H2SO4.
-- Mod Hóa Học 9 HỌC247
Video hướng dẫn giải bài 4 SGK
-


CTHH của Axit nitric là công thức nào dưới đây?
bởi nguyen bao anh
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -


CTHH của Axit clohiđric là CT nào dưới đây?
bởi Aser Aser
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -


Axit tương ứng của \(SO_2\) ?
bởi Bo Bo
 12/07/2021
Theo dõi (0) 1 Trả lời
12/07/2021
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Gốc axit \(HNO_3\) có hóa trị bao nhiêu ?
bởi thi trang
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -


Xác định môi trường A biết có \(pH = 3\)?
bởi Mai Trang
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -


Nêu CT của axit sunfuric?
bởi Nguyễn Hồng Tiến
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -


Chất dùng để phân biệt các dung dịch không màu: HCl, \(H_2SO_4\) loãng, \(BaCl_2\) là:
bởi Hoàng My
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Nhỏ từ từ dung dịch \(BaCl_2\) vào dung dịch \(Na_2SO_4\) ta thấy xuất hiện
bởi Minh Thắng
 12/07/2021
Theo dõi (0) 1 Trả lời
12/07/2021
Theo dõi (0) 1 Trả lời -


Cho \(5,6\)g sắt tác dụng với axit clohiđric dư, sau phản ứng thể tích khí \(H_2\) thu được (ở đktc):
bởi Bảo Hân
 12/07/2021
Theo dõi (0) 1 Trả lời
12/07/2021
Theo dõi (0) 1 Trả lời -


Để nhận biết dung dịch axit sunfuric và dung dịch axit clohiđric ta dùng thuốc thử:
bởi Thùy Nguyễn
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Cho m gam bột magie vào axit sunfuric loãng dư, phản ứng hoàn toàn tạo ra 8,96 lít (đktc) khí hiđro. Giá trị của m là
bởi Nguyễn Trà Long
 12/07/2021
Theo dõi (0) 1 Trả lời
12/07/2021
Theo dõi (0) 1 Trả lời -


Cho một khối lượng bột kẽm dư vào 100 ml dung dịch \(HCl\). Kết thúc phản ứng thu được 3,36 lít khí (đktc). Nồng độ mol của dung dịch HCl đã dùng là
bởi Nguyễn Quang Thanh Tú
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -


Cho một khối lượng bột kẽm vào dung dịch \(HCl\) dư. Kết thúc phản ứng thu được 2,24 lít khí (đktc). Tính khối lượng kẽm đã dùng
bởi Hong Van
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -


Kim loại X tác dụng với \(H_2SO_4\) loãng giải phóng khí hiđro. Dẫn toàn bộ lượng hiđro trên qua ống nghiệm chứa oxit, nung nóng thu được kim loại Y. Hai chất X, Y lần lượt là:
bởi Naru to
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -


Gọi x, y lần lượt là số mol của NaOH và HCl. Trộn 2 dung dịch \(NaOH\) và HCl trên với nhau, tạo ra dung dịch có pH=7. Tìm biểu thức liên hệ giữa x và y.
bởi thu hảo
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -


Ống nghiệm (1) chứa 2ml dung dịch HCl 1M. Ống nghiệm (2) chứa 2ml dung dịch \(H_2SO_4\) 1M. Cho Zn dư vào hai dung dịch axit trên thì thể tích khí hidro thu được từ ống nghiệm (1) và (2) tương ứng là V1 và V2 đo ở cùng điều kiện. viết phương trình hóa học. So sánh V1 và V2.
bởi Nguyen Nhan
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -


Công thức hóa học của axit sunfuric là?
bởi Nguyen Phuc
 13/07/2021
Theo dõi (0) 1 Trả lời
13/07/2021
Theo dõi (0) 1 Trả lời -


Cho 10 gam hỗn hợp gồm cuo mgo al2o3 tác dụng vừa đủ với 100 mà dung dịch h2so4 1M. Sau phản ứng thu được dung dịch A chứa m gam muối. Tính m?
bởi Đặng Lê Thảo Nhi
 01/09/2020
01/09/2020
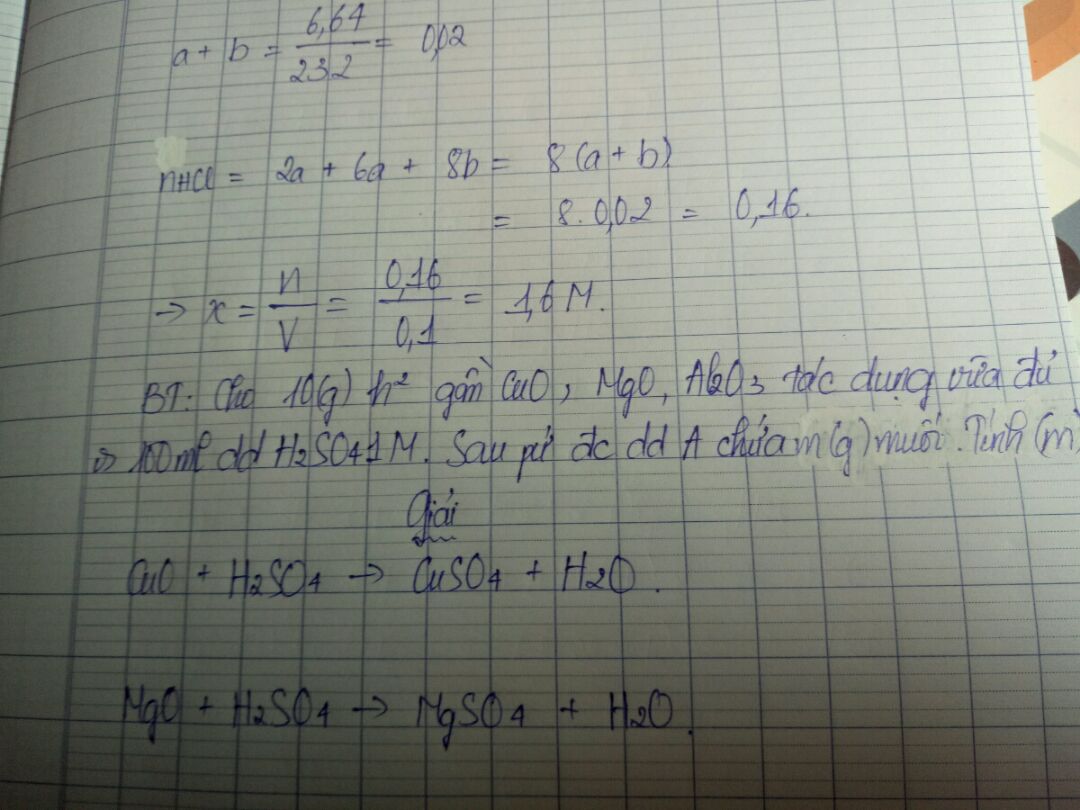 Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


Tính khối luồng axit cần dùng?
bởi Mai Le
 28/08/2020
Cho 40g CuO hoà tan trong dd H2SO4 10% ( vừa đủ). Câu a)Tính khối luồng axit cần dùng. Câu b) Tính nồng độ phần trăm của dd thu được sau phản ứngTheo dõi (0) 0 Trả lời
28/08/2020
Cho 40g CuO hoà tan trong dd H2SO4 10% ( vừa đủ). Câu a)Tính khối luồng axit cần dùng. Câu b) Tính nồng độ phần trăm của dd thu được sau phản ứngTheo dõi (0) 0 Trả lời
Bài tập SGK khác
Bài tập 2 trang 19 SGK Hóa học 9
Bài tập 3 trang 19 SGK Hóa học 9
Bài tập 5 trang 19 SGK Hóa học 9
Bài tập 6 trang 19 SGK Hóa học 9
Bài tập 7 trang 19 SGK Hóa học 9
Bài tập 4.1 trang 6 SBT Hóa học 9
Bài tập 4.2 trang 6 SBT Hóa học 9
Bài tập 4.3 trang 7 SBT Hóa học 9
Bài tập 4.4 trang 7 SBT Hóa học 9
Bài tập 4.5 trang 7 SBT Hóa học 9
Bài tập 4.6 trang 7 SBT Hóa học 9





