Giải bài 4 tr 9 sách GK Hóa lớp 9
Biết 2,24 lít khí CO2 (đktc) tác dụng vừa hết với 200 ml dung dịch Ba(OH)2 sản phẩm là BaCO3 và H2O:
a) Viết phương trình hóa học
b) Tính nồng độ mol của dung dịch Ba(OH)2 đã dùng
c) Tính khối lượng chất kết tủa thu được.
Hướng dẫn giải chi tiết bài 4
\(n_{CO_{2}} =\frac{ 2,24 }{ 22,4} =0,1 \ mol\)
a) Phương trình phản ứng hóa học:
CO2 + Ba(OH)2 → BaCO3↓ + H2O
b) Dựa vào phương trình phản ứng trên ta nhận thấy:
nBa(OH)2 = nCO2 = 0,1 mol.
⇒ CBa(OH)2 = 0,5 mol/lít.
c) Dựa vào phương trình phản ứng trên ta có:
nBaCO3 = nCO2 = 0,1 mol.
⇒ mBaCO3 = 0,1 x 197 = 19,7 g.
-- Mod Hóa Học 9 HỌC247
Video hướng dẫn giải bài 4 SGK
-


Dãy các chất tác dụng với lưu huỳnh đioxit là:
bởi Tieu Giao
 15/01/2021
15/01/2021
A. Na2O, CO2, NaOH, Ca(OH)2
B. CaO, K2O, KOH, Ca(OH)2
C. HCl, Na2O, Fe2O3, Fe(OH)3
D. Na2O, CuO, SO3, CO2
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


A. CaCO3 và HCl
B. Na2SO3 và H2SO4
C. CuCl2 và KOH
D. K2CO3 và HNO3
Theo dõi (0) 1 Trả lời -


Để phân biệt 2 lọ mất nhãn đựng CaO và MgO ta dùng thuốc thử là gì?
bởi Nguyễn Phương Khanh
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Tính nồng độ % của chất có trong dung dịch sau phản ứng?
bởi Huy Gia
 13/09/2020
13/09/2020
a) Sau phản ứng còn dư chất nào ? dư ? g
b) Tính khối lượng natri sunfat (Na2SO4)
c) Tính nồng độ % của chất có trong dd sau phản ứng?
Theo dõi (0) 0 Trả lời -


Hòa tan 5,6 gam fe vào 200g dung dịch h2 SO4 9,8% thu được FeSO4 và khí h2 tìm nồng độ phần trăm của các chất sau phản ứng?
bởi KSK
 07/09/2020
Hòa tan 5,6 gam fe vào 200 gam dung dịch h2 SO4 9,8% thu được FeSO4 và khí h2 tìm nồng độ phần trăm của các chất sau phản ứngTheo dõi (0) 0 Trả lời
07/09/2020
Hòa tan 5,6 gam fe vào 200 gam dung dịch h2 SO4 9,8% thu được FeSO4 và khí h2 tìm nồng độ phần trăm của các chất sau phản ứngTheo dõi (0) 0 Trả lời -


Tại sao khi tôi vôi phải dùng nhiều hơn lượng cần thiết?
bởi Hoa Nắng
 05/09/2020
Tại sao khi tôi vôi phải dùng nhiều hơn lượng cần thiết?Theo dõi (0) 0 Trả lời
05/09/2020
Tại sao khi tôi vôi phải dùng nhiều hơn lượng cần thiết?Theo dõi (0) 0 Trả lời -


Cho một ít na đã làm sạch cho vào cốc nước có chứa dd phenol phtalein rồi nhỏ từ từ dd HCl đến dư vào cốc. Nêu hiện tượng và viết phương trình hoá học xảy ra?
bởi Xiêm Dừa
 27/08/2020
27/08/2020
Cho một ít na đã làm sạch cho vào cốc nước có chứa dd phenol phtalein rồi nhỏ từ từ dd HCl đến dư vào cốc. Nêu hiện tượng và viết phương trình hoá học xảy ra
Theo dõi (0) 0 Trả lời -


Tính nồng độ mol dung dịch sau phản ứng biết rằng sự hòa tan không làm thay đổi thể tích dung dịch?
bởi Nguyễn Quốc Thánh Thánh
 27/08/2020
27/08/2020
Cho 52 gam hỗn hợp MgO về CuO tác dụng với 500ml dung dịch 3,2M HCL ,
a tính khối lượng phần trăm muối oxit
b tính nồng độ mol dung dịch sau phản ứng biết rằng sự hòa tan không làm thay đổi thể tích dung dịch
Theo dõi (0) 0 Trả lời -


Viết PT phản ứng xảy ra ?
bởi Minh Tuấn
 26/08/2020
26/08/2020
Để phản ứng vừa đủ với V lít khí SO3 (đktc) cần vừa đủ 150 ml dung dịch KOH 2M tạo thành muối trung hòa.
a) Viết PT phản ứng xảy ra
b) Tính giá trị của V
c) Tính nồng độ dung dịch sau phản ứng
Theo dõi (0) 2 Trả lời -


Tính khối lượng muối clorua tạo ra?
bởi Huyền Anh
 08/08/2020
Nung nóng 13,1 gam một hỗn hợp gồm Mg, Zn, Al trong ko khí đến phản ứng hoàn toàn thu được 20,3 gam hỗn hợp gồm MgO, ZnO, Al2O3. Hòa tan 20,3 gam hỗn hợp oxit trên cần dùng V lít dung dịch HCl 0,4M. a, Tính V b, Tính khối lượng muối clorua tạo raTheo dõi (0) 0 Trả lời
08/08/2020
Nung nóng 13,1 gam một hỗn hợp gồm Mg, Zn, Al trong ko khí đến phản ứng hoàn toàn thu được 20,3 gam hỗn hợp gồm MgO, ZnO, Al2O3. Hòa tan 20,3 gam hỗn hợp oxit trên cần dùng V lít dung dịch HCl 0,4M. a, Tính V b, Tính khối lượng muối clorua tạo raTheo dõi (0) 0 Trả lời -


cho 7,2 g hỗn hợp a gồm mgco3 và caco3 t/d hết dung dịch h2so4 loãng rồi cho toàn bộ khí thoát ra hấp thụ hết vào 450ml dung dịch ba(oh)2 0,2M thu đc 15.76 g kết tủa.Tính % về khối lượng mgco3 trong hỗn hợp?
bởi Nguyễn Ngọc Minh Quân
 26/07/2020
cho 7,2 g hỗn hợp a gồm mgco3 và caco3 t/d hết dung dịch h2so4 loãng rồi cho toàn bộ khí thoát ra hấp thụ hết vào 450ml dung dịch ba(oh)2 0,2M thu đc 15.76 g kết tủa.Tính % về khối lượng mgco3 trong hỗn hợpTheo dõi (0) 0 Trả lời
26/07/2020
cho 7,2 g hỗn hợp a gồm mgco3 và caco3 t/d hết dung dịch h2so4 loãng rồi cho toàn bộ khí thoát ra hấp thụ hết vào 450ml dung dịch ba(oh)2 0,2M thu đc 15.76 g kết tủa.Tính % về khối lượng mgco3 trong hỗn hợpTheo dõi (0) 0 Trả lời -


Chọn hệ số và CTHH thích hợp đặt vào những chỗ có dấu chấm hỏi trong phương trình hóa học sau: ? Na + ? → 2Na2O
bởi Nguyễn Thị Thanh
 01/06/2020
01/06/2020
A. 4, 1, O2
B. 1, 4, O2
C. 1, 1, O2
D. 2, 2, O2
Theo dõi (0) 5 Trả lời -


Oxit canxi tác dụng được với: nước (1), dung dịch axit HCl (2), khí CO2 (3), khí CO (4). Các tính chất đúng là:
bởi Anh Linh
 20/05/2020
20/05/2020
A.(1), (4)
B. (1), (2), (4)
C. (2), (3), (4)
D. (1), (2), (3)
Theo dõi (0) 5 Trả lời -


Để thu khí O2 từ hỗn hợp gồm: O2, CO2, SO2 người ta cho hỗn hợp khí đi qua:
bởi thuy linh
 21/05/2020
21/05/2020
A.dung dịch NaOH lấy dư
B. nước
C. CaO (rắn)
D. dung dịch axit sunfuric
Theo dõi (0) 5 Trả lời -


A. nước và quỳ tím
B. dung dịch HCl
C. nước
D. quỳ tím khô
Theo dõi (0) 5 Trả lời -


Cho các oxit: P2O5, CO2, SO2, CaO, Na2O. Oxit nào có khả năng tác dụng với nhau? Viết phương trình hóa học.
bởi Ánh tuyết
 21/05/2020
Theo dõi (0) 1 Trả lời
21/05/2020
Theo dõi (0) 1 Trả lời -


Chọn hóa chất thích hợp và viết phương trình hóa học để loại các khí SO2 và CO2 ra khỏi hỗn hợp với khí CO.
bởi Quynh Nhu
 20/05/2020
Theo dõi (0) 1 Trả lời
20/05/2020
Theo dõi (0) 1 Trả lời -


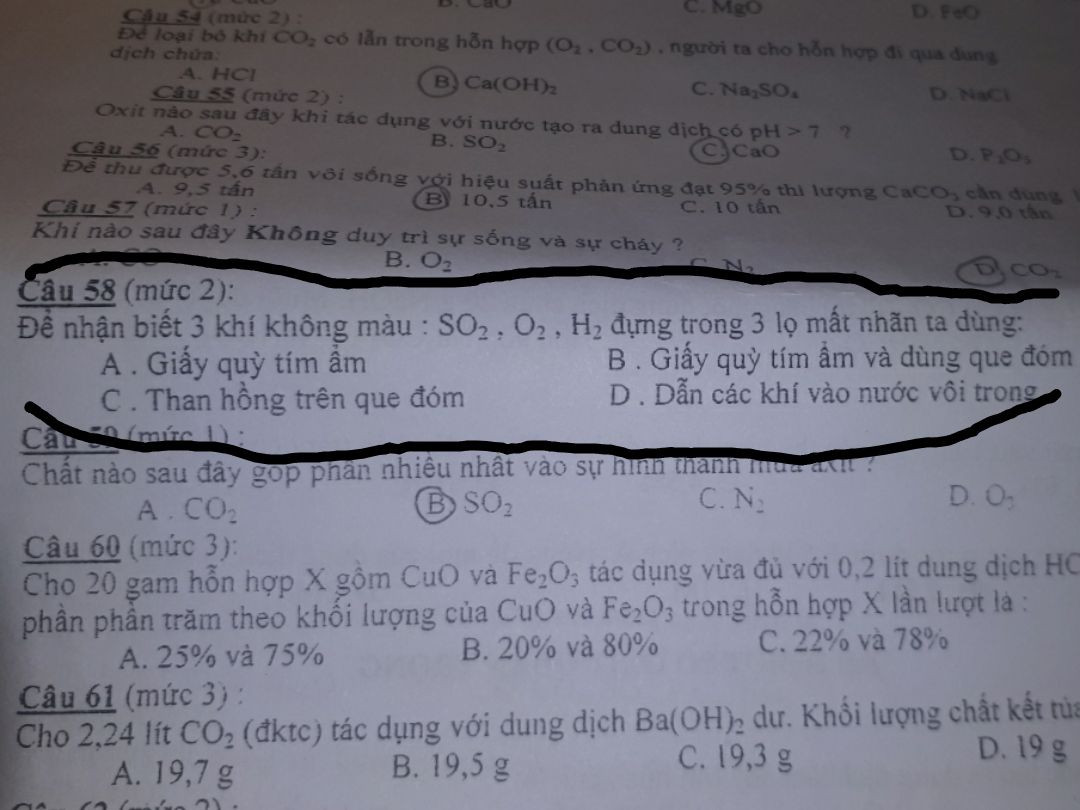 Theo dõi (0) 2 Trả lời
Theo dõi (0) 2 Trả lời -


Có mấy loại axit mỗi loại axit cho 2 ví dụ đọc tên và tính phân tử khối?
bởi Lường Huyền Châu
 30/03/2020
30/03/2020
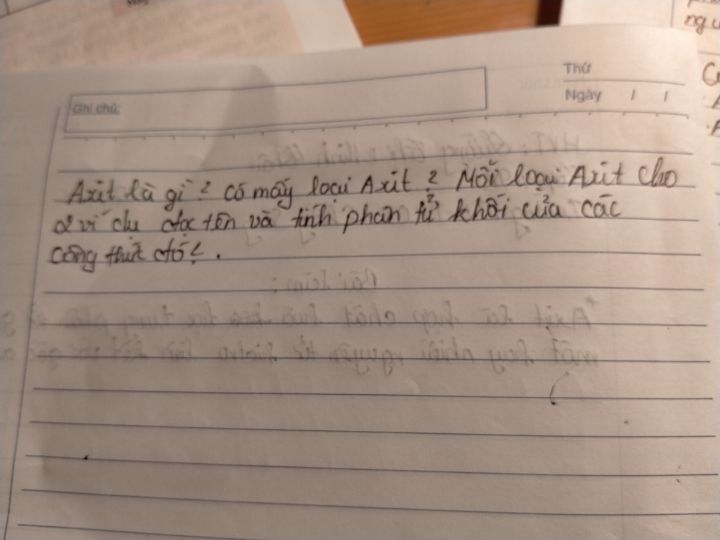 Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


Trong bình kín chứa hỗn hợp gồm SO2 SO3 và CO2 thể hơ trình bày phương pháp hóa học để nhận biết từng chất và viết phương trình phản ứng xảy ra?
bởi Nguyên Hz
 10/03/2020
Giải hộ mình vớiTheo dõi (0) 1 Trả lời
10/03/2020
Giải hộ mình vớiTheo dõi (0) 1 Trả lời -


Những chất tham gia phản ứng trùng hợp là?
bởi Momona Ichigo
 02/03/2020
02/03/2020
 Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


Kim loại nào sau đây không phản ứng với oxi?
bởi Momona Ichigo
 02/03/2020
02/03/2020
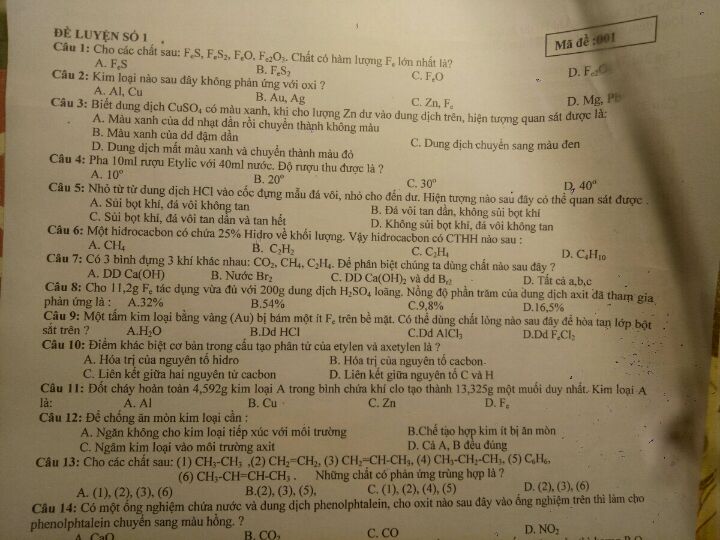 Theo dõi (1) 2 Trả lời
Theo dõi (1) 2 Trả lời -

 .............Theo dõi (0) 6 Trả lời
.............Theo dõi (0) 6 Trả lời -


Hòa tan hoàn toàn 8g oxit kim loại A, hóa trị 3 trong 300ml dung dịch H2SO4 thì thu được 20g muối khan. Tìm công thức của oxit giúp mình
Theo dõi (0) 1 Trả lời -

 Cho 5,1g oxit có hóa trị III, tác dụng với 43,8 g dung dịch HCL 25%. Tìm tên oxitTheo dõi (0) 3 Trả lời
Cho 5,1g oxit có hóa trị III, tác dụng với 43,8 g dung dịch HCL 25%. Tìm tên oxitTheo dõi (0) 3 Trả lời -


Nêu phương pháp nhận biết N2O5, CaO và CuO?
bởi Trúc Trúc
 13/06/2019
Bằng phương pháp nào nhận biết các chất rắn sau: N2O5, CaO, CuOTheo dõi (0) 3 Trả lời
13/06/2019
Bằng phương pháp nào nhận biết các chất rắn sau: N2O5, CaO, CuOTheo dõi (0) 3 Trả lời -


Tính khối lượng CuO và MgO
bởi hồng trang
 06/12/2018
06/12/2018
Cho 18g hỗn hợp A gồm CuO và MgO tác dụng vừa đủ với 600ml đ HNO\(_3\) 1M. Tính m\(_{CuO}\) và m\(_{MgO}\).
Theo dõi (0) 2 Trả lời -


Tính thể tích khí cacbonic thu được ở đktc
bởi Trần Thị Trang
 25/12/2018
25/12/2018
Nung 200g đá vôi (thành phần chính là CaCO3) chứa 5% tạp chất ta được vôi sống (CaO) và khí cacbonic
a/ Tính khối lượng vôi sống thu được
b/ Tính thể tích khí cacbonic thu được ở đktc
c/ Nếu sau phản ứng khối lượng vôi sống thu được là 90,44g thì hiệu suất phản ứng nung vôi đạt bao nhiêu phần trăm?
(Cho H=1 ; C=12; O-16; Ca=40; Mg=24; S=32)
Theo dõi (0) 1 Trả lời -


Tính nồng độ mol của dung dịch axit
bởi Nguyễn Thủy
 05/04/2019
05/04/2019
Bài:hòa tan 20.4g 1 KL A có hóa trị III trong 300ml dung dịch H2SO4 thu được 68.4g muối
a) tìm công thức của oxit
b) tính nồng độ mol của dung dịch axit
Theo dõi (0) 1 Trả lời -


Tính hiệu suất phản ứng khi cho CuO tác dụng với H2?
bởi can tu
 08/04/2019
08/04/2019
Dẫn khí hidro dư qua 32g bột đồng ooxxit màu đen đun nóng.Sau phản ứng kết thuk thu đc 12,8g kim loại đồng màu đỏ.tính hiệu suất của phản ứng
Theo dõi (0) 1 Trả lời -


Phân biệt các khí A.B.C.D.E.
bởi Hương Lan
 06/04/2019
06/04/2019
Cho các phản ứng sau:
MnO2+Hclđ\(\rightarrow\) khí A
Na2SO3+H2SO4\(\rightarrow\) khí B
FeS +HCl \(\rightarrow\)Khí C
NH4HCO3+ NaOH dư\(\rightarrow\)Khí d
Na2CO3 +H2SO4\(\rightarrow\) khí E
a, Xác định các khí A.B.C.D.E.
b, Cho A tác dụng với C, B tác dụng vs A,B tác dụng vs C,A tác dụng vs dd NaOH ở đk thường, E tác dụng vs dd NaOH.Viết các pthh xảy ra .
c, Có 3 bình khí A,B,E mất nhãn. Bằng pphh hãy phân biệt các khí
Theo dõi (0) 1 Trả lời -


Tính nồng độ mol của dung dịch axit
bởi Đào Thị Nhàn
 06/04/2019
06/04/2019
Bài1: cho 8g oxit của KL hóa trị III tác dụng hết với 300ml dung dịch HCl 1M. Xác định KL và công thức của oxit KL
Bài2:hòa tan 20.4g 1 KL A có hóa trị III trong 300ml dung dịch H2SO4 thu được 68.4g muối
a) tìm công thức của oxit
b) tính nồng độ mil của dung dịch axit
Theo dõi (0) 1 Trả lời -


Công thức của oxit sắt là gì ?
bởi Lê Minh Bảo Bảo
 06/04/2019
06/04/2019
Câu 1 : Cho 2,32g hh gồm FeO , Fe2O3 , Fe3O4 ( trong đó số mol FeO bằng số mol Fe2O3 ) tác dụng vừ đủ với V lit dd HCl 1M . Giá trị của V ?
Câu 2 : Khử hoàn toàn 11,6g oxit sắt bằng CO ở nhiệt độ cao . Sản phẩm khí dẫn vào dd Ca(OH)2 dư , tạo ra 20g kết tủa . Công thứ của oxit sắt là ?
Câu 3 : X là 1 oxit sắt . Biết 1,6g X tác dụng vừa hết với 30ml dd HCl 2M . X là oxit nào của sắt ?
Theo dõi (0) 1 Trả lời -


Tính C% dung dịch muối sau phản ứng
bởi Thụy Mây
 06/04/2019
06/04/2019
. Cho 6g hỗn hợp gồm: Mg, MgO ác dụng với dung dịch HCl vừa đủ. Sau phản ứng thu được 2,24l khí(đktc)
a) Tính khối lượng mỗi chất trong hỗn hợp ban đầu
b)Tính C% dung dịch muối sau phản ứng. Biết khối lượng dung dịch HCltham gia phản ứng là 120g
. Mọi người giúp Mai với ạ
Theo dõi (0) 1 Trả lời -


Xác định công thức phân tử của oxit sắt
bởi Nguyễn Tiểu Ly
 06/04/2019
06/04/2019
Chuyển hóa hoàn toàn 1,68g sắt thành một oxit sắt, sau đó hòa tan hết oxit sắt bằng dd H2SO4H2SO4 loãng 0,2 M thu được dd chứa 16,56 g muối.
a. Xác định công thức phân tử của oxit sắt.
b. Tính thể tích dd H2SO4H2SO4 đã dùng. Biết rằng lượng axit dùng dư 20% so vs lượng cần thiết.#mong các bạn giải cụ thể :)))
Theo dõi (0) 1 Trả lời -


Xác định oxit kim loại đã dùng
bởi Van Tho
 06/04/2019
06/04/2019
Hòa tan hoàn toàn m g một kim loại oxit hóa trị III cần b g dung dịch H2SO4 12,5% thì vừa đủ. Sau phản ứng, dung dịch muối có nồng độ 15,65%. Xác định oxit kim loại đã dùng.
Theo dõi (0) 1 Trả lời -


Cặp chất nào có thể tác dụng được với nhau
bởi Anh Trần
 06/04/2019
06/04/2019
Các chất sau :\(H_2O\) , KOH , K , O , \(CO_2\)
hãy cho biết những cặp chất có thể tác dụng vs nhau , viết pt
Theo dõi (0) 1 Trả lời -


Nhận biết các chất Al2O3, Fe2O3, P2O5
bởi thanh duy
 25/02/2019
25/02/2019
NHẬN BIẾT CÁC CHẤT
\(Al_2O_3,Fe_2O_3,P_2O_5\) giúp nhé
Theo dõi (0) 1 Trả lời -


cho 6, 72 lít khí CO phản ứng với 100 ml dung dịch KOH 2M tình khối lượng muối axit thu được
Theo dõi (0) 1 Trả lời -


đốt cháy m g hỗn hợp 3 kim loại mg zn cu thu dc 34.5 hỗn hợp T gồm 4 oxit mgo zno cu2o cuo để hòa tan hết hỗn hợp T cần dùng 400 ml dung dịch hcl 1M tính m
Theo dõi (0) 1 Trả lời -


Tính nồng độ mol của dung dịch Ca(OH)2
bởi thu hằng
 10/04/2019
10/04/2019
Cho 22,4 lít khí CO2 (đktc) tác dụng vừa đủ với 200 ml dung dịch Ca(OH)2 thu được muối trung hòa và nước.
a) Viết PTHH xảy ra.
b) Tính nồng độ mol của dung dịch Ca(OH)2.
c) Tính khối lượng muối thu được.
Theo dõi (0) 1 Trả lời -


Tính khối lượng muối thu được sau phản ứng
bởi Mai Trang
 10/04/2019
10/04/2019
4) Để hòa tan vừa hết 2,81 g hỗn hợp gồm Fe2O3 , MgO , ZnO cần 500 ml dd H2SO4 0,1 M . Tính khối lượng muối thu được sau phản ứng .
Theo dõi (0) 1 Trả lời -


Xác định công thức phân tử của oxit sắt
bởi Cam Ngan
 10/04/2019
10/04/2019
Khử hoàn toàn 4,8g hỗn hợp CuO và FexOy bằng khí H2 dư đun nóng. Sau phản ứng thu được 3,52g chất rắn.Hòa tan chất rắn vừa thu được vào dung dịch HCl dư, phản ứng kết thúc thu được 0,896l khí H2(đktc)
a) Xác định công thức phân tử của oxit sắt
b)Tính khối lượng của mỗi oxit kim loại có trong 4,8g hỗn hợp ban đầu.
Theo dõi (0) 1 Trả lời
Bài tập SGK khác
Bài tập 2 trang 9 SGK Hóa học 9
Bài tập 3 trang 9 SGK Hóa học 9
Bài tập 2.1 trang 4 SBT Hóa học 9
Bài tập 2.2 trang 4 SBT Hóa học 9
Bài tập 2.3 trang 4 SBT Hóa học 9
Bài tập 2.4 trang 4 SBT Hóa học 9
Bài tập 2.5 trang 4 SBT Hóa học 9
Bài tập 2.6 trang 4 SBT Hóa học 9
Bài tập 2.7 trang 4 SBT Hóa học 9
Bài tập 2.8 trang 5 SBT Hóa học 9
Bài tập 2.9 trang 5 SBT Hóa học 9





