Từ xa xưa con người đã biết sử dụng nhiều vật dụng bằng sắt hoặc hợp kim sắt. Ngày nay trong số tất cả trong kim loại, sắt vẫn được sử dụng nhiều nhất. Hãy tìm hiểu các tính chất vật lí, hóa học của sắt.
Tóm tắt lý thuyết
1.1. Tính chất vật lí
Màu trắng xám, có ánh kim, dẫn nhiệt tốt, dẻo, có tính nhiễm từ , là kim loại nặng, D= 7,86g/cm3, t0nc= 15390C

Hình 1: Đinh sắt
1.2. Tính chất hoá học
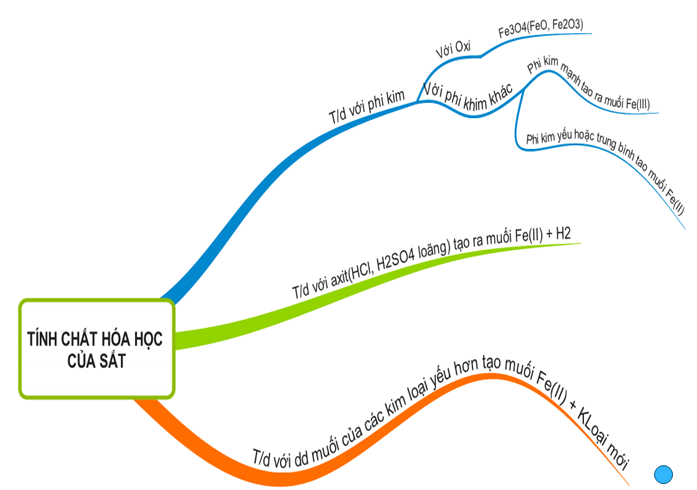
1.2.1. Tác dụng với phi kim
Tác dụng với oxi
Video 1: Phản ứng giữa Sắt và Oxi
3Fe + 2O2 → Fe3O4
Tác dung với clo
Video 2: Phản ứng của Fe và Clo
2Fe + 3Cl2 → 2FeCl3
trắng xám vàng lục nâu đỏ
Kết luận: Sắt tác dụng nhiều với phi kim tạo thành oxít hoặc muối
1.2.2. Tác dụng với dd axít
Video 3: Phản ứng giữa Fe và dung dịch HCl
Fe + 2HCl → FeCl2 + H2
Sắt tác dụng với dd HCl, H2SO4 loãng .., tạo thành muối sắt(II) và giải phóng khí H2. Sắt tác dụng với dd H2SO4 đặc nóng, với dd HNO3 không giải phóng khí H2
1.2.3. Tác dụng với dd muối
Video 4: Phản ứng giữa Fe và dung dịch CuSO4
Sắt tác dụng với dd muối của kim loại kém hoạt động hơn tạo thành dd muối sắt và giải phóng kim loại trong muối
Fe + CuSO4 → FeSO4 + Cu
Kết luận: Sắt có những tính chất hoá học của kim loại
1.3. Tổng kết
Hình 2: Sơ đồ tư duy bài Sắt
Bài tập minh họa
Bài 1:
Hòa tan 8,4 gam Fe bằng dung dịch HCl dư, thu được V lít khí H2 (đktc). Giá trị của V là:
Hướng dẫn:
Phương trình phản ứng
Fe + 2HCl → FeCl2 + H2
⇒ nFe = \(n_{H_{2}}\) = 0,15 mol
⇒ V = 3,36 lit
Bài 2:
Để khử hoàn toàn 8 gam bột Fe2O3 bằng bột nhôm ở nhiệt độ cao, trong điều kiện không có không khí thì khối lượng bột nhôm cần dùng là:
Hướng dẫn:
Phương trình hóa học:
Fe2O3 + 2Al → Al2O3 + 2Fe
⇒ nAl = \(2n_{Fe_{2}O_{3}}\) = 0,1 mol
⇒ mAl = 2,7g
3. Luyện tập Bài 19 Hóa học 9
Sau bài học cần nắm:
- Dự đoán tính chất hoá học của sắt, từ tính chất của kim loại nói chung và các kiến thức đã biết.
- Tính thành phần phần trăm về khối lượng của hỗn hợp bột nhôm và sắt.
- Tính khối lượng sắt tham gia phản ứng hoặc sản xuất được theo hiệu suất phản ứng.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 19 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Sắt không phản ứng với:
- A. Dung dịch HCl
- B. Dung dịch H2SO4
- C. H2SO4 đặc nóng
- D. H2SO4 đặc nguội
-
- A. H2SO4 đặc nóng, dư
- B. ZnSO4
- C. CuSO4
- D. HNO3 loãng, dư
-
- A. CuSO4
- B. KNO3
- C. CaCl2
- D. Na2CO3
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 19.
Bài tập 1 trang 60 SGK Hóa học 9
Bài tập 2 trang 60 SGK Hóa học 9
Bài tập 3 trang 60 SGK Hóa học 9
Bài tập 4 trang 60 SGK Hóa học 9
Bài tập 5 trang 60 SGK Hóa học 9
Bài tập 19.3 trang 24 SBT Hóa học 9
Bài tập 19.1 trang 23 SBT Hóa học 9
Bài tập 19.2 trang 23 SBT Hóa học 9
Bài tập 19.4 trang 24 SBT Hóa học 9
Bài tập 19.5 trang 24 SBT Hóa học 9
Bài tập 19.6 trang 24 SBT Hóa học 9
Bài tập 19.7 trang 24 SBT Hóa học 9
Bài tập 19.8 trang 24 SBT Hóa học 9
Bài tập 19.9 trang 24 SBT Hóa học 9
Bài tập 19.10 trang 24 SBT Hóa học 9
Bài tập 19.11 trang 24 SBT Hóa học 9
Bài tập 19.12 trang 25 SBT Hóa học 9
Bài tập 19.13 trang 25 SBT Hóa học 9
Bài tập 19.14 trang 25 SBT Hóa học 9
4. Hỏi đáp về Bài 19 chương 2 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.