Giải bài 8 tr 139 sách GK Hóa lớp 10
Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb(NO3)2 (dư), thu được 23,9g kết tủa màu đen.
a) Viết các phương trình hóa học của phản ứng đã xảy ra.
b) Hỗn hợp khí thu được gồm những khí nào? Thể tích mỗi khí là bao nhiêu (đktc)?
c) Tính khối lượng của Fe và FeS có trong hỗn hợp ban đầu?
Hướng dẫn giải chi tiết bài 8
Nhận định & Phương pháp
- Kết tủa màu đen là màu sắc đặc trưng của PbS. Có số mol kết tủa suy được số mol khí H2S và cả số mol FeS nữa.
- Có tổng số mol khí H2S và H2 ta trừ đi số mol khí H2S sẽ có số mol H2. Thông qua đó tìm được khối lượng Fe đã phản ứng.
Hướng dẫn:
\(\\ n_{hh \ khi'} = \frac{2,464}{22,4} = 0,11 \ mol \\ \\ n_{PbS} = \frac{23,9}{239} = 0,1 \ mol\)
Câu a:
Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2
FeS + 2HCl → FeCl2 + H2S
H2S + Pb(NO3)2 → PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
Câu b:
Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
Câu c:
mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.
-- Mod Hóa Học 10 HỌC247
Video hướng dẫn giải bài 8 SGK
-


Từ phản ứng \(SO_2 + 2H_2S → 3S + 2H_2O\). Câu nào diễn tả đúng tính chất của các chất ?
bởi Long lanh
 26/02/2021
26/02/2021
A. SO2 bị oxi hóa và H2S bị khử.
B. SO2 bị khử và H2S bị oxi hóa.
C. SO2 khử H2S và không có chất nào bị oxi hóa
D. SO2 bị khử, lưu huỳnh bị oxi hóa.
Theo dõi (0) 1 Trả lời -


Cho các phản ứng sau: \(2SO_2 + O_2 → 2SO_3\) (I)
bởi Nguyen Ngoc
 25/02/2021
25/02/2021
SO2 + 2H2S → 3S + 2H2O (II)
SO2 + Br2 + 2H2O → H2SO4 + 2HBr (III)
SO2 + NaOH → NaHSO3 (IV)
Các phản ứng mà SO2 có tính khử là:
Theo dõi (0) 1 Trả lời -


Dẫn khí \(SO_2\) vào lượng dư dung dịch \(Ca(OH)_2\), muối gì được tạo thành?
bởi Lê Trung Phuong
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Tại sao \(SO_2\) vừa có tính oxi hoá, vừa có tính khử?
bởi thanh duy
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Tính oxi hóa của \(SO_2\) thể hiện ở?
bởi Dương Quá
 26/02/2021
26/02/2021
A. SO2 + H2O → H2SO3
B. SO2 + Cl2 + H2O → H2SO4 + 2HCl
C. SO2 + 2H2S → 3S + 2H2O
D. SO2 + KOH → KHSO3
Theo dõi (0) 1 Trả lời -


Trong phòng thí nghiệm, khi tiến hành thí nghiệm cho mảnh đồng vào ống nghiệm của \(H_2SO_4\) đặc, đun nóng thấy sinh ra chất khí \(SO_2\) có mùi hắc, độc. Biện pháp nào sau đây xử lí thoát ra chống ô nhiễm môi trường?
bởi Trung Phung
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Trong bình cầu xảy ra phản ứng nào?
bởi Bình Nguyen
 25/02/2021
25/02/2021
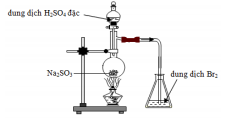 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Nêu hiệu tượng khi \(SO_2\) tác dụng với \(H_2S\)?
bởi Goc pho
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Ở PTN, điều chế một lượng lớn \(SO_2\) (để thực hành thí nghiệm) ta dùng phản ứng có phương trình hóa học là?
bởi Nguyễn Anh Hưng
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Thể tích dung dịch NaOH 2M tối thiểu để hấp thụ hết 5,6 lit khí \(SO_2\) (đkc) là:
bởi Trần Thị Trang
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Tính m kết tủa thu được khi đốt cháy hoàn toàn 4,8 gam lưu huỳnh rồi cho sản phẩm cháy hấp thụ hoàn toàn vào 200 ml dung dịch \(Ba(OH)_2\) 0,5M.
bởi Quynh Nhu
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Hấp thụ hoàn toàn 2,688 lít khí \(SO_2\) (đktc) + 2,5 lít \(Ba(OH)_2\) nồng độ a M. Thu được 17,36 gam kết tủa. Giá trị của a?
bởi thu hằng
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


V lít SO2 (đktc) + 500ml dung dịch \(Ca(OH)_2\) 0,5M tạo thành 12 gam kết tủa. Tìm Vmax ?
bởi Mai Bảo Khánh
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời
Bài tập SGK khác
Bài tập 6 trang 139 SGK Hóa học 10
Bài tập 7 trang 139 SGK Hóa học 10
Bài tập 9 trang 139 SGK Hóa học 10
Bài tập 10 trang 139 SGK Hóa học 10
Bài tập 32.1 trang 68 SBT Hóa học 10
Bài tập 32.2 trang 68 SBT Hóa học 10
Bài tập 32.3 trang 68 SBT Hóa học 10
Bài tập 32.4 trang 68 SBT Hóa học 10
Bài tập 32.5 trang 69 SBT Hóa học 10
Bài tập 32.6 trang 69 SBT Hóa học 10
Bài tập 32.7 trang 69 SBT Hóa học 10
Bài tập 32.8 trang 70 SBT Hóa học 10
Bài tập 32.9 trang 71 SBT Hóa học 10
Bài tập 32.10 trang 71 SBT Hóa học 10
Bài tập 32.11 trang 71 SBT Hóa học 10
Bài tập 32.12 trang 71 SBT Hóa học 10
Bài tập 32.13 trang 71 SBT Hóa học 10
Bài tập 32.14 trang 72 SBT Hóa học 10
Bài tập 32.15 trang 72 SBT Hóa học 10
Bài tập 32.16 trang 72 SBT Hóa học 10
Bài tập 32.17 trang 72 SBT Hóa học 10
Bài tập 32.18 trang 72 SBT Hóa học 10
Bài tập 32.19 trang 72 SBT Hóa học 10
Bài tập 2 trang 176 SGK Hóa học 10 nâng cao
Bài tập 3 trang 177 SGK Hóa học 10 nâng cao
Bài tập 4 trang 177 SGK Hóa học 10 nâng cao
Bài tập 5 trang 177 SGK Hóa học 10 nâng cao
Bài tập 1 trang 186 SGK Hóa học 10 nâng cao
Bài tập 2 trang 186 SGK Hóa học 10 nâng cao





