Bài tập 32.7 trang 69 SBT Hóa học 10
Trong phòng thí nghiêm, bạn em khảo sát thí nghiệm dùng dung dịch HCl dư tác dụng với một khối lượng nhỏ FeS. Cứ sau một khoảng cách thời gian là 20 giây, bạn em lại ghi thể tích khí thoát ra. Kết quả ghi được như sau (xem bảng):
| Thời gian (giây) | Thể tích H2S (cm3) | Thời gian (giây) | Thể tích H2S (cm3) |
|
0 20 40 60 80 |
0 27 49 68 83 |
100 120 140 160 180 |
93 99 100 100 100 |
a) Viết PTHH của phản ứng.
b) Vẽ đồ thị biểu diễn thể tích khí H2S thu được (trên trục tung) theo thời gian (trên trục hoành).
c) Hãy dùng đồ thị để tìm :
- Thể tích khí H2S thu được ở thời điểm 50 giây.
- Khoảng cách thời gian nào thì phản ứng xảy ra nhanh nhất ? chậm nhất ?
- Thời gian là bao nhiêu giây kể từ khi phản ứng xảy ra cho đến khi phản ứng kết thúc ?
d) Em hãy phác hoạ trên đồ thị này một đồ thị biểu diễn thể tích khí H2S thu được, nếu bạn em thay bằng dung dịch HCl khác có cùng thể tích nhưng có nồng độ cao hơn.
Hướng dẫn giải chi tiết bài 32.7
a) PTHH: FeS + 2HCl → FeCl2 + H2
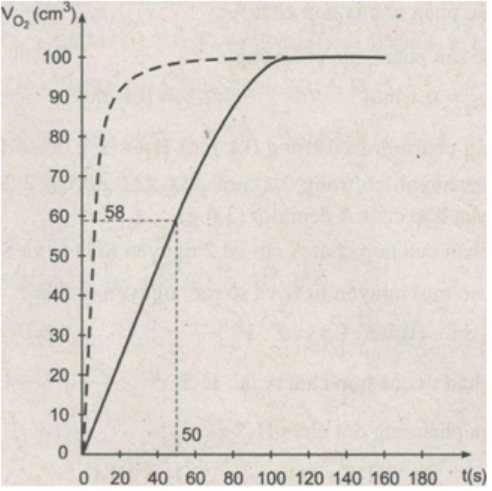
b) Đồ thị biểu diễn khí H2S sinh ra:
c) Căn cứ vào đồ thị, ta biết:
- Thể tích khí H2S thu được ở thời điểm 50 giây khoảng 58 cm3
- Trong, khoảng 20 giây đầu, phản ứng xảy ra nhanh nhất (đường cong có độ dốc lớn nhất). Khoảng thời gian 20 giây từ giây thứ 120 đến 140, phản ứng xảy ra chậm chất (đường cong có độ dốc nhỏ nhất).
- Phản ứng kết thúc ở giây thứ 140.
d) Nếu thay dung dịch HCl có nồng độ cao hơn thì đường cong sẽ có độ dốc lớn hơn, phản ứng sẽ kết thúc nhanh hơn, nhưng thể tích khí H2S hu được là không đổi. Trên đồ thị, đường cong này được biểu diễn bằng đường đứt nét.
-- Mod Hóa Học 10 HỌC247
-


Hấp thụ 7,84 lít (đktc) khí \(H_2S\) vào 64 gam dung dịch \(CuSO_4\) 10%, sau phản ứng hoàn toàn thu được m gam kết tủa đen. Giá trị của m là:
bởi thanh hằng
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Có các lọ đựng hoá chất riêng rẽ: \(PbCl_2, NaCl, NaOH, CdCl_2, KCl\). Chỉ dùng dung dịch \(H_2S\) , có thể nhận biết tối đa được mấy chất ?
bởi bala bala
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


Để tách khí SO2 có lẫn trong hỗn hợp khí CO2 và SO2 có thể cho hỗn hợp khí đi qua dung dịch:
bởi Lê Nhật Minh
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Hiện tượng gì xảy ra khi để dung dịch \(H_2S\) để lâu trong không khí?
bởi Nguyễn Thủy Tiên
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


Đồ dùng bằng bạc để lâu ngày trong không khí bị sạm đen do phản ứng: \(4Ag + 2H_2S + O_2 → 2Ag_2S + 2H_2O\) Trong phản ứng trên chất đóng vai trò là chất khử?
bởi Anh Linh
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


Dẫn khí \(H_2S\) vào dung dịch muối \(Pb(NO_3)_2\), hiện tượng quan sát được là gì?
bởi Thiên Mai
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


A. FeS + HNO3 loãng.
B. FeS + HNO3 đặc.
C. FeS + HCl.
D. FeS + H2SO4 đặc.
Theo dõi (0) 1 Trả lời -


Tìm công thức của hiđro sunfua?
bởi Sam sung
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Đốt cháy hoàn toàn 8,96 lít \(H_2S\) (đktc) trong oxi dư, rồi dẫn tất cả sản phẩm vào 50 ml dung dịch NaOH 25% (D= 1,28). Nồng độ % muối trong dung dịch là
bởi Hoai Hoai
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


Cho sản phẩm khí thu được khi đốt cháy 17,92 lít khí \(H_2S\) (đktc) sục vào 200 ml dung dịch NaOH 25% (d = 1,28g/ml). Tính nồng độ phần trăm muối trong dung dịch ?
bởi Quynh Anh
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


Tính m muối tan thu được khi sục 2,24 lít khí \(H_2S\) (đktc) vào dung dịch 0,2 mol \(Ba(OH)_2\)?
bởi Hoa Hong
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


Đốt cháy hoàn toàn 8,96 lít \(H_2S\) (đktc) trong oxi dư, rồi dẫn tất cả sản phẩm vào 50 ml dung dịch NaOH 25% (D= 1,28). Nồng độ % muối trong dung dịch là
bởi Hữu Nghĩa
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời
Bài tập SGK khác
Bài tập 32.5 trang 69 SBT Hóa học 10
Bài tập 32.6 trang 69 SBT Hóa học 10
Bài tập 32.8 trang 70 SBT Hóa học 10
Bài tập 32.9 trang 71 SBT Hóa học 10
Bài tập 32.10 trang 71 SBT Hóa học 10
Bài tập 32.11 trang 71 SBT Hóa học 10
Bài tập 32.12 trang 71 SBT Hóa học 10
Bài tập 32.13 trang 71 SBT Hóa học 10
Bài tập 32.14 trang 72 SBT Hóa học 10
Bài tập 32.15 trang 72 SBT Hóa học 10
Bài tập 32.16 trang 72 SBT Hóa học 10
Bài tập 32.17 trang 72 SBT Hóa học 10
Bài tập 32.18 trang 72 SBT Hóa học 10
Bài tập 32.19 trang 72 SBT Hóa học 10
Bài tập 2 trang 176 SGK Hóa học 10 nâng cao
Bài tập 3 trang 177 SGK Hóa học 10 nâng cao
Bài tập 4 trang 177 SGK Hóa học 10 nâng cao
Bài tập 5 trang 177 SGK Hóa học 10 nâng cao
Bài tập 1 trang 186 SGK Hóa học 10 nâng cao
Bài tập 2 trang 186 SGK Hóa học 10 nâng cao