Gluxit (hay Cacbohidrat) là tên gọi chung của một nhóm các hợp chất hữu cơ thiên nhiên có công thức chung Cn(H2O)m. Trong Gluxit thì chất quan trọng và tiêu biểu nhất là Glucozơ. Vậy Glucozơ có những tính chất và ứng dụng gì? Chúng ta cùng nhau tìm hiểu qua bài giảng về Glucozơ.
Tóm tắt lý thuyết
Glucozơ
- Công thức phân tử: C6H12O6
- Phân tử khối: 180
1.1. Trạng thái tự nhiên
Hình 1: Glucozơ có chứa nhiều trong hoa, quả chín
1.2. Tính chất vật lí
Glucozơ là chất kết tinh, không màu, vị ngot, dễ tan trong nước.
1.3. Tính chất hóa học
a) Phản ứng oxi hóa Glucozơ
- Cách tiến hành, các em quan sát thí nghiệm sau:
Video 1: Phản ứng tráng bạc của Glucozơ
- Hiện tượng: Có chất màu sáng bạc bám lên thành ống nghiệm
- Giải thích: Do Ag sinh ra từ phản ứng bám lên thành ống nghiệm:
C6H12O6 + Ag2O \(\overset{NH_{3}}{\rightarrow}\) C6H12O7 (Axit gluconic) + 2Ag\(\downarrow\)
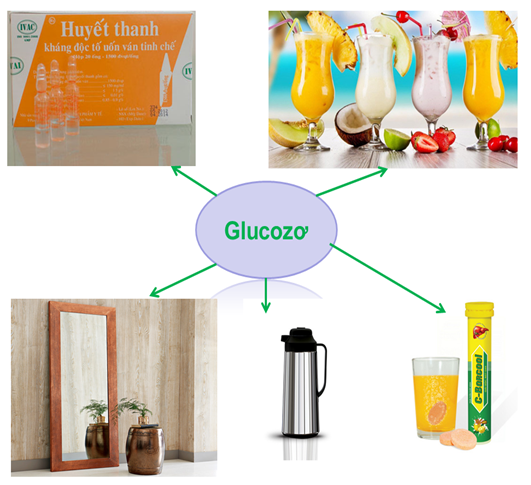
⇒ Ứng dụng của phản ứng này là dùng để tráng gương, tráng ruột phích nhưng như vậy sẽ lãng phí nguồn năng lượng từ glucozơ trong khi Xenlulozơ có nhiều trong tre, nứa không ăn được cũng có phản ứng này. Do đó, ngày nay người ta thường sử dụng Xenlulozơ để tráng gương. (Bài học về Xenlulozơ các em sẽ được tìm hiểu ở bài sau)
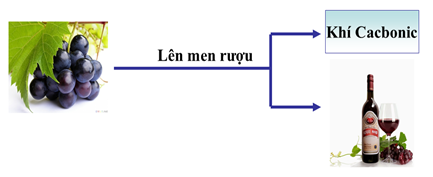
b) Phản ứng lên men rượu
Hình 2: Phản ứng lên men rượu
- Khi cho men rượu vào dung dịch glucozơ (t0: 30 – 320C), glucozơ chuyển dần thành rượu etylic, giải phóng CO2.
- Phương trình phản ứng:
C6H12O6 (dd) \(\xrightarrow[30-35^{0}]{len \,\,men}\) 2C2H5OH(dd) + 2CO2(k)
Hình 3: Quy trình lên men sản xuất rượu nếp
1.4. Ứng dụng của Glucozơ
Hình 4: Ứng dụng của Glucozơ
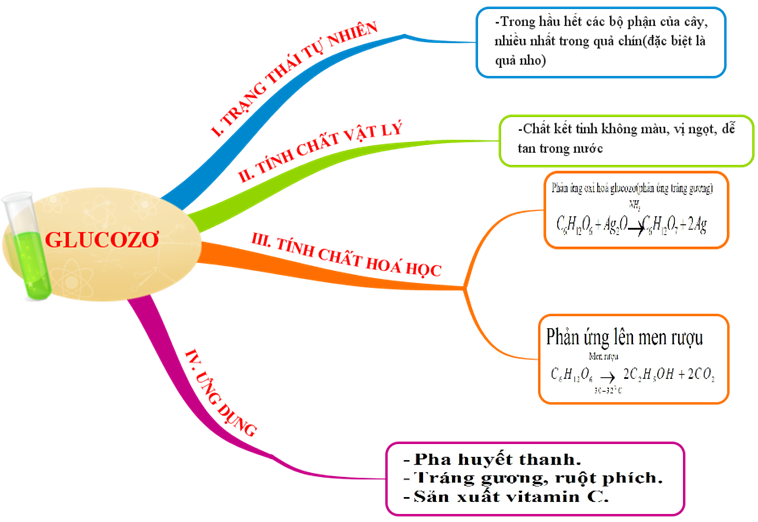
1.5. Tổng kết
Hình 5: Sơ đồ tư duy bài Glucozơ
Bài tập minh họa
Bài 1:
Nhận biết 3 dung dịch không màu sau: Glucozơ, rượu etylic và Axit axetic.
Hướng dẫn:
Thuốc thử: Qùy tím và dung dịch AgNO3 trong amoniac.
Bước 1: Cho vài giọt dung dịch của 3 dung dịch vào quỳ tím. Dung dịch nào làm quỳ chuyển màu hồng là axit axetic. Còn lại Rượu etylic và Glucozơ.
Bước 2: Cho 2 dung dịch còn lại vào dung dịch AgNO3 trong amoniac. Dung dịch nào thấy xuất hiện kết tủa trắng sáng là Glucozơ. Dung dịch không hiện tượng là Rượu etylic.
Phương trình hóa học: C6H12O6 + Ag2O \(\overset{NH_{3}}{\rightarrow}\) C6H12O7 (Axit gluconic) + 2Ag\(\downarrow\)
Bài 2:
Tráng bạc hoàn toàn m gam glucozơ thu được 86,4 gam Ag. Nếu lên men hoàn toàn m gam glucozơ rồi cho khí CO2 thu được hấp thụ vào nước vôi trong dư thì lượng kết tủa thu được là
Hướng dẫn:
Cách 1:
Số mol Bạc tạo thành là: \({n_{Ag}} = \frac{{{m_{Ag}}}}{{{M_{Ag}}}} = \frac{{86,4}}{{108}} = 0,8(mol)\)
Phương trình hóa học:
C6H12O6 + Ag2O \(\overset{NH_{3}}{\rightarrow}\) C6H12O7 (Axit gluconic) + 2Ag\(\downarrow\)
0,4(mol) \(\leftarrow\) 0,8(mol)
Đem lên men 0,4 mol glucozơ
C6H12O6 (dd) \(\xrightarrow[30-35^{0}]{len \,\,men}\) 2C2H5OH(dd) + 2CO2(k)
0,4(mol) → 0,8 (mol)
CO2 + Ca(OH)2 → CaCO3 + H2O
0,8(mol) → 0,8(mol)
Số gam kết tủa CaCO3 thu được là: \({m_{CaC{O_3}}} = {n_{_{CaC{O_3}}}}.{M_{_{CaC{O_3}}}} = 0,8.100 = 80(gam)\)
Cách 2:
Số mol Bạc tạo thành là: \({n_{Ag}} = \frac{{{m_{Ag}}}}{{{M_{Ag}}}} = \frac{{86,4}}{{108}} = 0,8(mol)\)
Phương trình hóa học:
C6H12O6 + Ag2O \(\overset{NH_{3}}{\rightarrow}\) C6H12O7 (Axit gluconic) + 2Ag\(\downarrow\)
0,4(mol) \(\leftarrow\) 0,8(mol)
Sơ đồ phản ứng như sau cân bằng theo nguyên tố Cacbon ta có:
C6H12O6 → 2C2H5OH + 2CO2 → 2CaCO3
0,4(mol) → 0,8 (mol)
Số gam kết tủa CaCO3 thu được là: \({m_{CaC{O_3}}} = {n_{_{CaC{O_3}}}}.{M_{_{CaC{O_3}}}} = 0,8.100 = 80(gam)\)
Bài 3:
Người ta cho 3,5 kg glucozơ chứa 15% tạp chất lên men thành rượu etylic.
- Viết phương trình hóa học.
- Tính khối lượng rượu tạo thành biết hiệu suất là 80%
- Nếu pha rượu đó thành rượu 40o thì thể tích rượu 40o thu được là bao nhiêu ( biết rượu có khối lượng riêng là 0,8 g/ml)
Hướng dẫn:
a) C6H12O6 (dd) \(\xrightarrow[30-35^{0}]{len \,\,men}\) 2C2H5OH(dd) + 2CO2(k)
b) Vì 3,5 kg glucozơ chứa 15% nên lượng nguyên chất là 100-15 = 85% ta có số mol glucozơ là:
\({n_{{C_6}{H_{12}}{O_6}}} = \frac{{3,5}}{{180}}.\frac{{85}}{{100}}(kmol)\)
Khối lượng rượu tạo thành biết hiệu suất là 80% là:
\({n_{{C_2}{H_5}OH}} = 2.{n_{{C_6}{H_{12}}{O_6}}}.\frac{{80}}{{100}} = 2.\frac{{3,5}}{{180}}.\frac{{85}}{{100}}.\frac{{80}}{{100}} = 0,026(kmol)\)
c) Khối lượng Rượu tạo thành:
\({m_{{C_2}{H_5}OH}} = 0,026.46 = 1,196(kg) = 1196(gam)\)
Thể tích rượu nguyên chất là:
\(m = D.V \Rightarrow V = \frac{m}{D} = \frac{{1196}}{{0,8}} = 1495(ml)\)
Thể tích dung dịch rượu sau khi pha thành rượu 400 là:
Độ rượu = \(\frac{{{V_{ruou{\rm{ nguyen chat}}}}}}{{{V_{dd}}}}.100\) ⇒ Vdd = (Vrượu nguyên chất/Độ rượu).100 = \(\frac{{1495}}{{40}}.100 = 3737,5(ml) = 3,7375(lit)\)
3. Luyện tập Bài 50 Hóa học 9
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 50 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. etilen.
- B. glucozơ
- C. chất béo.
- D. axit axetic.
-
- A. giấy quỳ tím và dung dịch AgNO3/NH3.
- B. giấy quỳ tím và Na.
- C. Na và dung dịch AgNO3/NH3.
- D. Na và dung dịch HCl.
-
- A. C2H5OH , CH3COOH , CaO , CO2.
- B. CaO , CO2 , C2H5OH , CH3COOH.
- C. C2H5OH , CO2 , CH3COOH , CaCO3.
- D. CH3COOH , C2H5OH , CaCO3 , CO2.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 50.
Bài tập 1 trang 152 SGK Hóa học 9
Bài tập 2 trang 152 SGK Hóa học 9
Bài tập 3 trang 152 SGK Hóa học 9
Bài tập 4 trang 152 SGK Hóa học 9
Bài tập 50.1 trang 58 SBT Hóa học 9
Bài tập 50.2 trang 58 SBT Hóa học 9
Bài tập 50.3 trang 59 SBT Hóa học 9
Bài tập 50.4 trang 59 SBT Hóa học 9
Bài tập 50.5 trang 59 SBT Hóa học 9
Bài tập 50.6 trang 59 SBT Hóa học 9
4. Hỏi đáp về Bài 50 chương 5 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.