Nội dung bài Luyện tập Hợp chất hữu cơ, công thức phân tử và công thức cấu tạo ôn tập, hệ thống lại về Hợp chất hữu cơ: Khái niệm, phân loại, đồng đẳng, đồng phân, liên kết trong phân tử. Phản ứng của hợp chất hữu cơ. Rèn luyện kĩ năng giải bài tập xác định CTPT, viết CTCT của một số chất hữu cơ đơn giản, nhận dạng một vài loại phản ứng của các chất hữu cơ đơn giản.
Tóm tắt lý thuyết
1. Hợp chất hữu cơ là hợp chẩt của cacbon (trừ CO, CO2, muối cacbonat, xianua, cacbua, ...)
2. Hợp chất hữu cơ được chia thành hidrocacbon và dẫn xuất hidrocacbon.
3. Liên kết hóa học trong phân tử hợp chất hữu cơ thường là liên kết cộng hóa trị.
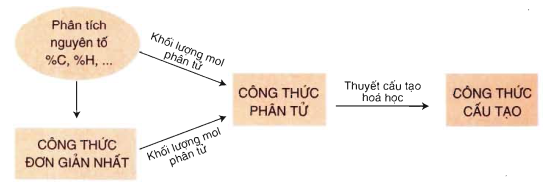
4. Các loại công thức biểu diễn công thức hợp chất hữu cơ.
5. Các loại phản ứng hay gặp trong hóa học hữu cơ là phản ứng thế, phản ứng cộng, phản ứng tách.
6. Đồng đẳng, đồng phân
| Công thức phân tử | Công thức cấu tạo | Tính chất | |
| Chất đồng đẳng | Khác nhau một hay nhiều nhóm -CH2 | Tương tự nhau | Tương tự nhau |
| Chất đồng phân | Giống nhau | Khác nhau | Khác nhau |
Bài tập minh họa
Bài 1:
Một hợp chất hữu cơ Y khi đốt cháy thu được CO2 và H2O có số mol bằng nhau; đồng thời lượng oxi cần dùng bằng 4 lần số mol của Y. Tìm CTPT của Y biết trong Y chỉ có 1 nguyên tử oxi.
Hướng dẫn:
\(\begin{array}{l} {n_{C{O_2}}} = {n_{{H_2}O}} \Rightarrow CTPT:{C_x}{H_{2x}}O\\ {C_x}{H_{2x}}O + \left( {\frac{{3x - 1}}{2}} \right){O_2} \to xC{O_2} + x{H_2}O\\ {n_{{O_2}}} = 4{n_Y} \Rightarrow \frac{{3x - 1}}{2} = 4 \Rightarrow x = 3\\ CTPT:{C_3}{H_6}O \end{array}\)
Bài 2:
Đốt cháy hoàn toàn một hợp chất hữu cơ chứa C, H, Cl sinh ra 0,22g CO2 và 0,09g H2O. Khi xác định clo trong lượng chất đó bằng dd AgNO3, người ta thu được 1,435 g AgCl. Xác định CTPT của hợp chất hữu cơ nói trên biết tỉ khối hơi của nó so với hydro bằng 42,5
Hướng dẫn:
\(\begin{array}{l} {n_{C{O_2}}} = 0,005{\rm{ }}mol;{n_{{H_2}O}} = 0,005{\rm{ }}mol;{n_{Cl}} = {n_{AgCl}} = 0,01{\rm{ }}mol\\ \Rightarrow {n_C} = 0,005{\rm{ }}mol;{n_H} = 2.0,005 = 0,01{\rm{ }}mol\\ C:H:Cl = {n_C}:{n_H}:{n_{Cl}} = 0,005:0,01:0,01 = 1:2:2\\ CTPT:{(C{H_2}C{l_2})_n}\\ {d_{HC/{H_2}}} = 42,5 \Rightarrow {M_A} = 42,5.2 = 85\\ \Rightarrow 85n = 85 \Leftrightarrow n = 1 \Rightarrow CTPT:{\rm{ C}}{{\rm{H}}_2}C{l_2} \end{array}\)
Bài 3:
Đốt cháy hoàn toàn 18g chất hữu cơ A cần vừa đủ 16,8 lít O2 thu được CO2 và hơi nước có tỷ lệ thể tích = 3: 2. Xác định CTPT của A, biết số nguyên tử oxi trong A không vượt quá 2?
Hướng dẫn:
\(\begin{array}{l} {n_{{O_2}}} = 0,75mol\\ \left\{ \begin{array}{l} C{O_2}(a{\rm{ }}mol)\\ {H_2}O{\rm{ }}(b{\rm{ }}mol) \end{array} \right.\\ \frac{a}{b} = \frac{3}{2} \Leftrightarrow 2a - 3b = 0{\rm{ }}(1)\\ {m_{C{O_2}}} + {m_{{H_2}O}} = {m_A} + {m_{{O_2}}}\\ \Leftrightarrow 44a + 18b = 18 + 0,75.32 = 42{\rm{ }}(2)\\ \left\{ \begin{array}{l} a = 0,75{\rm{ }}mol\\ b = 0,5{\rm{ }}mol \end{array} \right. \end{array}\)
\(\begin{array}{l} \Rightarrow {n_C} = {n_{C{O_2}}} = 0,75mol;{\rm{ }}{{\rm{n}}_H} = 2{n_{{H_2}O}} = 2.0,5 = 1{\rm{ }}mol\\ {n_{O(A)}} = ({n_{O(C{O_2})}} + {n_O}_{({H_2}O)}) - {n_{O({O_2})}}\\ \Rightarrow {n_{O(A)}} = (2.{n_{C{O_2}}} + {n_{{H_2}O}}) - 2{n_{{O_2}}}\\ \Leftrightarrow {n_{O(A)}} = 0,5{\rm{ }}mol\\ C{\rm{ }}:{\rm{ }}H{\rm{ }}:{\rm{ }}O{\rm{ }} = {\rm{ }}{n_C}:{\rm{ }}{n_H}:{\rm{ }}{n_O} = {\rm{ }}0,75{\rm{ }}:{\rm{ }}1{\rm{ }}:{\rm{ }}0,5{\rm{ }} = {\rm{ }}1,5{\rm{ }}:{\rm{ }}2{\rm{ }}:{\rm{ }}1 = {\rm{ }}3{\rm{ }}:{\rm{ }}4{\rm{ }}:{\rm{ }}2\\ \Rightarrow CTPT:{\rm{ }}{\left( {{C_3}{H_4}{O_2}} \right)_n} \end{array}\)
So số nguyên tử oxi không vượt quá 2 nên n = 1 ⇒ CTPT là: C3H4O2
3. Luyện tập Bài 24 Hóa học 11
Sau bài học cần nắm:
- Khái niệm, phân loại, đồng đẳng, đồng phân, liên kết trong phân tử, Phản ứng của hợp chất hữu cơ.
- Viết CTCT của một số chất hữu cơ đơn giản, nhận dạng một vài loại phản ứng của các chất hữu cơ đơn giản.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 24 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. C2H5O2
- B. C3H5O2
- C. C3H6O
- D. C2H4O
-
Câu 2:
Đốt cháy hoàn toàn hợp chất hữu cơ nào sau đây thì sản phẩm thu được khác với các chất còn lại?
- A. Protein.
- B. Cao su thiên nhiên.
- C. Chất béo.
- D. Tinh bột.
-
- A. Xác định H và Cl.
- B. Xác định C và N.
- C. Xác định C và H.
- D. Xác định C và S.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 24.
Bài tập 1 trang 107 SGK Hóa học 11
Bài tập 2 trang 107 SGK Hóa học 11
Bài tập 3 trang 107 SGK Hóa học 11
Bài tập 4 trang 107 SGK Hóa học 11
Bài tập 5 trang 107 SGK Hóa học 11
Bài tập 6 trang 107 SGK Hóa học 11
Bài tập 7 trang 107 SGK Hóa học 11
Bài tập 8 trang 107 SGK Hóa học 11
Bài tập 24.1 trang 34 SBT Hóa học 11
Bài tập 24.2 trang 35 SBT Hóa học 11
Bài tập 24.3 trang 35 SBT Hóa học 11
Bài tập 24.4 trang 35 SBT Hóa học 11
Bài tập 24.5 trang 35 SBT Hóa học 11
Bài tập 24.6 trang 36 SBT Hóa học 11
Bài tập 24.7 trang 36 SBT Hóa học 11
Bài tập 24.8 trang 36 SBT Hóa học 11
Bài tập 1 trang 121 SGK Hóa học 11 nâng cao
Bài tập 2 trang 121 SGK Hóa học 11 nâng cao
Bài tập 3 trang 121 SGK Hóa học 11 nâng cao
Bài tập 4 trang 121 SGK Hóa học 11 nâng cao
Bài tập 5 trang 121 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 24 Chương 4 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.