Nội dung bài giảng Clo tìm hiểu về Tính chất vật lí, trạng thái tự nhiên, ứng dụng của clo, phương pháp điều chế clo trong phòng thí nghiệm, trong công nghiệp. Kiến thức trọng tâm: Tính chất hoá học cơ bản của clo là phi kim mạnh, có tính oxi hoá mạnh (tác dụng với kim loại, hiđro), Clo còn thể hiện tính khử.
Tóm tắt lý thuyết
Sơ lược nguyên tố Clo
- Kí hiệu hóa học: Cl
- Số ô nguyên tố: 17
- Cấu hình e: 1s22s22p63s23p5
- Khối lượng nguyên tử : 35,5
- Công thức phân tử: Cl2
- Khối lượng phân tử: 71
1.1. Tính chất vật lí
Hình 1: Bình khí Clo
- Ở điều kiện thường, Clo là chất khí màu vàng lục, mùi xốc, rất độc.
- Khí Clo nặng gấp 2,5 lần không khí và tan ít trong nước tạo thành dung dịch nước Clo có màu vàng nhạt , Clo tan nhiều trong các dung môi hữu cơ: Benzen,…
1.2. Tính chất hóa học
Clo thể hiện tính oxi hóa mạnh chỉ kém hơn Flo và Oxi.
Cl + 1e → Cl-
Hay: Cl2 + 2.1e → 2 Cl-
1.2.1. Phản ứng với kim loại
Clo tác dụng với kim loại tạo muối Clorua
2M + nCl2 .PNG)
- Natri nóng chảy trong khí Clo nóng chảy trong khí clo với ngọn lửa sáng chói, tạo natri clorua:
2Na + Cl2 → 2NaCl
Video 1: Natri cháy sáng trong khí clo
- Dây đồng nung nóng đỏ cháy trong không khí clo tạo thành Đồng (II) clorua
Cu (đỏ) + Cl2 (vàng lục) .PNG)
Video 2: Đồng tác dụng với khí Clo
- Dây sắt nung nóng đỏ cháy trong khí clo tạo thành khói màu nâu là những hạt sắt (III) clorua
2Fe + 3Cl2 .PNG)
Video 3: Sắt tác dụng với khí clo
1.2.2. Tác dụng với khí Hidro
- Clo tác dụng với khí hidro tạo Khí Hiđro Clorua không màu dễ tan trong nước. \({H_2} + C{l_2} \to HCl\)
- Kết luận: Trong phản ứng với kim loại và với hiđro thì Clo thể hiện tính oxi hóa mạnh.
1.2.3. Tác dụng với nước
- Khi tan trong nước một phần Clo phản ứng với nước tạo hỗn hợp hai axit Clohiđric và axit Hypoclorơ.
Video 4: Clo tác dụng với nước
- Kết luận: Trong phản ứng với nước, Clo vừa đóng vai trò là chất khử, vừa đóng vai trò là chất oxi hóa.
1.3. Trạng thái tự nhiên
- Trong tự nhiên Clo có hai đồng vị bền là \({}^{35}Cl{\rm{ (75,77)}}\) và \({}^{37}Cl{\rm{ (24,23\% )}}\), nguyên tử khối trung bình là 35,5.
- Clo chủ yếu tồn tại dưới dạng hợp chất NaCl và các chất khoáng.
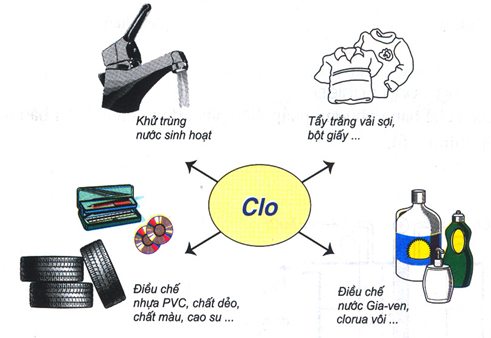
1.4. Ứng dụng
- Clo được dùng để tiệt trùng nước sinh họat, dùng để tẩy trắng vải, sợi giấy…
- Một lượng lớn Clo dùng để điều chế một số chất hữu cơ như : PVC, CCl4…
- Điều chế một số hóa chất quan trọng khác: nước Javen
Hình 2: Ứng dụng của Clo
1.5. Điều chế
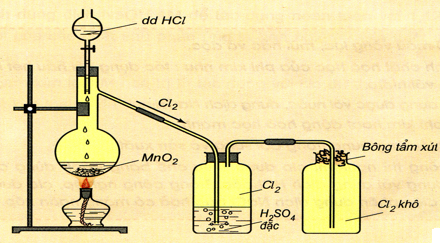
1.5.1. Trong phòng thí nghiệm
Dùng chất oxihóa mạnh như MnO2, KMnO4, KClO3,…tác dụng dung dịch HCl đặc hoặc muối Clorua
MnO2 + 4HCl → MnCl2 + Cl2 + H2O
\(2KMn{O_4} + 16HCl \to 2MnC{l_2} + 2KCl + 5C{l_2} + 8{H_2}O\)
Hình 3: Điều chế và thu khí Clo trong phòng thí nghiệm
1.5.2. Trong công nghiệp
Điện phân dung dịch NaCl có màng ngăn bằng xốp với điện cực dương bằng than chì và điện cực âm làm bằng sắt.
2NaCl +2H2O 
Hình 4: Sơ đồ điện phân NaCl để thu khí Clo
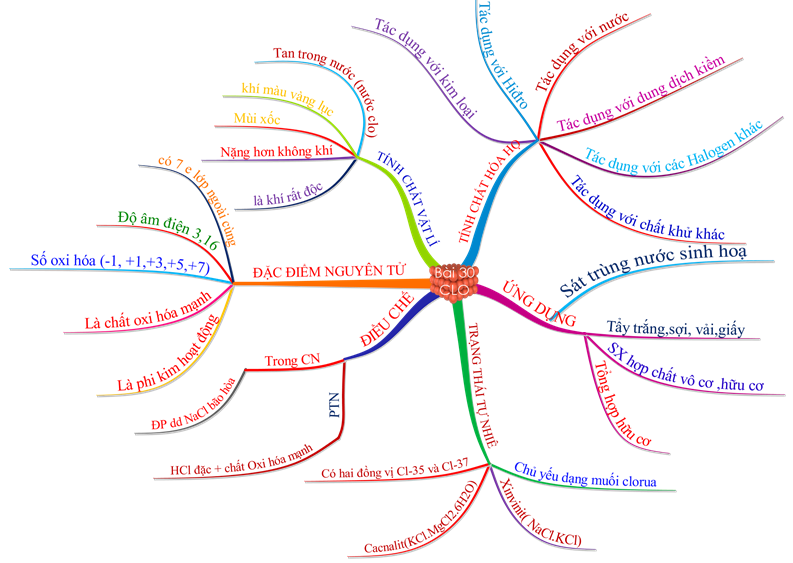
1.6. Tổng kết
Hình 5: Sơ đồ tư duy bài Clo
Bài tập minh họa
Bài 1:
Viết phương trình phản ứng của Cl2 với dung dịch Ca(OH)2?
Hướng dẫn:
- Giai đoạn 1: Cl2 tác dụng với nước tạo 2 axit HCl và HClO
- Giai đoạn 2: 2 axit HCl và HClO với kiềm tạo 2 muối tương ứng
2HCl + Ca(OH)2 → CaCl2 + 2H2O
2HClO + Ca(OH)2 → Ca(OCl)2 + 2H2O
→ Tổng quát: 2Cl2 + 2Ca(OH)2 → CaCl2 + Ca(OCl)2 + 2H2O
Có thể viết: Cl2 + Ca(OH)2 → CaOCl2 + H2O
Bài 2:
Hoàn thành các phương trình phản ứng dưới đây. Nêu rõ vai trò của clo trong các phản ứng đó.
a) FeCl2 + Cl2 .PNG)
b) SO2 + Cl2 + 2H2O →
c) 6KOH + 3Cl2 →
d) 2Ca(OH)2 + Cl2 →
Hướng dẫn:
a) 2FeCl2 + Cl2 .PNG)
Clo là chất oxy hóa:
b) SO2 + Cl2 + 2H2O →2HCl +H2SO4
Clo là chất oxy hóa
c) 6KOH + 3Cl2 →5KCl + KClO3 + 3H2O
Clo vừa là chất khử, vừa là chất oxy hóa
d) 2Ca(OH)2 + Cl2 →Ca(ClO)2+ CaCl2+ 2H2O
Clo vừa là chất khử, vừa là chất oxy hóa
Bài 3:
Đốt 3,36 gam kim loại M trong khí clo dư thì thu được 9,75 gam muối clorua. Kim loại M là:
Hướng dẫn:
mmuối = mMn2+ + mCl-
⇒ mCl- = 9,75 – 3,36 = 6,39g
⇒ nCl- = 0,18 mol ⇒ \(n_{Cl_{2}}\) = 0,09 mol
2M + nCl2 → 2MCln
\(\frac{0,18}{n}\) ← 0,09
MM = 3,36 : (\(\frac{0,18}{n}\)) = \(\frac{56n}{3}\)
⇒ M là Fe
Bài 4:
Đốt một kim loại trong bình chứa khí Clo thu được 26,70 gam muối, đồng thời thể tích khí Clo trong bình giảm 6,72 lít (đktc). Kim loại đem đốt là:
Hướng dẫn:
Giả sử kim loại m có hóa trị x trong hợp chất với clo: MClx
\(\\ \Rightarrow n_{MClx} = \frac{2}{x.n_{Cl_{2}}} = \frac{0,6}{x} \ (mol) \\ \Rightarrow M_{MClx }= 44,5x = M + 35,5 x \\ \Rightarrow M = 9x\)
⇒ Với x = 3 ⇒ M = 27g (Al) thỏa mãn
3. Luyện tập Bài 22 Hóa học 10
Sau bài học cần nắm:
- Tính chất vật lí, trạng thái tự nhiên, ứng dụng của clo, phương pháp điều chế clo trong phòng thí nghiệm, trong công nghiệp.
- Tính chất hoá học cơ bản của clo là phi kim mạnh, có tính oxi hoá mạnh (tác dụng với kim loại, hiđro), Clo còn thể hiện tính khử.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 22 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. quỳ tím.
- B. HCl.
- C. NaOH.
- D. NaCl.
-
Câu 2:
Cho hình vẽ mô tả sự điều chế Clo trong phòng Thí nghiệm như sau:
Phát biểu nào sau đây không đúng?- A. Dung dịch H2SO4 đặc có vai trò hút nước, có thể thay H2SO4 bằng CaO.
- B. Khí Clo thu được trong bình eclen là khí Clo khô.
- C. Có thể thay MnO2 bằng KMnO4 hoặc KClO3.
- D. Không thể thay dung dịch HCl đặc bằng dung dịch NaCl.
-
- A. FeCl3 và Fe.
- B. FeCl2 và Fe.
- C. FeCl2 và FeCl3.
- D. FeO và FeCl2.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 22.
Bài tập 1 trang 101 SGK Hóa học 10
Bài tập 2 trang 101 SGK Hóa học 10
Bài tập 3 trang 101 SGK Hóa học 10
Bài tập 4 trang 101 SGK Hóa học 10
Bài tập 5 trang 101 SGK Hóa học 10
Bài tập 6 trang 101 SGK Hóa học 10
Bài tập 7 trang 101 SGK Hóa học 10
Bài tập 22.1 trang 52 SBT Hóa học 10
Bài tập 22.2 trang 52 SBT Hóa học 10
Bài tập 22.3 trang 52 SBT Hóa học 10
Bài tập 22.4 trang 52 SBT Hóa học 10
Bài tập 22.5 trang 52 SBT Hóa học 10
Bài tập 22.6 trang 52 SBT Hóa học 10
Bài tập 22.7 trang 53 SBT Hóa học 10
Bài tập 22.8 trang 53 SBT Hóa học 10
Bài tập 22.9 trang 53 SBT Hóa học 10
Bài tập 22.10 trang 53 SBT Hóa học 10
Bài tập 22.11 trang 53 SBT Hóa học 10
Bài tập 22.12 trang 54 SBT Hóa học 10
Bài tập 22.13 trang 54 SBT Hóa học 10
Bài tập 22.14 trang 54 SBT Hóa học 10
Bài tập 22.15 trang 54 SBT Hóa học 10
Bài tập 1 trang 125 SGK Hóa học 10 nâng cao
Bài tập 2 trang 125 SGK Hóa học 10 nâng cao
Bài tập 3 trang 125 SGK Hóa học 10 nâng cao
Bài tập 4 trang 125 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 22 Chương 5 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.



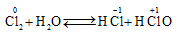

.PNG)











