Nß╗Öi dung b├Āi giß║Żng SŲĪ lŲ░ß╗Żc vß╗ü hß╗Żp chß║źt c├│ oxi cß╗¦a clo t├¼m hiß╗āu nŲ░ß╗øc Javen v├Ā Clorua v├┤i c├│ th├Ānh phß║¦n, t├Łnh chß║źt, cß║źu tß║Īo nhŲ░ thß║┐ n├Āo? Ch├║ng ─æŲ░ß╗Żc d├╣ng l├Ām g├¼ v├Ā ─æŲ░ß╗Żc ─æiß╗üu chß║┐ bß║▒ng c├Īch n├Āo?
T├│m tß║»t l├Į thuyß║┐t
1.1. Th├Ānh phß║¦n, t├Łnh chß║źt v├Ā ß╗®ng dß╗źng cß╗¦a nŲ░ß╗øc Javel v├Ā clorua v├┤i
| NŲ░ß╗øc Javel | Clorua v├┤i | |
| Th├Ānh phß║¦n |
Dung dß╗ŗch: NaCl v├Ā NaClO. NaClO Ōćö HClO natri hipoclorit axit hipoclorŲĪ |
- CTPT: CaOCl2 - CTCT:
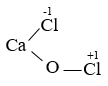 ŌåÆ muß╗æi hß╗Śn tß║Īp. |
| T├Łnh chß║źt |
- T├Łnh tß║®y m├Āu, s├Īt tr├╣ng. - NaClO l├Ā muß╗æi cß╗¦a axit yß║┐u:
NaClO + CO2 + H2O ŌåÆ HClO + NaHCO3 - NaClO, HClO: c├│ t├Łnh oxi h├│a rß║źt mß║Īnh. |
- Chß║źt bß╗Öt, m├Āu trß║»ng, xß╗æp. - T├Łnh oxi h├│a mß║Īnh:
CaOCl2 + 2HCl ŌåÆCaCl2 + Cl2+ H2O - T├Īc dß╗źng vß╗øi CO2 trong kh├┤ng kh├Ł ß║®m: 2CaOCl2 + CO2 + H2O ŌåÆ 2HClO + CaCO3 + CaCl2 |
| ß╗©ng dß╗źng |
- Tß║®y trß║»ng vß║Żi, sß╗Żi, giß║źy, ... - Tß║®y uß║┐ chuß╗ōng trß║Īi ch─ān nu├┤i, nh├Ā vß╗ć sinh |
- Tß║®y trß║»ng, tß║®y uß║┐. - Tinh chß║┐ dß║¦u mß╗Å. - Xß╗Ł l├Ł c├Īc chß║źt ─æß╗Öc, bß║Żo vß╗ć m├┤i trŲ░ß╗Øng. |
1.1.1 NŲ░ß╗øc Javel
- NŲ░ß╗øc Javel l├Ā dung dß╗ŗch hß╗Śn hß╗Żp muß╗æi NaCl v├Ā NaClO.
- Muß╗æi NaClO c├│ t├Łnh oxi h├│a rß║źt mß║Īnh, do vß║Ły nŲ░ß╗øc Javel c├│ t├Łnh tß║®y m├Āu, s├Īt tr├╣ng, tß║®y trß║»ng vß║Żi, sß╗Żi, giß║źy v├Ā d├╣ng s├Īt tr├╣ng chuß╗ōng trß║Īi ch─ān nu├┤i, nh├Ā vß╗ć sinh.
- NaClO l├Ā muß╗æi cß╗¦a axit rß║źt yß║┐u, yß║┐u hŲĪn axit cacbonic n├¬n dß╗ģ t├Īc dß╗źng vß╗øi CO2 cß╗¦a kh├┤ng kh├Ł tß║Īo th├Ānh axit HClO c├│ t├Łnh oxi h├│a mß║Īnh.
ŌćÆ nŲ░ß╗øc Javel kh├┤ng ─æß╗ā ─æŲ░ß╗Żc l├óu trong kh├┤ng kh├Ł.
1.1.2. Clorua v├┤i CaOCl2
- Clorua v├┤i l├Ā chß║źt bß╗Öt m├Āu trß║»ng, xß╗æp, m├╣i xß╗æc, c├│ t├Łnh oxi h├│a mß║Īnh.
- T├Īc dß╗źng vß╗øi axit clohidric cho Cl2┬Ł
CaOCl2 + 2HCl ŌåÆ CaCl2 + Cl2 + H2O
- Trong kh├┤ng kh├Ł ß║®m, clorua v├┤i t├Īc dß╗źng vß╗øi CO2 tß║Īo ra axit hipoclorŲĪ
1.2. ─Éiß╗üu chß║┐ nŲ░ß╗øc Javel v├Ā clorua v├┤i
1.2.1. ─Éiß╗üu chß║┐ nŲ░ß╗øc Javel
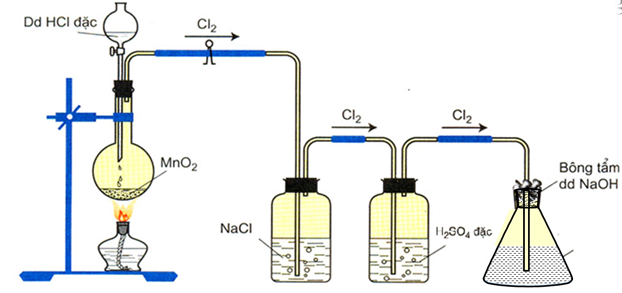
- Trong ph├▓ng th├Ł nghiß╗ćm:
Cho kh├Ł clo t├Īc dß╗źng vß╗øi NaOH lo├Żng ß╗¤ nhiß╗ćt ─æß╗Ö thŲ░ß╗Øng:
Cl2 + 2NaOH ŌåÆ NaCl + NaClO + H2O
H├¼nh 1: SŲĪ ─æß╗ō ─æiß╗üu chß║┐ nŲ░ß╗øc Javel trong ph├▓ng th├Ł nghiß╗ćm
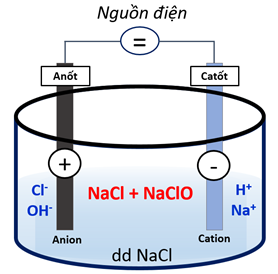
- Trong c├┤ng nghiß╗ćp:
ŌĆŗ─Éiß╗ćn ph├ón dung dß╗ŗch NaCl nß╗ōng ─æß╗Ö 15 ŌĆō 20% trong th├╣ng ─æiß╗ćn ph├ón kh├┤ng c├│ m├Āng ng─ān.
\(2NaCl + 2{H_2}O \to 2NaOH + {H_2} \uparrow + C{l_2} \uparrow \)
\(C{l_2} + 2NaOH \to NaCl + NaClO + H{}_2O\)
H├¼nh 2: ─Éiß╗üu chß║┐ nŲ░ß╗øc Javel trong c├┤ng nghiß╗ćp
1.2.2. Điều chế clorua vôi
Cho clo t├Īc dß╗źng vß╗øi v├┤i t├┤i (sß╗»a v├┤i) ß╗¤ 30oC thu ─æŲ░ß╗Żc clorua v├┤i:
Cl2 + Ca(OH)2 ŌåÆ CaOCl2 + H2O (to = 30OC)

Hình 3: Clorua vôi
B├Āi tß║Łp minh hß╗Źa
B├Āi 1:
Viß║┐t phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng biß╗āu diß╗ģn sŲĪ ─æß╗ō chuyß╗ān h├│a sau:
HŲ░ß╗øng dß║½n:
(1) \(2KMn{O_4} + 16HCl \to 2KCl + 2MnC{l_2} + 5C{l_2} \uparrow + 8{H_2}O\)
(2) \(C{l_2} + 2NaOH \to NaCl + NaClO + {H_2}O\)
(3) \(Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} \uparrow + 2{H_2}O\)
(4) \(C{l_2} + Ca{(OH)_2} \to CaOC{l_2} + {H_2}O\) ─ÉK: ß╗× 30oC
(5) \(CaOC{l_2} + 2HCl \to CaC{l_2} + C{l_2} + {H_2}O\)
Hoß║Ęc \(CaOC{l_2} \to CaC{l_2} + \frac{1}{2}{O_2}\) ─ÉK: toc
B├Āi 2:
Viß║┐t c├Īc phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng ─æiß╗üu chß║┐ nŲ░ß╗øc Javel tß╗½ c├Īc chß║źt c├│ trong ph├▓ng th├Ł nghiß╗ćm: NaCl, MnO2, H2SO4 ─æß║Ęc, NaOH
HŲ░ß╗øng dß║½n:
- ─Éiß╗üu chß║┐ axit HCl tß╗½ NaCl, H2SO4 ─æß║Ęc, H2O
NaCl (r) + H2SO4 (─æß║Ęc) ŌåÆ NaHSO4 + HCl ─ÉK: tOC
- Tß╗½ HCl va╠Ć MnO2 ─æiß╗üu chß║┐ khi╠ü Cl2
MnO2 + 4HCl (─æß║Ęc) ŌåÆ MnCl2 + Cl2 + 2H2O ─ÉK: tOC
- Tß╗½ Cl2 va╠Ć dung dß╗ŗch NaOH lo├Żng nguß╗Öi ─æiß╗üu chß║┐ nŲ░ß╗øc Javel
Cl2+ 2NaOH ŌåÆ NaCl + NaClO + H2O
B├Āi 3:
Chß╗ē d├╣ng mß╗Öt thuß╗æc thß╗Ł, h├Ży nhß║Łn biß║┐t c├Īc dung dß╗ŗch mß║źt nh├Żn sau: HCl, HClO, NaCl, NaClO
HŲ░ß╗øng dß║½n:
Sß╗Ł dß╗źng quß╗│ t├Łm:
- HCl ŌåÆ Q├╣y t├Łm h├│a ─æß╗Å
- HClO ŌåÆ Q├╣y t├Łm kh├┤ng ─æß╗Ģi m├Āu
- NaCl ŌåÆ Q├╣y t├Łm mß║źt m├Āu
- NaClO ŌåÆ Q├╣y t├Łm h├│a ─æß╗Å rß╗ōi mß║źt m├Āu
3. Luyß╗ćn tß║Łp B├Āi 24 H├│a hß╗Źc 10
Sau b├Āi hß╗Źc cß║¦n nß║»m: Th├Ānh phß║¦n h├│a hß╗Źc, ß╗®ng dß╗źng, nguy├¬n tß║»c sß║Żn xuß║źt c┼®ng nhŲ░ t├Łnh oxi h├│a mß║Īnh cß╗¦a mß╗Öt sß╗æ hß╗Żp chß║źt c├│ oxi cß╗¦a clo (nŲ░ß╗øc Gia-ven, clorua v├┤i).
3.1. Trß║»c nghiß╗ćm
B├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 10 B├Āi 24 c├│ phŲ░ŲĪng ph├Īp v├Ā lß╗Øi giß║Żi chi tiß║┐t gi├║p c├Īc em luyß╗ćn tß║Łp v├Ā hiß╗āu b├Āi.
-
- A. Oxi nguy├¬n tŲ░╠ē co╠ü ti╠ünh oxi ho╠üa ma╠Żnh.
- B. Cl+ co╠ü ti╠ünh oxi ho╠üa ma╠Żnh.
- C. Cl- va╠Ć oxi nguy├¬n tŲ░╠ē co╠ü ta╠üc du╠Żng pha╠ü hu╠ēy ma╠Żnh.
- D. Do ca╠üc mu├┤╠üi tŲ░╠Ż ph├ón hu╠ēy.
-
- A. Clorua v├┤i re╠ē ti├¬╠Ćn hŲĪn.
- B. Clorua v├┤i co╠ü ha╠Ćm lŲ░ŲĪ╠Żng hipoclorit cao hŲĪn.
- C. Clorua v├┤i ─æ├¬╠ē ba╠ēo qua╠ēn va╠Ć d├¬╠ā chuy├¬n chŲĪ╠ē hŲĪn.
- D. Ca╠ē A, B, C.
-
- A. Clorua v├┤i l├Ā muß╗æi tß║Īo bß╗¤i mß╗Öt kim loß║Īi li├¬n kß║┐t vß╗øi mß╗Öt loß║Īi gß╗æc axit
- B. Clorua v├┤i l├Ā muß╗æi tß║Īo bß╗¤i mß╗Öt kim loß║Īi li├¬n kß║┐t vß╗øi hai loß║Īi gß╗æc axit
- C. Clorua v├┤i l├Ā muß╗æi tß║Īo bß╗¤i hai kim loß║Īi li├¬n kß║┐t vß╗øi mß╗Öt loß║Īi gß╗æc axit
- D. Clorua v├┤i kh├┤ng phß║Żi l├Ā muß╗æi
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK v├Ā N├óng cao
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung b├Āi hß╗Źc th├┤ng qua phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 10 B├Āi 24.
B├Āi tß║Łp 1 trang 108 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 2 trang 108 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 3 trang 108 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 4 trang 108 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 5 trang 108 SGK H├│a hß╗Źc 10
B├Āi tß║Łp 24.1 trang 56 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 24.2 trang 57 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 24.3 trang 57 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 24.4 trang 57 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 24.5 trang 57 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 24.6 trang 57 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 24.7 trang 57 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 24.8 trang 58 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 24.9 trang 58 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 24.10 trang 58 SBT H├│a hß╗Źc 10
B├Āi tß║Łp 1 trang 134 SGK H├│a hß╗Źc 10 n├óng cao
B├Āi tß║Łp 2 trang 134 SGK H├│a hß╗Źc 10 n├óng cao
B├Āi tß║Łp 3 trang 134 SGK H├│a hß╗Źc 10 n├óng cao
B├Āi tß║Łp 4 trang 134 SGK H├│a hß╗Źc 10 n├óng cao
B├Āi tß║Łp 5 trang 134 SGK H├│a hß╗Źc 10 n├óng cao
4. Hß╗Åi ─æ├Īp vß╗ü B├Āi 24 ChŲ░ŲĪng 5 H├│a hß╗Źc 10
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ bß║źt k├¼ thß║»c mß║»c g├¼, c├Īc em h├Ży ─æß╗ā lß║Īi lß╗Øi nhß║»n ß╗¤ mß╗źc Hß╗Åi ─æ├Īp ─æß╗ā c├╣ng cß╗Öng ─æß╗ōng H├│a HOC247 thß║Żo luß║Łn v├Ā trß║Ż lß╗Øi nh├®.