Nội dung bài học tìm hiểu về Tính chất hoá học của axit như khả năng tác dụng với quỳ tím, với bazơ, oxit bazơ và kim loại.
Tóm tắt lý thuyết
1.1. Tính chất hóa học
1.1.1. Axit làm đổi màu chất chỉ thị màu
- Dung dịch axit làm quỳ tím chuyển thành màu đỏ.
- Các em chú ý quan sát thí nghiệm làm đổi màu quỳ của đại diện các chất thuộc axit và bazơ
Video 1: Khả năng làm đổi màu quỳ tím của axit và bazơ
1.1.2. Axit tác dụng với kim loại
*Thí nghiệm 1: Fe tác dụng với dung dịch HCl
Video 2: Phản ứng giữa Fe và dung dịch HCl
- Hiện tượng: Có xuất hiện khí không màu
- Giải thích: Do xảy ra phản ứng tạo khí không màu là khí H2 theo phương trình: Fe + 2HCl → FeCl2 + H2
*Thí nghiệm 2: Fe phản ứng với axit H2SO4 loãng
Video 3: Phản ứng giữa kim loại Fe và axit H2SO4
- Hiện tượng: Có xuất hiện khí không màu
- Giải thích: Do xảy ra phản ứng tạo khí không màu là khí H2 theo phương trình: Fe + H2SO4 → FeSO4 + H2
* Kết luận:
- Dung dịch axit tác dụng được với một số kim loại tạo muối và giải phóng khí H2 (Trừ Cu, Ag, Au)
- dd HNO3, H2SO4 đặc tác dụng với nhiều kim loại nhưng không giải phóng H2 (tính chất này sẽ được tìm hiểu ở chương trình THPT)
1.1.3. Axit tác dụng với bazơ
- Các em chú ý quan sát thao tác tiến hành cũng như hiện tượng quan sát được khi tiến hành thí nghiệm Cu(OH)2 với H2SO4
Video 4: Phản ứng giữa dung dịch Cu(OH)2 và axit H2SO4
- Hiện tượng: Cu(OH)2 tan dần và tạo thành dung dịch màu xanh
- Giải thích: Do xảy ra phản ứng theo phương trình: Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
*Kết luận: Axit tác dụng với bazơ tạo muối và nước
1.1.4. Axit tác dụng với oxit bazơ
- Phản ứng giữa Fe2O3 và dung dịch HCl
- Hiện tượng: Fe2O3 bị hòa tan dần và tạo thành dung dịch màu nâu
- Giải thích: Do xảy ra phản ứng theo phương trình: Fe2O3 + 6HCl → 2FeCl2 + 3H2O
* Kết luận: Axit tác dụng với oxit bazơ tạo muối và nước.
Ngoài ra, Axit còn tác dụng được với muối ( tính chất này sẽ được học ở bài 9)
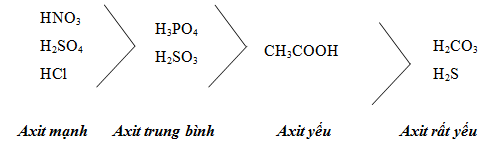
1.2. Axit mạnh, axit yếu
Hình 1: Các mức axit vô cơ ( mạnh - trung bình - yếu - rất yếu)
1.3. Tổng kết
Hình 2: Sơ đồ tư duy bài Tính chất hóa học của Axit
Bài tập minh họa
Bài 1:
Cho 32g một oxit kim loại hóa trị III tan hết trong 294g dung dịch H2SO4. Tìm công thức của oxit kim loại trên.
Hướng dẫn:
Công thức cần tìm có dạng: X2O3
- Khối lượng H2SO4: m = 20.294100 = 58,8 g
- Số mol H2SO4 = 0,6 mol.
- Phương trình phản ứng:
X2O3 + 3H2SO4 → X2 (SO4)3 + 3H2O
0,2 mol 0,6mol
Phân tử lượng của oxit: M =160.
Vậy oxit đó là Fe2O3.
Bài 2:
a. Cho từ từ dung dịch X chứa x mol HCl vào dung dịch Y chứa y mol Na2CO3 (x< 2y) thì thu được dung dịch Z chứa V lít khí. Tính V?
b. Nếu cho dung dịch Y vào dung dịch X thì thu được dung dịch A và V1 lít khí. Các phản ứng xảy ra hoàn toàn và thể tích khí đo ở điều kiện tiêu chuẩn. Tìm mối quan hệ giữa V1 với x, y.
Hướng dẫn:
a.Cho từ từ HCl vào Na2CO3, phản ứng xảy ra như sau:
HCl + Na2CO3 --> NaHCO3 + NaCl (1)
Nhưng theo đầu bài có khí bay ra nên phản ứng tiếp tục:
HCl + NaHCO3 --> NaCl + CO2 + H2O (2)
Phản ứng (1) sẽ xảy ra hoàn toàn, sinh ra y mol NaHCO3.
Muốn phản ứng (2) xảy ra thì x > y.
Do đề bài cho x < 2y nên (2) phản ứng theo số mol của HCl còn lại.
Vậy V = 22,4.(x – y)
b.Khi cho Na2CO3 vào HCl:
Na2CO3 + 2HCl --> 2NaCl + CO2 + H2O
1 mol 2 mol
y mol x mol
Đề bài cho x < 2y nên ta tính số mol khí sinh ra theo HCl:
V1 = xy . 22,4l
3. Luyện tập Bài 3 Hóa học 9
Sau bài học cần nắm: Tính chất hoá học của axit như khả năng tác dụng với quỳ tím, với bazơ, oxit bazơ và kim loại.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 3 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. NaOH
- B. Fe
- C. CaO
- D. CO2
-
- A. Dung dịch NaOH
- B. Dung dịch Na2CO3
- C. Dung dịch HCl
- D. Dung dịch Ca(OH)2
-
- A. Fe, Cu, Mg
- B. Zn, Fe, Cu
- C. Zn, Fe, Al.
- D. Fe, Zn, Ag
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 3.
Bài tập 1 trang 14 SGK Hóa học 9
Bài tập 2 trang 14 SGK Hóa học 9
Bài tập 3 trang 14 SGK Hóa học 9
Bài tập 4 trang 14 SGK Hóa học 9
Bài tập 3.1 trang 5 SBT Hóa học 9
Bài tập 3.2 trang 5 SBT Hóa học 9
Bài tập 3.3 trang 6 SBT Hóa học 9
Bài tập 3.4 trang 6 SBT Hóa học 9
Bài tập 3.5 trang 6 SBT Hóa học 9
Bài tập 3.6 trang 6 SBT Hóa học 9
4. Hỏi đáp về Bài 3 chương 1 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.