Nội dung bài học Các oxit của cacbon tìm hiểu về hai hợp chất quan trọng là CO và CO2. Hai oxit này thuộc loại nào? Chúng có những tính chất và ứng dụng gì? để trả lời chúng ta sẽ nghiên cứu về tính chất và ứng dụng của các oxit này.
Tóm tắt lý thuyết
1.1. CACBON OXIT
- Công thức phân tử: CO
- Phân tử khối: 28
1.1.1. Tính chất vật lí
CO là chất khí không màu, không mùi, ít tan trong nước, hơi nhẹ hơn không khí, rất độc.
1.1.2. Tính chất hóa học
- CO là Oxit trung tính: Ở nhiệt độ thường CO không phản ứng với nước, kiềm và axít.
- CO là chất khử
+ Ở nhiệt độ cao CO khử được nhiều oxít kim loại
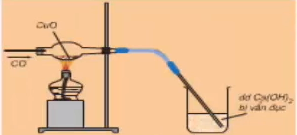
+ CO khử CuO theo phương trình:
CuO (đen) + CO .PNG)
Hình 1: CO khử Cu
Video 1: Phản ứng giữa CO và CuO
- CO khử oxit Sắt trong lò cao:
4CO + Fe3O4 .PNG)
- CO cháy trong Oxi hoặc trong không khí với ngọn lửa xanh, tỏa nhiều nhiệt.
2CO + O2 .PNG)
1.1.3. Ứng dụng
Làm nhiên liệu, chất khử, nguyên liệu trong công nghiệp hóa học
1.2. CACBON ĐIOXIT
- Công thức phân tử: CO2
- Phân tử khối: 44
1.2.1. Tính chất vật lí
- CO2 là chất khí không màu, không mùi, nặng hơn không khí, không duy trì sự cháy, CO2 bị nén và làm lạnh thì hoá rắn.
Video 2: Chứng minh CO2 không duy trì sự cháy
- Ngọn nến đang cháy, khi rót khí CO2 vào nến tắt
1.2.2. Tính chất hóa học
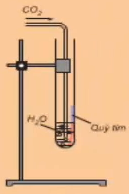
Tác dụng với nước
- Cách tiến hành:
Khí CO2 phản ứng với nước
- Hiện tượng: Dung dịch làm quỳ chuyển thành màu đỏ sau khi đun lại thành màu tím
- Giải thích: Do xảy ra phản ứng CO2 + H2O \(\leftrightarrows\) H2CO3 . Khí CO2 phản ứng với nước tạo dung dịch axit yếu là H2CO3 làm quỳ chuyển đỏ, H2CO3 không bền nên khi đun nóng dung dịch sẽ làm quỳ tím chuyển lại màu tím.
Tác dụng với dd bazơ
- Sản phẩm tạo thành phụ thuộc vào tỉ lệ số mol
CO2 + 2NaOH → Na2CO3+H2O
1 mol 2 mol
CO2 + NaOH → NaHCO3(dd)
1 mol 1 mol
2CO2+3NaOH → NaHCO3+Na2CO3
2 mol 3 mol
- Nhận xét: Khi làm các bài tập liên quan đến phản ứng giữa CO2 và NaOH hoặc KOH thì ta nhận định sản phẩm tạo thành bằng tỉ lệ mol. Lập tỉ lệ \(\frac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}}\).
\(\frac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}}\) \(\leq\) 1 ⇒ Tạo muối NaHCO3
1 < \(\frac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}}\) < 2 ⇒ Tạo 2 muối NaHCO3 và Na2CO3
\(\frac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}}\) \(\geq\) 2 ⇒ Tạo muối Na2CO3
1.2.3. Ứng dụng
CO2 chữa cháy, bảo quản thực phẩm, sản xuất nước giải khát có gas, sản xuất xôđa, phân đạm urê.
Bài tập minh họa
Bài 1:
Khử hoàn toàn 32 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
Hướng dẫn:
Phương trình hóa học: CuO + CO .PNG)
Số mol Cu = số mol CuO = 0,4 → mCu = 25,6 gam
Bài 2:
Cho khí CO dư đi qua ống chứa 0,2 mol MgO và 0,2 mol CuO nung nóng, đến phản ứng hoàn toàn, thu được x gam chất rắn. Giá trị của x là:
Hướng dẫn:
Phương trình hóa học: CuO + CO .PNG)
0,2 → 0,2
Chất rắn gồm MgO và Cu (vì MgO không phản ứng với CO)
⇒ x = mMgO + mCu = 0,2.(24+16) + 0,2.64 = 20,8g
3. Luyện tập Bài 28 Hóa học 9
Sau bài học cần nắm:
- Tính chất hoá học của CO, CO2
- Xác định phản ứng có thực hiện được hay không và viết phương trình hóa học
- Nhận biết CO2, một số muối cacbonat cụ thể
- Tính thành phần phần trăm thể tích khí CO và CO2 trong hỗn hợp.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 28 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Cacbon mono oxit là oxit:
- A. Oxit axit.
- B. Oxit bazơ.
- C. Oxit lưỡng tính.
- D. Oxit trung tính.
-
- A. Nước, dung dịch bazơ, oxit bazơ.
- B. Nước, dung dịch axit, oxit bazơ.
- C. Nước, oxit axit, oxit bazơ.
- D. Nước, dung dịch bazơ, oxit axit.
-
Câu 3:
Người ta có thể rót khí CO2 từ cốc này sang cốc khác là do tính chất nào sau đây:
- A. CO2 là chất khí nặng hơn không khí.
- B. CO2 là chất khí không màu, không mùi.
- C. CO2 không duy trì sự cháy và sự sống.
- D. CO2 bị nén và làm lạnh hóa rắn.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 28.
Bài tập 1 trang 87 SGK Hóa học 9
Bài tập 2 trang 87 SGK Hóa học 9
Bài tập 3 trang 87 SGK Hóa học 9
Bài tập 4 trang 87 SGK Hóa học 9
Bài tập 5 trang 87 SGK Hóa học 9
Bài tập 28.1 trang 34 SBT Hóa học 9
Bài tập 28.2 trang 34 SBT Hóa học 9
Bài tập 28.3 trang 34 SBT Hóa học 9
Bài tập 28.4 trang 35 SBT Hóa học 9
Bài tập 28.5 trang 35 SBT Hóa học 9
Bài tập 28.6 trang 35 SBT Hóa học 9
Bài tập 28.7 trang 35 SBT Hóa học 9
Bài tập 28.8 trang 35 SBT Hóa học 9
Bài tập 28.9 trang 36 SBT Hóa học 9
Bài tập 28.10 trang 36 SBT Hóa học 9
Bài tập 28.11 trang 36 SBT Hóa học 9
Bài tập 28.12 trang 36 SBT Hóa học 9
Bài tập 28.13 trang 36 SBT Hóa học 9
4. Hỏi đáp về Bài 28 chương 3 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.