ß╗× c├Īc lß╗øp dŲ░ß╗øi v├Ā ß╗¤ chŲ░ŲĪng I, II, III c├Īc em biß║┐t g├¼ vß╗ü nguy├¬n tß╗æ oxi, vß╗ü ─æŲĪn chß║źt phi kim oxi? C├Īc em c├│ nhß║Łn x├®t g├¼ vß╗ü m├Āu sß║»c, m├╣i vß╗ŗ v├Ā t├Łnh tan trong nŲ░ß╗øc cß╗¦a kh├Ł oxi? Oxi c├│ thß╗ā t├Īc dß╗źng vß╗øi c├Īc chß║źt kh├Īc ─æŲ░ß╗Żc kh├┤ng? Nß║┐u ─æŲ░ß╗Żc th├¼ mß║Īnh hay yß║┐u? Cß╗ź thß╗ā ch├║ng ta sß║Į c├╣ng nhau t├¼m hiß╗āu c├Īc vß║źn ─æß╗ü tr├¬n trong b├Āi giß║Żng T├Łnh chß║źt cß╗¦a oxi ng├Āy h├┤m nay.
T├│m tß║»t l├Į thuyß║┐t
- K├Ł hiß╗ću h├│a hß╗Źc cß╗¦a nguy├¬n tß╗æ oxi l├Ā O
- C├┤ng thß╗®c h├│a hß╗Źc cß╗¦a ─æŲĪn chß║źt (kh├Ł) oxi l├Ā O2
- Nguy├¬n tß╗Ł khß╗æi: 16
- Ph├ón tß╗Ł khß╗æi: 32
- Oxi l├Ā nguy├¬n tß╗æ h├│a hß╗Źc phß╗Ģ biß║┐n nhß║źt (chiß║┐m 49,4% khß╗æi lŲ░ß╗Żng vß╗Å Tr├Īi ─Éß║źt). ß╗× dß║Īng ─æŲĪn chß║źt, kh├Ł oxi c├│ nhiß╗üu trong kh├┤ng kh├Ł. ß╗× dß║Īng hß╗Żp chß║źt, nguy├¬n tß╗æ oxi c├│ trong nŲ░ß╗øc, ─æŲ░ß╗Øng, quß║Ęng, ─æß║źt ─æ├Ī, cŲĪ thß╗ā ngŲ░ß╗Øi, ─æß╗Öng vß║Łt v├Ā thß╗▒c vß║Łt...
H├¼nh 1: Oxi l├Ā nguy├¬n tß╗æ phß╗Ģ biß║┐n nhß║źt (chiß║┐m 49,4% khß╗æi lŲ░ß╗Żng vß╗Å Tr├Īi ─Éß║źt)
1.1. T├Łnh chß║źt vß║Łt l├Ł
- Chß║źt kh├Ł, kh├┤ng m├Āu, kh├┤ng m├╣i, ├Łt tan trong nŲ░ß╗øc, nß║Ęng hŲĪn kh├┤ng kh├Ł. Ho├Ī lß╗Ång ß╗¤ -1830C.
H├¼nh 2: Trß║Īng th├Īi tß╗▒ nhi├¬n cß╗¦a kh├Ł oxi v├Ā oxi lß╗Ång
1.2. T├Łnh chß║źt h├│a hß╗Źc
1.2.1. T├Īc dß╗źng vß╗øi phi kim
T├Īc dß╗źng vß╗øi lŲ░u huß╗│nh (S)
- C├Īch tiß║┐n h├Ānh: ─ÉŲ░a mu├┤i sß║»t c├│ chß╗®a bß╗Öt S v├Āo ngß╗Źn lß╗Ła ─æ├©n cß╗ōn. Sau ─æ├│ ─æŲ░a S ─æang ch├Īy v├Āo lß╗Ź thuß╗Ę tinh c├│ chß╗®a kh├Ł oxi.
Video 1: Phß║Żn ß╗®ng giß╗»a lŲ░u huß╗│nh v├Ā kh├Ł Oxi
- Hiß╗ćn tŲ░ß╗Żng: LŲ░u huß╗│nh ch├Īy trong kh├Ł oxi m├Żnh liß╗ćt hŲĪn ch├Īy trong kh├┤ng kh├Ł, cho ngß╗Źn lß╗Ła m├Āu xanh.
- Giß║Żi th├Łch: Do lŲ░u huß╗│nh ch├Īy trong oxi tß║Īo th├Ānh lŲ░u huß╗│nh ─æioxit (SO2), c├▓n gß╗Źi l├Ā kh├Ł sunfurŲĪ) v├Ā rß║źt ├Łt lŲ░u huß╗│nh trioxit (SO3)
- PhŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng: S + O2
SO2
T├Īc dß╗źng vß╗øi Photpho
- C├Īch tiß║┐n h├Ānh: ─Éß╗æt Photpho ─æß╗Å trong kh├Ł Oxi
Video 2: Phopho ch├Īy trong kh├Ł oxi
- Hiß╗ćn tŲ░ß╗Żng: Photpho ch├Īy mß║Īnh trong kh├Ł oxi vß╗øi ngß╗Źn lß╗Ła s├Īng ch├│i, tß║Īo ra kh├│i trß║»ng d├Āy ─æß║Ęc b├Īm v├Āo th├Ānh lß╗Ź lŲ░ß╗øi dß║Īng bß╗Öt tan ─æŲ░ß╗Żc trong nŲ░ß╗øc.
- Giß║Żi th├Łch: Bß╗Öt trß║»ng tß║Īo th├Ānh dŲ░ß╗øi ─æ├Īy lß╗Ź ch├Łnh l├Ā ─æi photpho pentaoxit c├│ c├┤ng thß╗®c h├│a hß╗Źc l├Ā P2O5
- PhŲ░ŲĪng tr├¼nh h├│a hß╗Źc: 4P + 5O2
2P2O5
1.2.2. T├Īc dß╗źng vß╗øi kim loß║Īi
- C├Īch tiß║┐n h├Ānh: Quß║źn th├¬m v├Āo d├óy sß║»t mß╗Öt mß║®u than gß╗Ś (mß╗źc ─æ├Łch l├Ā cung cß║źp nhiß╗ćt ─æß╗Ö cho d├óy sß║»t nhß╗Ø phß║Żn ß╗®ng ch├Īy cß╗¦a Cacbon) rß╗ōi ─æß╗æt cho d├óy sß║»t n├│ng ─æß╗Å rß╗ōi ─æŲ░a v├Āo b├¼nh chß╗®a kh├Ł Oxi.
Video 3: Sß║»t ch├Īy trong kh├Ł Oxi
- Hiß╗ćn tŲ░ß╗Żng: Khi cho d├óy sß║»t c├│ quß║źn mß║®u than hß╗ōng v├Āo lß╗Ź kh├Ł oxi, mß║®u than ch├Īy trŲ░ß╗øc tß║Īo nhiß╗ćt ─æß╗Ö ─æß╗¦ cao cho sß║»t ch├Īy. Sß║»t ch├Īy mß║Īnh, s├Īng ch├│i, kh├┤ng c├│ ngß╗Źn lß╗Ła, kh├┤ng c├│ kh├│i, tß║Īo ra nhß╗»ng hß║Īt nhß╗Å n├│ng chß║Ży m├Āu n├óu.
- Giß║Żi th├Łch: Nhß╗»ng hß║Īt nhß╗Å n├│ng chß║Ży m├Āu n├óu l├Ā Sß║»t (II, III) oxit, c├┤ng thß╗®c h├│a hß╗Źc l├Ā Fe3O4 thŲ░ß╗Øng gß╗Źi l├Ā sß║»t tß╗½ oxit.
- PhŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng: 3Fe + 2O2
Fe3O4
1.2.3. T├Īc dß╗źng vß╗øi hß╗Żp chß║źt
Kh├Ł metan c├│ trong kh├Ł b├╣n ao, phß║Żn ß╗®ng ch├Īy cß╗¦a metan trong kh├┤ng kh├Ł tß║Īo th├Ānh kh├Ł cacbonic, nŲ░ß╗øc, ─æß╗ōng thß╗Øi toß║Ż nhiß╗üu nhiß╗ćt.
CH4 + 2O2 .PNG)
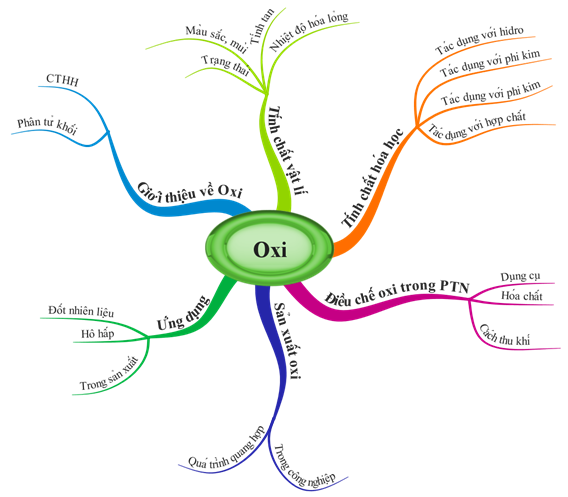
1.3. Tß╗Ģng kß║┐t
H├¼nh 3: SŲĪ ─æß╗ō tŲ░ duy b├Āi T├Łnh chß║źt cß╗¦a Oxi
B├Āi tß║Łp minh hß╗Źa
B├Āi 1:
─Éß╗æt ch├Īy 6,2g P trong b├¼nh chß╗®a 6,72 lit kh├Ł oxi ( ß╗¤ ─æktc) tß║Īo th├Ānh P2O5.
a. Chß║źt n├Āo c├▓n dŲ░, chß║źt n├Āo thiß║┐u?
A. P c├▓n dŲ░, O2 thiß║┐u. B. P c├▓n thiß║┐u, O2 dŲ░.
C. Cß║Ż 2 chß║źt vß╗½a ─æß╗¦. D. Tß║źt cß║Ż ─æß╗üu sai.
b. Khß╗æi lŲ░ß╗Żng chß║źt tß║Īo th├Ānh l├Ā bao nhi├¬u?
A. 15,4g. B. 16g.
C. 14,2g. D. Tß║źt cß║Ż ─æß╗üu sai.
HŲ░ß╗øng dß║½n:
a) Sß╗æ mol cß╗¦a Photpho tham gia phß║Żn ß╗®ng l├Ā:
\({n_P} = \frac{{{m_P}}}{{{M_P}}} = \frac{{6,2}}{{31}} = 0,2(mol)\)
Sß╗æ mol oxi tham gia phß║Żn ß╗®ng l├Ā:
\({n_{{O_2}}} = \frac{V}{{22,4}} = \frac{{6,72}}{{22,4}} = 0,3(mol)\)
PhŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng: 4P + 5O2 .PNG)
X├®t tß╗ē lß╗ć phß║Żn ß╗®ng sß╗æ mol chia cho hß╗ć sß╗æ phß║Żn ß╗®ng ta c├│:
\(\frac{{0,2}}{4} < \frac{{0,3}}{5}\) ŌćÆ Oxi dŲ░, P phß║Żn ß╗®ng vß╗½a ─æß╗¦
Vß║Ły ta chß╗Źn ─æ├Īp ├Īn D
b) Khß╗æi lŲ░ß╗Żng chß║źt tß║Īo th├Ānh ta dß╗▒a v├Āo sß╗æ mol cß╗¦a Photpho, l├Ā chß║źt phß║Żn ß╗®ng vß╗½a ─æß╗¦.
4P + 5O2 .PNG)
4 mol ŌåÆ 2 mol
0,2 (mol) ŌåÆ ? (mol)
Sß╗æ mol P2O5 tß║Īo th├Ānh l├Ā:
\({n_{{P_2}{O_5}}} = \frac{{0,2 \times 2}}{4} = 0,1(mol)\)
Khß╗æi lŲ░ß╗Żng P2O5 tß║Īo th├Ānh l├Ā:
\({m_{{P_2}{O_5}}} = {n_{{P_2}{O_5}}}.{M_{{P_2}{O_5}}} = 0,1(31 \times 2 + 16 \times 5) = 14,2(gam)\)
Vß║Ły ta chß╗Źn ─æ├Īp ├Īn C
B├Āi 2:
─Éß╗æt ch├Īy hß║┐t 3,2 g kh├Ł metan trong kh├┤ng kh├Ł sinh ra kh├Ł cacbonic v├Ā nŲ░ß╗øc.
a) Viß║┐t phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng
b) T├Łnh thß╗ā t├Łch kh├Ł oxi (ß╗¤ ─æktc)
c) T├Łnh khß╗æi lŲ░ß╗Żng kh├Ł cacbonic tß║Īo th├Ānh.
HŲ░ß╗øng dß║½n:
a) PhŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng: CH4 + 2O2 .PNG)
b) Sß╗æ mol kh├Ł metan tham gia phß║Żn ß╗®ng l├Ā:
\({n_{C{H_4}}} = \frac{m}{M} = \frac{{3,2}}{{12 + 4}} = 0,2(mol)\)
Thay sß╗æ mol metan v├Āo phŲ░ŲĪng tr├¼nh ta c├│:
CH4 + 2O2 .PNG)
1 mol ŌåÆ 2 mol ŌåÆ 1 mol
0,2 mol ŌåÆ ? mol ŌåÆ ? mol
Sß╗æ mol Oxi tham gia phß║Żn ß╗®ng l├Ā:
\({n_{{O_2}}} = \frac{{0,2 \times 2}}{1} = 0,4(mol)\)
Thß╗ā t├Łch kh├Ł Oxi tham gia phß║Żn ß╗®ng l├Ā:
\({V_{{O_2}}} = {n_{{O_2}}} \times 22,4 = 0,4 \times 22,4 = 8,96(lit)\)
c) Sß╗æ mol kh├Ł cacbonic tß║Īo th├Ānh:
\({n_{C{O_2}}} = \frac{{0,2 \times 1}}{1} = 0,2(mol)\)
Khß╗æi lŲ░ß╗Żng kh├Ł Cacbonat tß║Īo th├Ānh l├Ā:
\({m_{C{O_2}}} = {n_{C{O_2}}}.{M_{C{O_2}}} = 0,2.(12 + 16 \times 2) = 8,8(gam)\)
3. Luyß╗ćn tß║Łp B├Āi 24 H├│a hß╗Źc 8
Sau b├Āi hß╗Źc cß║¦n nß║»m:
- Nguy├¬n tß╗æ oxi, vß╗ü ─æŲĪn chß║źt phi kim oxi? C├Īc em c├│ nhß║Łn x├®t g├¼ vß╗ü m├Āu sß║»c, m├╣i vß╗ŗ v├Ā t├Łnh tan trong nŲ░ß╗øc cß╗¦a kh├Ł oxi?
- Oxi c├│ thß╗ā t├Īc dß╗źng vß╗øi c├Īc chß║źt kh├Īc ─æŲ░ß╗Żc kh├┤ng? Nß║┐u ─æŲ░ß╗Żc th├¼ mß║Īnh hay yß║┐u?
3.1. Trß║»c nghiß╗ćm
B├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 8 B├Āi 24 c├│ phŲ░ŲĪng ph├Īp v├Ā lß╗Øi giß║Żi chi tiß║┐t gi├║p c├Īc em luyß╗ćn tß║Łp v├Ā hiß╗āu b├Āi.
-
-
A.
S + O2
SO2
-
B.
4P + 5O2
2P2O5
-
C.
C + O2
CO2
-
D.
3Fe + 2O2
Fe3O4
-
A.
S + O2
-
-
A.
3Fe + 2O2
ŌĆŗ Fe3O4
-
B.
CH4 + 2O2
CO2+ 2H2O
-
C.
C + O2
CO2
-
D.
4P + 5O2
2P2O5
-
A.
3Fe + 2O2
-
- A. 16 gam
- B. 32 gam
- C. 64 gam
- D. 48 gam
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK v├Ā N├óng cao
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung b├Āi hß╗Źc th├┤ng qua phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 8 B├Āi 24.
B├Āi tß║Łp 1 trang 84 SGK H├│a hß╗Źc 8
B├Āi tß║Łp 2 trang 84 SGK H├│a hß╗Źc 8
B├Āi tß║Łp 3 trang 84 SGK H├│a hß╗Źc 8
B├Āi tß║Łp 4 trang 84 SGK H├│a hß╗Źc 8
B├Āi tß║Łp 5 trang 84 SGK H├│a hß╗Źc 8
B├Āi tß║Łp 6 trang 84 SGK H├│a hß╗Źc 8
B├Āi tß║Łp 24.1 trang 32 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.2 trang 32 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.3 trang 32 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.4 trang 32 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.5 trang 33 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.6 trang 33 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.7 trang 33 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.8 trang 33 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.9 trang 33 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.10 trang 33 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.11 trang 34 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.12 trang 34 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.13 trang 34 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.14 trang 34 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.15 trang 34 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.16 trang 34 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.17 trang 34 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.18 trang 34 SBT H├│a hß╗Źc 8
B├Āi tß║Łp 24.19 trang 34 SBT H├│a hß╗Źc 8
4. Hß╗Åi ─æ├Īp vß╗ü B├Āi 24 ChŲ░ŲĪng 4 H├│a hß╗Źc 8
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ bß║źt k├¼ thß║»c mß║»c g├¼, c├Īc em h├Ży ─æß╗ā lß║Īi lß╗Øi nhß║»n ß╗¤ mß╗źc Hß╗Åi ─æ├Īp ─æß╗ā c├╣ng cß╗Öng ─æß╗ōng H├│a HOC247 thß║Żo luß║Łn v├Ā trß║Ż lß╗Øi nh├®.