B├Āi giß║Żng ─æi v├Āo t├¼m hiß╗āu Sß╗▒ ─æiß╗ćn li l├Ā g├¼? Chß║źt ─æiß╗ćn li l├Ā g├¼? R├©n luyß╗ćn khß║Ż n─āng quan s├Īt th├Ł nghiß╗ćm r├║t ra ─æŲ░ß╗Żc kß║┐t luß║Łn vß╗ü t├Łnh dß║½n ─æiß╗ćn cß╗¦a dung dß╗ŗch chß║źt ─æiß╗ćn li, Ph├ón biß╗ćt ─æŲ░ß╗Żc chß║źt ─æiß╗ćn li, chß║źt kh├┤ng ─æiß╗ćn li, chß║źt ─æiß╗ćn li mß║Īnh, chß║źt ─æiß╗ćn li yß║┐u, Viß║┐t ─æŲ░ß╗Żc phŲ░ŲĪng tr├¼nh ─æiß╗ćn li cß╗¦a chß║źt ─æiß╗ćn li mß║Īnh, chß║źt ─æiß╗ćn li yß║┐u.
T├│m tß║»t l├Į thuyß║┐t
1.1. Hiß╗ćn tŲ░ß╗Żng ─Éiß╗ćn li
1.1.1. Th├Ł nghiß╗ćm
- Trong SGK tr├¼nh b├Āy c├Īch tiß║┐n h├Ānh th├Ł nghiß╗ćm ─æß╗ōng loß║Īt bß║▒ng nguß╗ōn ─æiß╗ćn v├Ā h├│a chß║źt l├Ā NaCl khan, NaOH khan, sacarozŲĪ, nŲ░ß╗øc cß║źt, dd NaCl , dd NaOH , dd sacarozo, ancol etylic.
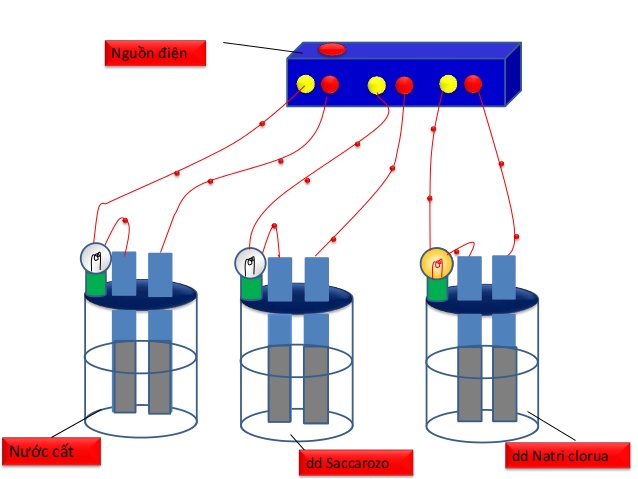
H├¼nh 1: Bß╗Ö dß╗źng cß╗ź chß╗®ng minh sß╗▒ dß║½n ─æiß╗ćn cß╗¦a dung dß╗ŗch
- Tuy nhi├¬n, th├Ł nghiß╗ćm n├Āy dß╗źng cß╗ź tiß║┐n h├Ānh th├Ł nghiß╗ćm hŲĪi rŲ░ß╗Øm r├Ā n├¬n khi tiß║┐n h├Ānh cho hß╗Źc sinh quan s├Īt, GV thŲ░ß╗Øng sß╗Ł dß╗źng thiß║┐t bß╗ŗ thß╗Ł t├Łnh dß║½n ─æiß╗ćn ─æŲĪn giß║Żn nhŲ░ sau:
Video 1: Th├Ł nghiß╗ćm Sß╗▒ ─æiß╗ćn li
- Hiß╗ćn tŲ░ß╗Żng: Dd NaCl, HCl, NaOH, ŌĆ” l├Ām ─æ├©n s├Īng. Dd saccarozŲĪ, rŲ░ß╗Żu etylic ŌĆ” kh├┤ng l├Ām ─æ├©n ph├Īt s├Īng
- Giß║Żi th├Łch: Cho dß╗źng cß╗ź thß╗Ł t├Łnh dß║½n ─æiß╗ćn v├Āo lß║¦n lŲ░ß╗Żt c├Īc cß╗æc ─æß╗▒ng c├Īc chß║źt kh├Īc nhau. B├│ng ─æ├©n ph├Īt s├Īng chß╗®ng tß╗Å chß║źt ─æß╗▒ng trong cß╗æc ─æ├│ c├│ t├Łnh dß║½n ─æiß╗ćn.ŌĆŗ
- Kß║┐t luß║Łn: Dung dß╗ŗch Axit, bazŲĪ v├Ā muß╗æi ─æß╗üu dß║½n ─æiß╗ćn
1.1.2. Nguy├¬n nh├ón t├Łnh dß║½n ─æiß╗ćn cß╗¦a c├Īc dd axit, bazŲĪ, muß╗æi trong nŲ░ß╗øc.
- C├Īc muß╗æi, ax├Łt, bazŲĪ khi tan trong nŲ░ß╗øc ph├ón li ra c├Īc ion l├Ām cho dd cß╗¦a ch├║ng dß║½n ─æiß╗ćn.
- Qu├Ī tr├¼nh ph├ón li c├Īc chß║źt trong H2O ra ion l├Ā sß╗▒ ─æiß╗ćn li.
- Nhß╗»ng chß║źt tan trong H2O ph├ón li th├Ānh c├Īc ion gß╗Źi l├Ā chß║źt ─æiß╗ćn li.
- Sß╗▒ ─æiß╗ćn li ─æŲ░ß╗Żc biß╗āu diß╗ģn bß║▒ng pt ─æiß╗ćn li: NaCl ŌåÆ Na+ + Cl-
HCl ŌåÆ H+ + Cl-
NaOH ŌåÆ Na+ + OH-
1.2. Ph├ón loß║Īi c├Īc chß║źt ─æiß╗ćn li
1.2.1. Th├Ł nghiß╗ćm
- Tiß║┐n h├Ānh th├Ł nghiß╗ćm vß╗øi chß║źt ─æiß╗ćn li mß║Īnh nhŲ░ dung dß╗ŗch NaOH v├Ā chß║źt ─æiß╗ćn li yß║┐u nhŲ░ CH3COOH
Video 2: T├Łnh dß║½n ─æiß╗ćn cß╗¦a dung dß╗ŗch chß║źt ─æiß╗ćn li mß║Īnh
Video 3: T├Łnh dß║½n ─æiß╗ćn cß╗¦a dung dß╗ŗch chß║źt ─æiß╗ćn li yß║┐u
- Hiß╗ćn tŲ░ß╗Żng: Cß║Ż hai dung dß╗ŗch ─æß╗üu l├Ām b├│ng ─æ├©n ph├Īt s├Īng. B├│ng ─æ├©n ß╗¤ dung dß╗ŗch axit axetic s├Īng mß╗Ø hŲĪn ß╗¤ dung dß╗ŗch NaOH rß║źt nhiß╗üu
- Giß║Żi th├Łch: ß╗¤ c├╣ng nß╗ōng ─æß╗Ö th├¼ NaOH ph├ón li ra ion nhiß╗üu hŲĪn CH3COOH. LŲ░ß╗Żng ion c├Āng nhiß╗üu th├¼ t├Łnh dß║½n ─æiß╗ćn c├Āng t─āng n├¬n b├│ng ─æ├©n ß╗¤ dung dß╗ŗch NaOH s├Īng hŲĪn.
- Nhß║Łn x├®t: Dß╗▒a v├Āo mß╗®c ─æß╗Ö ph├ón li th├Ānh ion cß╗¦a c├Īc chß║źt ─æiß╗ćn li kh├Īc nhau, ngŲ░ß╗Øi ta chia th├Ānh chß║źt ─æiß╗ćn mß║Īnh v├Ā chß║źt ─æiß╗ćn li yß║┐u.
1.2.2. Chß║źt ─æiß╗ćn li mß║Īnh, chß║źt ─æiß╗ćn li yß║┐u
*Chß║źt ─æiß╗ćn li mß║Īnh:
- Kh├Īi niß╗ćm: Chß║źt ─æiß╗ćn li mß║Īnh l├Ā chß║źt khi tan trong nŲ░ß╗øc, c├Īc ph├ón tß╗Ł ho├Ā tan ─æß╗üu ph├ón li ra ion.
- PhŲ░ŲĪng tr├¼nh ─æiß╗ćn li NaCl: (ch├║ ├Į sß╗Ł dß╗źng m┼®i t├¬n mß╗Öt chiß╗üu)
NaCl ŌåÆ Na+ + Cl-
100 ptß╗Ł ŌåÆ 100 ion Na+ v├Ā 100 ion Cl-
- Bao gß╗ōm:
- C├Īc ax├Łt mß║Īnh HCl, HNO3, H2SO4ŌĆ”
- C├Īc bazŲĪ mß║Īnh:NaOH, KOH, Ba(OH)2
- Hß║¦u hß║┐t c├Īc muß╗æi.
- V├Ł dß╗ź: T├Łnh nß╗ōng ─æß╗Ö cß╗¦a ion Na+ v├Ā SO42- trong dung dß╗ŗch muß╗æi Na2SO4 0,1M
Dung dß╗ŗch muß╗æi Na2SO4 l├Ā dung dß╗ŗch chß║źt ─æiß╗ćn li mß║Īnh n├¬n ta c├│ phŲ░ŲĪng tr├¼nh ion nhŲ░ sau:
Na2SO4 ŌåÆ 2Na+ + SO42-
0,1MŌåÆ 0,2M ŌåÆ 0,1 M
Vß║Ły nß╗ōng ─æß╗Ö cß╗¦a ion Na+ l├Ā 0,2M; cß╗¦a ion SO42- l├Ā 0,1M
*Chß║źt ─æiß╗ćn li yß║┐u:
- Kh├Īi niß╗ćm: Chß║źt ─æiß╗ćn li yß║┐u l├Ā chß║źt khi tan trong nŲ░ß╗øc, chß╗ē c├│ 1 phß║¦n sß╗æ ph├ón tß╗Ł ho├Ā tan ph├ón li ra ion, phß║¦n c├▓n lß║Īi vß║½n tß╗ōn tß║Īi dŲ░ß╗øi dß║Īng ph├ón tß╗Ł trong dung dß╗ŗch.
- PhŲ░ŲĪng tr├¼nh ─æiß╗ćn li: (ch├║ ├Į sß╗Ł dß╗źng 2 m┼®i t├¬n ngŲ░ß╗Żc chiß╗üu nhau)
CH3COOH \(\leftrightarrows\) CH3COO- + H+
V├Ł dß╗ź trong dung dß╗ŗch CH3COOH cß╗® 100 ph├ón tß╗Ł h├▓a tan th├¼ c├│ 2 ph├ón tß╗Ł ph├ón li th├Ānh ion, 98 ph├ón tß╗Ł c├▓n lß║Īi kh├┤ng ph├ón li.
- V├Ł dß╗ź:
- C├Īc ax├Łt yß║┐u: H2S, HClO, CH3COOH, HF, H2SO3, HNO2, H3PO4, H2CO3, ...
- BazŲĪ yß║┐u: Mg(OH)2, Bi(OH)3...
- LŲ░u ├Į: Qu├Ī tr├¼nh ph├ón li cß╗¦a chß║źt ─æiß╗ćn li yß║┐u l├Ā qu├Ī tr├¼nh c├ón bß║▒ng ─æß╗Öng, tu├ón theo nguy├¬n l├Ł LŲĪ SatŲĪli├¬.
B├Āi tß║Łp minh hß╗Źa
B├Āi 1:
X├Īc ─æß╗ŗnh chß║źt ─æiß╗ćn li mß║Īnh, ─æiß╗ćn li yß║┐u v├Ā viß║┐t phŲ░ŲĪng tr├¼nh ─æiß╗ćn li cß╗¦a c├Īc chß║źt sau: HNO3, Mg(OH)2, Ba(OH)2, HCl, H2SO4, H2S
HŲ░ß╗øng dß║½n:
- Chß║źt ─æiß╗ćn li mß║Īnh l├Ā: HNO3, Ba(OH)2, HCl, H2SO4
ŌĆŗHNO3 ŌåÆ H+ + NO3-
Ba(OH)2 ŌåÆ Ba2+ + 2OH-
HCl ŌåÆ H+ + Cl-
H2SO4 ŌåÆ 2H+ + SO42-
- Chß║źt ─æiß╗ćn li yß║┐u l├Ā: Mg(OH)2, H2S
Mg(OH)2 l├Ā bazŲĪ ß╗¤ dß║Īng kß║┐t tß╗¦a n├¬n ph├ón li yß║┐u. Mg(OH)2 \(\leftrightarrows\) Mg2+ + 2OH-
H2S l├Ā axit yß║┐u n├¬n ph├ón li c┼®ng yß║┐u theo 2 nß║źc nhŲ░ sau:
H2S \(\leftrightarrows\) H+ + HS-
HS-\(\leftrightarrows\) H+ + S2-
B├Āi 2:
T├Łnh nß╗ōng ─æß╗Ö c├Īc ion trong c├Īc dung dß╗ŗch sau
a. dd NaOH 0,1M b. dd BaCl2 0,2 M c. dd Ba(OH)2 0,1M
HŲ░ß╗øng dß║½n:
a. PhŲ░ŲĪng tr├¼nh ─æiß╗ćn li:
NaOH ŌåÆ Na+ + OH-
0,1M ŌåÆ 0,1M ŌåÆ 0,1 M
Vß║Ły nß╗ōng ─æß╗Ö cß╗¦a ion Na+ v├Ā OH- ─æß╗üu l├Ā 0,1 M
b. PhŲ░ŲĪng tr├¼nh ─æiß╗ćn li:
BaCl2 ŌåÆ Ba2+ + 2Cl-
0,1 M ŌåÆ 0,1 M ŌåÆ 0,2 M
Vß║Ły nß╗ōng ─æß╗Ö cß╗¦a ion Ba2+ l├Ā 0,1M v├Ā ion Cl- l├Ā 0,2M
c. PhŲ░ŲĪng tr├¼nh ─æiß╗ćn li:
Ba(OH)2 ŌåÆ Ba2+ + 2OH-
0,1M ŌåÆ 0,1M ŌåÆ 0,2 M
B├Āi 3:
Mß╗Öt dung dß╗ŗch chß╗®a 0,02 mol Cu2+, 0,03 mol K+, x mol Cl- v├Ā y mol SO42-. Tß╗Ģng khß╗æi lŲ░ß╗Żng muß╗æi tan c├│ trong dung dß╗ŗch l├Ā 5,435 gam. X├Īc ─æß╗ŗnh gi├Ī trß╗ŗ cß╗¦a x v├Ā y
HŲ░ß╗øng dß║½n:
C├Īc ion trong dß╗ŗch tß╗ōn tß║Īi c├╣ng nhau v├¼ gh├®p c├Īc ion kh├┤ng tß║Īo kß║┐t tß╗¦a.
├üp dß╗źng ─æß╗ŗnh luß║Łt bß║Żo to├Ān ─æiß╗ćn t├Łch ta c├│:
(1) 0,02.2 + 0,03.1 = x + 2y
├üp dß╗źng ─æß╗ŗnh luß║Łt bß║Żo to├Ān khß╗æi lŲ░ß╗Żng th├Ānh phß║¦n ta c├│:
(2) 0,02.64 + 0,03.39 + 35,5x + 96.y = 5,435
Kß║┐t hß╗Żp (1) v├Ā (2) ta c├│ hß╗ć phŲ░ŲĪng tr├¼nh:
\(\left\{ \begin{array}{l} x + 2y = 0,07\\ 35,5x + 96y = 2,985 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} x = 0,03(mol)\\ y = 0,02(mol) \end{array} \right.\)
Vß║Ły sß╗æ mol cß╗¦a ion Cl- l├Ā 0,03 mol; sß╗æ mol cß╗¦a ion SO42- l├Ā 0,02 mol
3. Luyß╗ćn tß║Łp B├Āi 1 H├│a hß╗Źc 11
Sau b├Āi hß╗Źc cß║¦n nß║»m:
- R├©n luyß╗ćn khß║Ż n─āng quan s├Īt th├Ł nghiß╗ćm r├║t ra ─æŲ░ß╗Żc kß║┐t luß║Łn vß╗ü t├Łnh dß║½n ─æiß╗ćn cß╗¦a dung dß╗ŗch chß║źt ─æiß╗ćn li
- Ph├ón biß╗ćt ─æŲ░ß╗Żc chß║źt ─æiß╗ćn li, chß║źt kh├┤ng ─æiß╗ćn li, chß║źt ─æiß╗ćn li mß║Īnh, chß║źt ─æiß╗ćn li yß║┐u
- Viß║┐t ─æŲ░ß╗Żc phŲ░ŲĪng tr├¼nh ─æiß╗ćn li cß╗¦a chß║źt ─æiß╗ćn li mß║Īnh, chß║źt ─æiß╗ćn li yß║┐u.
3.1. Trß║»c nghiß╗ćm
B├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 11 B├Āi 1 c├│ phŲ░ŲĪng ph├Īp v├Ā lß╗Øi giß║Żi chi tiß║┐t gi├║p c├Īc em luyß╗ćn tß║Łp v├Ā hiß╗āu b├Āi.
-
- A. C├Īc electron chuyß╗ān ─æß╗Öng tß╗▒ do.
- B. C├Īc cation v├Ā anion chuyß╗ān ─æß╗Öng tß╗▒ do.
- C. C├Īc ion H+ v├Ā OH- chuyß╗ān ─æß╗Öng tß╗▒ do.
- D. C├Īc ion ─æŲ░ß╗Żc gß║»n cß╗æ ─æß╗ŗnh tß║Īi c├Īc n├║t mß║Īng.
-
- A. KCl rắn, khan.
- B. CaCl2 n├│ng chß║Ży.
- C. NaOH n├│ng chß║Ży.
- D. HBr h├▓a tan trong nŲ░ß╗øc.
-
- A. Sß╗▒ ─æiß╗ćn li l├Ā sß╗▒ ho├Ā tan mß╗Öt chß║źt v├Āo nŲ░ß╗øc th├Ānh dung dß╗ŗch.
- B. Sß╗▒ ─æiß╗ćn li l├Ā sß╗▒ ph├ón li mß╗Öt chß║źt dŲ░ß╗øi t├Īc dß╗źng cß╗¦a d├▓ng ─æiß╗ćn.
- C. Sß╗▒ ─æiß╗ćn li l├Ā sß╗▒ ph├ón li mß╗Öt chß║źt th├Ānh ion khi tan trong nŲ░ß╗øc hay ß╗¤ trß║Īng th├Īi n├│ng chß║Ży.
- D. Sß╗▒ ─æiß╗ćn li l├Ā qu├Ī tr├¼nh oxi ho├Ī - khß╗Ł.
-
- A. 3.
- B. 4.
- C. 5.
- D. 2.
-
- A. H+, CH3COO- .
- B. CH3COOH, H+, CH3COO-, H2O.
- C. H+, CH3COO-, H2O.
- D. CH3COOH, CH3COO-, H+.
-
- A. HClO, HNO2, HgCl2, Sn(OH)2.
- B. HClO, HNO2, K3PO4, H2SO4.
- C. HgCl2, Sn(OH)2, NH4Cl, HNO2.
- D. HgCl2, Sn(OH)2, HNO2, H2SO4.
-
- A. a, b, c, f.
- B. a, d, e, f.
- C. b, c, d, e.
- D. a, b, c, e.
C├óu 8-20: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK v├Ā N├óng cao ChŲ░ŲĪng 1 B├Āi 1
B├Āi tß║Łp 1 trang 7 SGK H├│a hß╗Źc 11
B├Āi tß║Łp 2 trang 7 SGK H├│a hß╗Źc 11
B├Āi tß║Łp 3 trang 7 SGK H├│a hß╗Źc 11
B├Āi tß║Łp 4 trang 7 SGK H├│a hß╗Źc 11
B├Āi tß║Łp 5 trang 7 SGK H├│a hß╗Źc 11
B├Āi tß║Łp 1.1 trang 3 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 1.2 trang 3 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 1.3 trang 3 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 1.4 trang 3 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 1.5 trang 3 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 1.6 trang 3 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 1.7 trang 4 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 1 trang 7 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 2 trang 7 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 3 trang 7 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 4 trang 7 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 5 trang 7 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 6 trang 7 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 7 trang 7 SGK H├│a hß╗Źc 11 n├óng cao
4. Hß╗Åi ─æ├Īp vß╗ü B├Āi 1: Sß╗▒ ─æiß╗ćn li
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ bß║źt k├¼ thß║»c mß║»c g├¼, c├Īc em h├Ży ─æß╗ā lß║Īi lß╗Øi nhß║»n ß╗¤ mß╗źc Hß╗Åi ─æ├Īp ─æß╗ā c├╣ng cß╗Öng ─æß╗ōng H├│a HOC247 thß║Żo luß║Łn v├Ā trß║Ż lß╗Øi nh├®.