Hướng dẫn giải bài tập SGK Hóa học 10 Bài 21 Khái quát về nhóm halogen giúp các em học sinh Viết được cấu hình lớp electron ngoài cùng của nguyên tử F, Cl, Br, I. Dự đoán được tính chất hóa học cơ bản của halogen là tính oxi hóa mạnh dựa vào cấu hình lớp electron ngoài cùng và một số tính chất khác của nguyên tử. Viết được các phương trình hóa học chứng minh tính chất oxi hoá mạnh của các nguyên tố halogen, quy luật biến đổi tính chất của các nguyên tố trong nhóm. Tính thể tích hoặc khối lượng dung dịch chất tham gia hoặc tạo thành sau phản ứng.
-
Bài tập 1 trang 96 SGK Hóa học 10
Kim loại nào sau đây tác dụng với dung dịch HCl loãng và tác dụng với khí Cl2 cho cùng loại muối clorua kim loại?
A. Fe.
B. Zn.
C. Cu.
D. Ag.
-
Bài tập 2 trang 96 SGK Hóa học 10
Đặc điểm nào dưới đây không phải là đặc điểm chung của các nguyên tố halogen (F, Cl, Br, I)?
A. Nguyên tử có khả năng thu thêm 1e.
B. Tạo ra hợp chất liên kết cộng hóa trị có cực với hidro.
C. Có số oxi hóa -1 trong mọi trường hợp.
D. Lớp electron ngoài cùng của nguyên tử có 7 electron.
-
Bài tập 3 trang 96 SGK Hóa học 10
Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen (F2, Cl2, Br2, I2)?
A. Ở điều kiện thường là các chất khí.
B. Có tính oxi hóa mạnh.
C. Vừa có tính oxi hóa, vừa có tính khử.
D. Tác dụng mạnh với nước.
-
Bài tập 4 trang 96 SGK Hóa học 10
So sánh những nguyên tố halogen về các mặt sau:
a) Cấu tạo nguyên tử và cấu tạo phân tử.
b) Tính chất vật lí.
c) Tính chất hóa học.
-
Bài tập 5 trang 96 SGK Hóa học 10
Hãy cho biết tính quy luật của sự biến đổi của nhiệt độ nóng chảy nhiệt độ sôi, màu sắc, độ âm điện của nguyên tố halogen.
-
Bài tập 6 trang 96 SGK Hóa học 10
Nêu tính chất hóa học cơ bản của các nguyên tố halogen. Giải thích chiều biến đổi của tính chất hóa học cơ bản đó trong nhóm?
-
Bài tập 7 trang 96 SGK Hóa học 10
Giải thích vì sao các nguyên tố halogen không có ở trạng thái tự do trong tự nhiên?
-
Bài tập 8 trang 96 SGK Hóa học 10
Cho một lượng đơn chất halogen tác dụng với Mg thu được 19g magie halogenua. Cũng lượng đơn chất halogen đó tác dụng với nhôm tạo 17,8g nhôm halogen. Xác định tên và khối lượng đơn chất halogen nói trên.
-
Bài tập 21.1 trang 50 SBT Hóa học 10
Những nguyên tố ở nhóm nào sau đây có cấu hình electron lớp ngoài cùng là ns2np5
A. Nhóm IVA.
B. Nhóm VA.
C. Nhóm VIA.
D. Nhóm VIIA.
-
Bài tập 21.2 trang 50 SBT Hóa học 10
Các nguyên tử halogen đều có
A. 3e ở lớp electron ngoài cùng.
B. 5e ở lớp electron ngoài cùng.
C. 7e ở lớp electron ngoài cùng.
D. 8e ở lớp electron ngoài cùng.
-
Bài tập 21.3 trang 50 SBT Hóa học 10
Đặc điểm nào dưới đây là đặc điểm chung của các nguyên tố halogen (F, Cl, Br, I)
A. Ở điều kiện thường là chất khí
B. Có tính oxi hóa mạnh
C. Vừa có tính oxi hóa, vừa có tính khử
D. Tác dụng mạnh với nước
-
Bài tập 21.4 trang 50 SBT Hóa học 10
Tính chất nào sau đây không phải là tính chất chung của các nguyên tử halogen
A. Nguyên tử có khả năng thu thêm 1 electron
B. Tác dụng với hidro tạo thành hợp chất có liên kết cộng hóa trị có cực
C. Có số oxi hóa -1 trong mọi hợp chất
D. Lớp electron ngoài đều có 7 electron
-
Bài tập 21.5 trang 50 SBT Hóa học 10
Trong các phản ứng hóa học, để chuyển thành anion, nguyên tư của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron
A. nhận thêm 1 electron
B. nhận thêm 2 electron
C. nhường đi 1 electron
D. nhường đi 7 electron
-
Bài tập 21.6 trang 51 SBT Hóa học 10
Xác định các chất trong sơ đồ chuyển hoá sau:
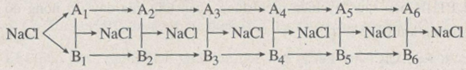
-
Bài tập 21.7 trang 51 SBT Hóa học 10
Một nguyên tố halogen có cấu hình electron lớp ngoài cùng của nguyên tử là 4s24p5
a) Viết cấu hình electron đầy đủ của nguyên tử nguyên tố đó.
b) Cho biết tên, kí hiệu hoá học và cấu tạo phân tử của đơn chất halogen này.
c) Nêu tính hoá học cơ bản của nguyên tố trên.
d) So sánh tính chất hoá học của nguyên tố này với 2 nguyên tố halogen khác đứng trên và dưới nó trong nhóm halogen.
-
Bài tập 21.8 trang 51 SBT Hóa học 10
Viết PTHH của các phản ứng xảy ra khi cho clo và iot lần lượt tác dụng với dung dịch KOH ở nhiệt độ thường. Giải thích vì sao có sự khác nhau ở 2 phản ứng đó.
-
Bài tập 21.9 trang 51 SBT Hóa học 10
Cho 5 gam brom có lẫn tạp chất là clo vào một dung dịch chứa 1,600 gam KBr. Sau phản ứng làm bay hơi dung dịch thì thu được 1,155 gam chất rắn khan. Xác định % về khối lượng của clo trong 5 gam brom đem phản ứng.
-
Bài tập 21.10 trang 51 SBT Hóa học 10
Khi cho 20m3 không khí có chứa khí clo đi qua một ống đựng muối KBr, khối lượng của muối đó giảm bớt 178 mg. Xác định làm lượng của khí clo (mg/m3) trong không khí.
-
Bài tập 21.11 trang 51 SBT Hóa học 10
Có 2 khí không màu, dễ tan trong nước, dung dịch thu được cho tác dụng với dung dịch AgNO3 tạo ra kết tủa màu vàng
a) Cho biết tên 2 khí đó.
b) Hãy phân biệt 2 khí đó bằng phương pháp hoá học.
-
Bài tập 1 trang 119 SGK Hóa học 10 nâng cao
So sánh cấu hình electron nguyên tử của các nguyên tố flo, clo, brom, iot.
-
Bài tập 2 trang 119 SGK Hóa học 10 nâng cao
Các halogen giống nhau như thế nào về tính chất hóa học? Giải thích.
-
Bài tập 3 trang 119 SGK Hóa học 10 nâng cao
Các halogen khác nhau như thế nào về tính chất hóa học? Giải thích.
-
Bài tập 4 trang 119 SGK Hóa học 10 nâng cao
Từ bảng 5.1, hãy nhận xét về sự biến đổi một số đặc điểm sau đây của các halogen:
a) Nhiệt độ nóng chảy
b) Nhiệt độ sôi.
c) Màu sắc.
d) Độ âm điện.
-
Bài tập 5 trang 119 SGK Hóa học 10 nâng cao
Vì sao trong các hợp chất, nguyên tố flo luôn luôn có số oxi hóa âm còn các halogen khác ngoài số oxi hóa âm còn có số oxi hóa dương?
-
Bài tập 6 trang 119 SGK Hóa học 10 nâng cao
Atatin (số hiệu nguyên tử bằng 85) cũng ở nhóm VIIA như các halogen. Hãy dự đoán xem atatin có tính oxi hóa mạnh hơn hay yếu hơn so với iot. Giải thích.






