Bài tập 32.3 trang 75 SBT Hóa học 12
Khử hoàn toàn 0,3 mol một oxit sắt FexOy bằng Al thu được 0,4 mol Al2O3 theo sơ đồ phản ứng sau :
FexOy + Al → Fe + Al2O3
Công thức của oxit sắt là
A. FeO
B. Fe2O3
C. Fe3O4
D. không xác định được
Hướng dẫn giải chi tiết bài 32.5
Đáp án C
-- Mod Hóa Học 12 HỌC247
-


Cho 5,36 g hỗn hợp X gồm FeO ; \(Fe_2O_3\) ; \(Fe_3O_4\) tác dụng với HCl dư . Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y thu dược 3,81 g \(FeCl_2\) và m gam \(FeCl_3\). Giá trị của mlà:
bởi Lê Nhật Minh
 30/01/2021
Theo dõi (0) 1 Trả lời
30/01/2021
Theo dõi (0) 1 Trả lời -


Cho các phát biểu sau: (1) Kim loại sắt có tính nhiễm từ. (2) Trong tự nhiên Crom chỉ tồn tại trong dạng đơn chất.
bởi Vũ Hải Yến
 29/01/2021
29/01/2021
(3) Fe(OH)3 là chất rắn mầu đỏ nâu.
(4) CrO3 là 1 oxit axit Số phát biểu đúng là:
A.4
B.3
C.1
D.2
Theo dõi (0) 1 Trả lời -


Cho m gam hỗn hợp X gồm Fe và Cu vào dung dịch \(H_2SO_4\) loãng dư , kết thúc phản ứng thu được 2,24 lít khí \(H_2\) (dktc). Khối lượng Fe trong m gam X là:
bởi Nguyen Ngoc
 29/01/2021
Theo dõi (0) 1 Trả lời
29/01/2021
Theo dõi (0) 1 Trả lời -


Hỗn hợp X gồm FeO; \(Fe_2O_3 ; Fe_3O_4\) . Cho khí CO đi qua m gam X sau 1 thời gian thu được chất rắn Y và hỗn hợp khí Z. Cho Z vào dung dịch \(Ca(OH)_2\) dư đến hoàn toàn thu được 4 gam kết tủa. Mặt khác hòa tan hoàn toàn Y trong \(H_2SO_4\) đặc nóng dư thu được 1,008 lit \(SO_2\) (sản phẩm khử duy nhất ở dktc) và 18 gam muối. Giá trị của m là:
bởi na na
 29/01/2021
Theo dõi (0) 1 Trả lời
29/01/2021
Theo dõi (0) 1 Trả lời -


Cho m gam hỗn hợp bột X gồm \(Fe_xO_y\), CuO và Cu (x, y nguyên dương) vào 600 ml dung dịch HCl 1M,thu được dung dịch Y (không chứa HCl) và còn lại 6,4 gam kim loại không tan. Cho Y tác dụng với lượng dư dung dịch \(AgNO_3\), thu được 102,3 gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
bởi Nhật Nam
 30/01/2021
Theo dõi (0) 1 Trả lời
30/01/2021
Theo dõi (0) 1 Trả lời -


Cho sơ đồ phản ứng sau: \({(N{H_4})_2}C{r_2}{O_7} \to X \to Y \to \;Z \to T\) Trong đó X, Y, Z, T đều là các hợp chất khác nhau của crom. Chất T là
bởi Lê Văn Duyệt
 30/01/2021
30/01/2021
A. K2Cr2O7.
B. K2CrO4.
C. Cr2(SO4)3.
D. CrSO4.
Theo dõi (0) 1 Trả lời -


Cho m gam bột Fe vào 100 ml dung dịch \(CuSO_4\) 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và 9,2 gam chất rắn Y. Giá trị của m là
bởi Nguyễn Thị Thanh
 29/01/2021
Theo dõi (0) 1 Trả lời
29/01/2021
Theo dõi (0) 1 Trả lời -


Cho phản ứng: \(FeS{\text{ }} + {\text{ }}{H_2}S{O_4} \to F{e_2}{(S{O_4})_3} + {\text{ }}S{O_2} + {\text{ }}{H_2}O\) Sau khi cân bằng phản ứng hoá học trên với hệ số của các chất là những số nguyên dương,tối giản thì tổng hệ số của \({H_2}S{O_4}\) và FeS là
bởi Pham Thi
 29/01/2021
29/01/2021
A. 12.
B. 10.
C. 14.
D. 16
Theo dõi (0) 1 Trả lời -


Nhiệt phân \(Fe(NO_3)_2\) trong môi trường khí trơ. Sau khi các phản ứng xảy ra hoàn toàn, thu được sản phẩm gồm
bởi Nguyễn Thanh Hà
 30/01/2021
30/01/2021
A. FeO, NO2, O2.
B. Fe2O3, NO2, O2.
C. Fe3O4, NO2, O2.
D. Fe, NO2, O2.
Theo dõi (0) 1 Trả lời -


Hòa tan a(gam) Fe vào dung dịch HCl thu được 2,24 l khí (dktc) và dung dịch D. Cô cạn D thu được m(gam) muối khan. Cho lượng muối trên vào 160 ml (\(KMnO_4/ H_2SO_4\)) 0,25M sau phản ứng hoàn toàn thu được V (lit) khí. Giá trị của V?
bởi Phung Meo
 30/01/2021
Theo dõi (0) 1 Trả lời
30/01/2021
Theo dõi (0) 1 Trả lời -


Hòa tan 1 lượng S và 0,01 mol \(Cu_2S\) trong \(HNO_3\) đặc nóng được 1 chất tan duy nhất và sản phẩm khử là \(NO_2\) duy nhất. Hấp thụ hết \(NO_2\) này bằng 200 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thì được m gam chất rắn khan. Giá trị của m là
bởi Truc Ly
 30/01/2021
Theo dõi (0) 1 Trả lời
30/01/2021
Theo dõi (0) 1 Trả lời -


Cho 11,04g hỗn hợp X gồm FeO ; \(Fe_2O_3\); S ; \(FeS_2\) ; CuS trong đó O chiếm 14,5% về khối lượng. Cho X tác dụng vừa đủ với \(H_2SO_4\) đặc nóng sinh ra 0,31 mol \(SO_2\) và dung dịch Y. Nhúng thanh Mg dư vào Y sau khí các phản ứng xảy ra hoàn toàn lấy thanh Mg ra cân lại tăng 2,8g ( giả sử 100% kim loại tạo ra bám hết vào thanh Mg).Đốt hoàn toàn m g X bằng lượng vừa đủ V(lit) (dktc) hỗn hợp A gồm \(O_2\) và \(O_3\) có tỉ khối so với \(H_2\) là 20. Giá trị của V là?
bởi het roi
 30/01/2021
Theo dõi (0) 1 Trả lời
30/01/2021
Theo dõi (0) 1 Trả lời -


Đốt cháy hỗn hợp gồm 2,4g Mg ; 4,48g Fe với hỗn hợp X gồm có \(Cl_2\) và \(O_2\) ; sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua( không có khí dư). Hòa tan Y vào lượng vừa đủ 120 ml HCl 2M thu được dung dịch Z. Cho \(AgNO_3\) dư vào Z thu được 61,01g kết tủa. Phần trăm V của \(O_2\) trong X?
bởi Tay Thu
 30/01/2021
Theo dõi (0) 1 Trả lời
30/01/2021
Theo dõi (0) 1 Trả lời -


Nung nóng hoàn toàn 27,3 gam hỗn hợp \(NaNO_3, Cu(NO_3)_2\). Hỗn hợp khí thoát ra được dãn vào nước dư thì thấy có 1,12 lít khí (đktc) không bị hấp thụ (lượng \(O_2\) hòa tan không đáng kể). Khối lượng \(Cu(NO_3)_2\) trong hỗn hợp ban đầu?
bởi Lan Ha
 30/01/2021
Theo dõi (0) 1 Trả lời
30/01/2021
Theo dõi (0) 1 Trả lời -


Hòa tan 26,64 gam chất tinh thể muối sunfat của kim loại M vào nước được dung dịch X. Cho X tác dụng với dung dịch \(NH_3\) vừa đủ thu được kết tủa Y, nung Y ở nhiệt độ cao đến khối lượng không đổi được 4,08 gam oxit. Mặt khác, cho X tác dụng với dung dịch \(BaCl_2\) dư được 27,96 gam kết tủa. Công thức của tinh thể trên là gì?
bởi Tieu Dong
 29/01/2021
29/01/2021
A: CuSO4.6H2O
B: Fe2(SO4)3.12H2O
C: Al2(SO4)3.24H2O
D: Al2(SO4)3.18H2O
Theo dõi (0) 1 Trả lời -


Oxi hóa chậm m gam Fe ngoài không khí thu được 3 gam hỗn hợp A gồm \(FeO, Fe_3O_4, Fe_2O_3\) và Fe dư. Hóa tan A vừa đủ bởi 200 ml dung dịch \(HNO_3\) thu được 0,56 lít khí NO duy nhất (đktc). Tính m và nồng độ mol/l của dung dịch \(HNO_3\)?
bởi Thu Hang
 30/01/2021
Theo dõi (0) 1 Trả lời
30/01/2021
Theo dõi (0) 1 Trả lời -


Cho m gam Fe tan hết trong 400 ml dung dịch \(FeCl_3\) 1M thu được dung dịch Y. Cô cạn Y thu được 68,92 gam chất rắn khan. Để hòa tan hết m gam Fe trên cần tối thiểu bao nhiêu ml đung dịch hỗn hợp \(H_2SO_4\) 0,2M và \(Fe(NO_3)_3\) 0,025 M (Sản phẩm khử \({N^{ + 5}}\) là NO duy nhất)
bởi Quynh Nhu
 30/01/2021
Theo dõi (0) 1 Trả lời
30/01/2021
Theo dõi (0) 1 Trả lời -


Kết tủa K và L lần lượt là:
bởi khanh nguyen
 29/01/2021
29/01/2021
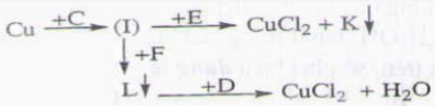
A: Cu(OH)2 và CuO
B: CaCO3 và Ag
C: BaSO4 và Cu(OH)2
D: Fe(OH)2 và CuO
Theo dõi (0) 1 Trả lời
Bài tập SGK khác
Bài tập 32.1 trang 74 SBT Hóa học 12
Bài tập 32.2 trang 74 SBT Hóa học 12
Bài tập 32.4 trang 75 SBT Hóa học 12
Bài tập 32.5 trang 75 SBT Hóa học 12
Bài tập 32.6 trang 75 SBT Hóa học 12
Bài tập 32.7 trang 75 SBT Hóa học 12
Bài tập 32.8 trang 76 SBT Hóa học 12
Bài tập 32.9 trang 76 SBT Hóa học 12
Bài tập 32.10 trang 76 SBT Hóa học 12
Bài tập 32.11 trang 76 SBT Hóa học 12
Bài tập 32.12 trang 76 SBT Hóa học 12
Bài tập 32.13 trang 76 SBT Hóa học 12
Bài tập 32.14 trang 77 SBT Hóa học 12
Bài tập 32.15 trang 77 SBT Hóa học 12
Bài tập 32.16 trang 77 SBT Hóa học 12





