Cùng Hoc247 ôn tập với Một số kỹ thuật làm bài tập nhận biết môn Hóa học 9 năm 2021 với các dạng câu hỏi như: tự luận, trắc nghiệm,...sẽ giúp các em vừa kiểm tra kiến thức trong chương trình Hóa học lớp 9 vừa rèn luyện kỹ năng làm bài. Nội dung chi tiết tham khảo tại đây!
A. PHƯƠNG PHÁP CHUNG
*Cách trình bày bài tập nhận biết:
Bước 1: Trích mẫu thử (Đánh số thứ tự tương ứng)
Bước 2: Chọn thuốc thử để nhận biết (Tùy theo yêu cầu của đề bài: thuốc thử không giới hạn, có giới hạn hay không dùng thuốc thử nào khác)
Bước 3: Cho thuốc thử vào mẫu thử, trình bày hiện tượng quan sát được (mô tả hiện tượng xảy ra) rút ra kết luận đã nhận biết được chất nào.
Bước 4: Viết phương trình phản ứng xảy ra khi nhận biết để minh họa.
*Một số chú ý:
- Khi nhận biết một chất khí bất kỳ, ta dẫn khí đó lội qua dung dịch hoặc sục khí đó vào dung dịch, hay dẫn khí đó qua chất rắn rồi nung … không làm ngược lại.
-Dạng toán nhận biết có giới hạn thuốc thử: Dạng bài tập này dùng thuốc thử đã cho nhận biết được một trong vài chất cần nhận biết. Sau đó dùng lọ vừa tìm được cho phản ứng với các lọ còn lại để nhận biết các chất cần tìm.
-Dạng toán nhận biết không được dùng bất kì thuốc thử nào khác: Dạng bài tập này bắt buộc phải lấy lần lượt từng lọ cho phản ứng với các lọ còn lại. Để tiện so sánh, ta nên kẻ bảng phản ứng. Khi ấy ứng với mỗi lọ sẽ có những hiện tượng phản ứng khác nhau. Đây chính là cơ sở để phân biệt từng lọ.
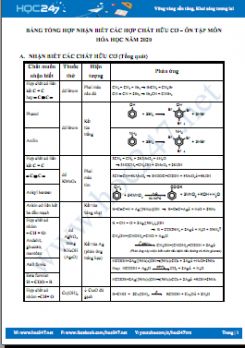
B. MỘT SỐ THUỐC THỬ DÙNG ĐỂ NHẬN BIẾT CÁC HỢP CHẤT VÔ CƠ THÔNG DỤNG
|
Chất |
Thuốc thử |
Hiện tượng |
Phương trình phản ứng |
|
|
KIM LOẠI |
Li K Na Ca Ba |
Đốt cháy |
Li cho ngọn lửa đỏ tía |
|
|
K cho ngọn lửa tím |
||||
|
Na cho ngọn lửa vàng |
||||
|
Ca cho ngọn lửa đỏ da cam |
||||
|
Ba cho ngọn lửa vàng lục |
||||
|
H2O |
Tạo thành dung dịch + H2 (Với Ca→ dd đục) |
M + nH2O → M(OH)n + n/2H2 |
||
|
Be Zn Al |
dd kiềm |
Tan + H2 |
M +(4-n)OH- + (n-2)H2O → MO2n-4 + n/2H2 |
|
|
Kloại từ Mg→ Pb |
dd axit (HCl) |
Tan + H2 (Pb có ↓ PbCl2 màu trắng) |
M + nHCl → MCln +n/2H2 |
|
|
Cu |
HCl/H2SO4 loãng có sục O2 |
Tan + dung dịch màu xanh |
2Cu + O2 + 4HCl → 2CuCl2 + 2H2O |
|
|
Đốt trong O2 |
Màu đỏ → màu đen |
2Cu + O2 → 2CuO |
||
|
Ag |
HNO3đ/t0 sau đó cho NaCl vào dung dịch |
Tan + NO2 nâu đỏ + trắng |
Ag + 2HNO3đ → AgNO3 + NO2 + H2O AgNO3+ NaCl → AgCl + NaNO3 |
|
|
PHI KIM |
I2 |
Hồ tinh bột |
Màu xanh |
|
|
S |
Đốt trong O2 |
khí SO2 mùi hắc |
S + O2 → SO2 |
|
|
P |
Đốt trong O2 và hòa tan sản phẩm vào H2O |
Dung dịch tạo thành làm quỳ tím hóa đỏ |
4P + O2 → 2P2O5 P2O5 + 3H2O → 2H3PO4 (Dung dịch H3PO4 làm đỏ quỳ tím) |
|
|
C |
Đốt trong O2 |
CO2 làm đục nước vôi trong |
C + O2 → CO2 CO2 + Ca(OH)2 → CaCO3 + H2O |
|
|
KHÍ VÀ HƠI |
Cl2 |
Nước Br2 |
Nhạt màu |
5Cl2 + Br2 + 6H2O → 10HCl + 2HBrO3 |
|
dd KI + hồ tinh bột |
Không màu → màu xanh |
Cl2 + 2KI → 2KCl + I2 Hồ tinh bột → màu xanh |
||
|
O2 |
Tàn đóm |
Tàn đóm bùng cháy |
||
|
Cu, t0 |
Cu màu đỏ → màu đen |
2Cu + O2 → 2CuO |
||
|
H2 |
Đốt,làm lạnh |
Hơi nước ngưng tụ |
2H2 + O2 → 2H2O |
|
|
CuO, t0 |
Hóa đỏ |
CuO + H2 → Cu + H2O |
||
|
H2O (hơi) |
CuSO4 khan |
Trắng → xanh |
CuSO4 + 5H2O → CuSO4.5H2O |
|
|
CO |
CuO |
Đen → đỏ |
CuO + CO → Cu + CO2 |
|
|
dd PdCl2 |
↓ Pd vàng |
CO + PdCl2 + H2O → Pd↓ +2HCl + CO2 |
||
|
Đốt trong O2 rồi dẫn sản phẩm cháy qua dd nước vôi trong |
Dung dịch nước vôi trong vẩn đục |
2CO + O2 → 2CO2 CO2 + Ca(OH)2 →CaCO3↓ + H2O |
||
|
CO2 |
dd nước vôi trong |
Dung dịch nước vôi trong vẩn đục |
CO2 + Ca(OH)2 →CaCO3 ↓+ H2O |
|
|
SO2 |
nước Br2 |
Nhạt màu |
SO2 + Br2 + 2H2O →H2SO4 + 2HBr |
|
|
dd thuốc tím |
Nhạt màu |
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4 |
||
|
Dung dịch H2S |
Tạo bột màu vàng |
SO2 + 2 H2S → 3S↓ + 2 H2O |
||
|
Dung dịch I2 |
Nhạt màu vàng của dung dịch I2 |
SO2 + I2 + 2 H2O → H2SO4 + 2HI |
||
|
Dung dịch Ca(OH)2 dư |
Làm cho nước vôi trong bị vẩn đục |
SO2 + Ca(OH)2 → CaSO3↓ + H2O |
||
|
SO3 |
Dd BaCl2 |
BaSO4 ↓ trắng |
BaCl2 + H2O + SO3 →BaSO↓+ 2HCl |
|
|
H2S |
mùi |
Trứng thối |
||
|
Dd Pb(NO3)2 |
PbS↓ đen |
Pb(NO3)2 +H2S →PbS↓ + 2HNO3 |
||
|
HCl |
Quỳ tím ẩm |
Hóa đỏ |
||
|
NH3 |
Khói trắng |
NH3 + HCl → NH4Cl |
||
|
NH3 |
Quỳ tím ẩm |
Hóa xanh |
||
|
HCl |
Khói trắng |
NH3 + HCl → NH4Cl |
||
|
NO |
Không khí |
Hóa nâu |
2NO + O2 →2 NO2 |
|
|
NO2 |
Quỳ tim ẩm |
Hóa đỏ |
||
|
Làm lạnh |
Màu nâu → không màu |
2NO2 → N2O4 |
||
|
N2 |
Que đóm cháy |
Tắt |
||
|
DUNG DỊCH |
Axit:HCl |
Quỳ tím |
Hóa đỏ |
|
|
Muối cacbonat; sunfit, sunfua, kim loại đứng trước H |
Có khí CO2, SO2, H2S, H2 |
2HCl + CaCO3 →CaCl2 + CO2 ↑+ H2O 2HCl + CaSO3 →CaCl2 + SO2↑+ H2O 2HCl + FeS → FeCl2 + H2S↑ 2HCl + Zn → ZnCl2 + H2↑ |
||
|
Axit HCl đặc |
MnO2 |
Khí Cl2 màu vàng lục bay lên |
4HCl + MnO2 → MnCl2 +Cl2↑ +2H2O |
|
|
Axit H2SO4 loãng |
Quỳ tím |
Hóa đỏ |
||
|
Muối cacbonat; sunfit, sunfua, kim loại đứng trước H Dung dịch muối của Ba. |
Có khí CO2, SO2, H2S, H2,
Tạo kết tủa trắng. |
H2SO4 + Na2CO3 → 2Na2SO4 + CO2↑ + H2O H2SO4 + CaSO3 → CaSO4 + SO2↑ + H2O H2SO4 + FeS → FeSO4 + H2S↑ H2SO4 + Zn → ZnSO4 + H2↑ |
||
|
Axit HNO3, H2SO4 đặc nóng |
Hầu hết các kim loại (trừ Au, Pt) |
Có khí thoát ra |
4HNO3(đ) + Cu → Cu(NO3)2 + 2NO↑ + 2H2O Cu +2H2SO4(đ, nóng) → CuSO4 + 2SO2↑ + 2H2O |
|
|
Dung dịch Bazơ |
Quỳ tím |
Hóa xanh |
||
|
Dung dịch phenol phtalein |
Hóa hồng |
|||
|
Muối sunfat |
Dd muối Ba2+ |
↓trắng BaSO4 |
BaCl2 + Na2SO4 →BaSO4↓+ 2NaCl |
|
|
Muối clorua |
Dd AgNO3 |
↓trắng AgCl |
AgNO3 + NaCl→AgCl↓+ NaNO3 |
|
|
Muối photphat |
↓vàng Ag3PO4 |
3AgNO3 +Na3PO4→Ag3PO4↓+3NaNO3 |
||
|
Muối cacbonat, sunfit |
Dd axit |
CO2, SO2 |
CaCO3 + 2HCl →CaCl2 + CO2 ↑+ H2O CaSO3 + 2HCl →CaCl2 + SO2↑ + H2O |
|
|
Muối hiđrocacbonat |
Dd axit |
CO2 |
NaHCO3 + HCl →NaCl + CO2↑+ H2O |
|
|
Muối hiđrosunfit |
Dd axit |
SO2 |
NaHSO3 + HCl →NaCl + SO2↑ + H2O |
|
|
Muối Magie |
Dung dịch kiềm NaOH, KOH |
Kết tủa trắng Mg(OH)2 không tan trong kiềm dư |
MgCl2 + 2KOH →Mg(OH)2↓ + 2KCl |
|
|
Muối đồng |
Kết tủa xanh lam : Cu(OH)2 |
CuCl2 + 2NaOH →Cu(OH)2↓ + 2NaCl |
||
|
Muối Sắt (II) |
Kết tủa trắng xanh : Fe(OH)2 |
FeCl2 + 2KOH →Fe(OH)2↓ + 2KCl |
||
|
Muối Sắt (III) |
Kết tủa nâu đỏ : Fe(OH)3 |
FeCl3 + 3KOH →Fe(OH)3↓+ 3KCl |
||
|
Muối Nhôm |
Kết tủa keo trắng Al(OH)3 tan trong kiềm dư |
AlCl3 + 3NaOH →Al(OH)3↓ + 3NaCl Al(OH)3 + NaOH →NaAlO2 + 2H2O |
||
|
Muối Natri |
Lửa đèn khí |
Ngọn lửa màu vàng |
||
|
Muối Kaki |
Ngọn lửa màu tím |
|||
|
OXIT Ở THỂ RẮN |
Na2O K2O BaO CaO |
H2O |
dd làm xanh quỳ tím (CaO tạo ra dung dịch đục) |
Na2O + H2O → 2NaOH |
|
P2O5 |
H2O |
dd làm đỏ quỳ tím |
P2O5 + 3H2O → 2H3PO4 |
|
|
SiO2 |
Dd HF |
tan tạo SiF4↑ |
SiO2 + 4HF → SiF4↑ +2H2O |
|
|
Al2O3, ZnO |
kiềm |
dd không màu |
Al2O3 + 2NaOH →2NaAlO2 + H2O ZnO + 2NaOH →Na2ZnO2 + H2O |
|
|
CuO |
Axit |
dd màu xanh |
CuO + 2HCl → CuCl2 + H2O |
|
|
MnO2 |
HCl đun nóng |
Cl2 màu vàng |
4HCl + MnO2→ MnCl2 +Cl2 +2H2O |
|
|
Ag2O |
HCl đun nóng |
AgCl ↓ trắng |
Ag2O + 2HCl →2AgCl↓ + H2O |
|
|
FeO, Fe3O4 |
HNO3 đặc |
NO2 màu nâu |
FeO + 4HNO3 → Fe(NO3)3 + NO2↑ + 2H2O Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2↑+ 5H2O |
|
|
Fe2O3 |
HNO3 đặc |
tạo dd màu nâu đỏ, không có khí thoát ra |
Fe2O3 + 6HNO3 →2Fe(NO3)3 + 3H2O |
C. CÁC DẠNG BÀI TOÁN THƯỜNG GẶP
Bài 1: Trong phòng thí nghiệm có 8 lọ hóa chất mất nhãn đựng riêng biệt các dung dịch sau: NaCl, NaNO3, MgCl2, Mg(NO3)2, AlCl3, Al(NO3)3, CuCl2, Cu(NO3)2. bằng phương pháp hóa học hãy nhận biết mỗi dung dịch? Viết phương trình phản ứng xẩy ra và ghi rõ điều kiện của phản ứng (nếu có).
Hướng dẫn giải
* Đánh sô thứ tự các lọ hóa chất mất nhãn, lấy ra một lượng nhỏ vào các ống nghiệm (mẫu A) để làm thí nghiệm, các ống nghiệm này cũng được đánh số theo thứ tự các lọ:
- Cho dd AgNO3 lần lựơt vào mỗi ống nghiệm (mẫu A). Nếu thấy kết tủa trắng nhận ra các dd muối clorua:
Kết tủa trắng → các dd NaCl, MgCl2, AlCl3, CuCl2
→ Mẫu A
Không có hiện tượng phản ứng các dd NaNO3. Mg(NO3)2, Al(NO3)3, Cu(NO3)2
- Cho dd NaOH dư vào lần lượt các muối clorua:
+ Nhận ra MgCl2 do tạo kết tủa trắng Mg(OH)2 MgCl2 + 2NaOH → Mg(OH)2 trắng + 2NaCl
+ Không có hiện tượng phản ứng nhận ra NaCl
+ Thấy kết tủa xanh nhận ra CuCl2 CuCl2 + 2NaOH → Cu(OH)2 xanh + 2NaCl
+ Thấy kết tủa, kết tủa tan trong NaOH dư nhận ra AlCl3
AlCl3 + 3NaOH → Al(OH)3 keo trắng + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
- Nhận ra các dd muối nitrat cũng làm tượng tự như vậy.
Bài 2 : Có các khí CH4, C2H4, SO2, SO3, CO2, CO được đựng trong các bình không ghi nhãn, hãy trình bày phương pháp hóa học để phân biệt các khí trên.
Hướng dẫn giải
Ta nhận biết các khí:
- Khí tạo được kết tủa với dung dịch BaCl2 là SO3
BaCl2 + H2O + SO3 → BaSO4 trắng + 2HCl
- Khí tạo ra kết tủa vàng với dung dịch H2S là SO2
SO2 + 2 H2S → 3S vàng + 2 H2O
- Khí làm mất màu nước brom là C2H4
C2H4 + Br2 → C2H4Br2
- Khí làm đục nước vôi trong là CO2:
CO2 + Ca(OH)2 → CaCO3 + H2O
- Khí CH4 cháy được, dẫn sản phẩm cháy qua bình đựng CuSO4 khan (màu trắng) thì thấy xuất hiện màu xanh (CuSO4.5H2O):
CH4 + 2O2 → CO2 + 2H2O
5H2O + CuSO4 (Trắng) → CuSO4.5H2O (Xanh)
- Khí CO cháy được, sản phẩm cháy không làm CuSO4 khan chuyển sang màu xanh (do không có nước sinh ra).
Bài 3:
a) Có 6 dung dịch đựng trong 6 lọ riêng biệt bị mất nhãn KOH, FeCl3, MgSO4, NH4Cl, BaCl2, FeSO4. Chỉ được dùng thêm một hóa chất khác để làm thuốc thử , hãy nhận ra từng dung dịch trên. Viết các phương trình phản ứng xảy ra.
b) Có dung dịch FeSO4 lẫn tạp chất CuSO4. Làm thế nào để loại bỏ tạp chất bằng phương pháp hóa học?
Hướng dẫn giải
a) Trích mỗi dung dịch cần nhận biết một ít để làm mẫu thử cho các lần thí nghiệm. Thuốc thử tự chọn là quỳ tím.
- Mẫu thử làm quỳ tím→ xanh → dung dịch KOH
- Dùng dung dịch KOH vừa nhận biết được để nhận biết các mẫu thử còn lại. Mẫu thử nào xuất hiện khí không màu, mùi khai là dung dịch NH4Cl:
- Mẫu thử nào xuất hiện kết tủa trắng là dung dịch MgSO4
- Mẫu thử nào xuất hiện kết tủa màu nâu đỏ là dung dịch FeCl3
- Mẫu thử nào xuất hiện kết tủa màu trắng xanh, để lâu trong không khí chuyển thành kết tủa màu nâu đỏ là dung dịch FeSO4
-Mẫu thử nào không thấy có hiện tượng gì là dung dịch BaCl2
b) Cho bột Fe dư vào hỗn hợp , Fe sẽ khử hết ion Cu2+ thành kim loại Cu.
Sau đó lọc, loại bỏ phần chất rắn không tan, nước lọc là dung dịch FeSO4 tinh khiết.
Bài 4: Chỉ dùng quỳ tím hãy nhận biết các dung dịch riêng biệt đựng trong các lọ mất nhãn sau: KCl, BaCl2, NH4HSO4, Ba(OH)2, HCl, H2SO4.
Hướng dẫn giải
* Cho quỳ tím vào các mẫu thử.
- Mẫu thử nào làm quỳ tím chuyển sang màu xanh là: Ba(OH)2.
- Mẫu thử nào làm quỳ tím chuyển sang màu đỏ là: NH4HSO4, HCl, H2SO4 (nhóm I).
- Mẫu thử nào làm quỳ tím không đổi màu là: BaCl2, KCl (nhóm II).
* Cho Ba(OH)2 mới nhận biết được vào các dung dịch nhóm I:
- Dung dịch có khí thoát ra và kết tủa trắng là NH4HSO4:
Ba(OH)2 + NH4HSO4 → BaSO4 trắng + NH3 + 2H2O
- Dung dịch có kết tủa trắng là H2SO4:
Ba(OH)2 + H2SO4 → BaSO4 trắng + 2H2O
- Dung dịch còn lại là HCl.
* Cho H2SO4 mới nhận biết được vào các dung dịch nhóm II:
- Dung dịch có kết tủa trắng là BaCl2:
H2SO4 + BaCl2 → BaSO4 trắng + 2HCl
- Dung dịch còn lại là KCl.
Bài 5: Có 5 lọ hóa chất khác nhau, mỗi lọ chứa một dung dịch của một trong các hóa chất sau: NaOH, HCl, H2SO4, BaCl2, Na2SO4. Chỉ được dùng thêm phenolphtalein ( với các điều kiện và dụng cụ thí nghiệm có đủ). Hãy trình bày phương pháp hóa học nhận ra 5 hóa chất trên và viết các phương trình phản ứng xảy ra (nếu có).
Hướng dẫn giải
- Lấy một lượng vừa đủ mỗi mẫu hóa chất cho vào các ống nghiệm riêng biệt rồi đánh số thứ tự.
- Nhỏ từ từ dung dịch phenolphtalein vào các ống nghiệm chứa các hóa chất nói trên,
+ Nếu ống nghiệm nào hóa chất làm phenolphtalein từ không màu chuyển màu hồng là NaOH
+ Ống nghiệm còn lại không có hiện tượng gì là HCl, H2SO4, BaCl2 và Na2SO4.
- Nhỏ từ từ và lần lượt vài giọt dung dịch có màu hồng ở trên vào 4 ống nghiệm còn lại.
+ Ống nghiệm nào làm mất màu hồng là các dung dịch axit HCl và H2SO4. ( Nhóm I)
+ Ống nghiệm nào không làm mất màu hồng là dung dịch muối BaCl2 và Na2SO4. ( Nhóm II).
NaOH + HCl → NaCl + H2O
2NaOH + H2SO4 → Na2SO4 + H2O
- Nhỏ một vài giọi dung dịch của một dung dịch ở nhóm I và hai ống nghiệm chứa dung dịch nhóm II
+ Nếu không có hiện tượng gì thì hóa chất đó là HCl. Chất còn lại của nhóm I là H2SO4. Nhỏ dung dịch H2SO4 vào hai ống nghiệm chứa hóa chất nhóm II
- Nếu thấy ống nghiệm nào kết tủa trắng thì ống nghiệm đó chứa dung dịch BaCl2.
- Ống nghiệm còn lại không có hiện tượng gì đó là hóa chất Na2SO4
+ Nếu thấy ống nghiệm nào có kết tủa ngay thì dung dịch ở nhóm I là hóa chất H2SO4, ống nghiệm gây kết tủa BaCl2, ống nghiệm còn lại không gây kết tủa chứa hóa chất Na2SO4. Hóa chất còn lại ở nhóm I là HCl.
H2SO4 + BaCl2 → BaSO4 trắng + 2HCl
Trên đây là trích dẫn một phần tài liệu một số kỹ thuật làm bài tập nhận biết môn Hóa học 9 năm 2021, để theo dõi nội dung đầy đủ, chi tiết vui lòng đăng nhập vào hệ thống hoc247.net chọn chức năng xem online hoặc tải về máy!
Ngoài ra các em học sinh có thể tham khảo thêm một số tài liệu tại đây:
Chúc các em học tập thật tốt!