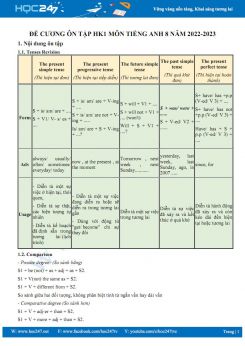
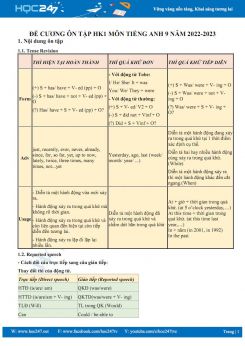
─Éß╗ü cŲ░ŲĪng ├┤n tß║Łp HK1 m├┤n H├│a hß╗Źc 9 n─ām hß╗Źc 2022-2023 t├│m tß║»t to├Ān bß╗Ö l├Į thuyß║┐t v├Ā c├Īc b├Āi tß║Łp H├│a hß╗Źc 9 hß╗Źc k├¼ 1 sau ─æ├óy sß║Į gi├║p c├Īc em hß╗Źc sinh ├┤n tß║Łp v├Ā r├©n luyß╗ćn k─® n─āng giß║Żi ─æß╗ü, chuß║®n bß╗ŗ cho k├¼ thi HK1 sß║»p tß╗øi. Ch├║c c├Īc em hß╗Źc tß║Łp tß╗æt!
1. T├ōM Tß║«T L├Ø THUYß║ŠT
1.1. D├Ży hoß║Īt ─æß╗Öng h├│a hß╗Źc cß╗¦a kim loß║Īi
Theo chiß╗üu giß║Żm dß║¦n ─æß╗Ö hoß║Īt ─æß╗Öng cß╗¦a kim loß║Īi:
Li, K, Ba, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Ag, Hg, Pt, Au
L├║c kh├│ b├Ā cß║¦n n├Āng may ├Īo gi├Īp sß║»t n├¬n sang phß╗æ h├Āng ─æß╗ōng ├Ī hiß╗ću phi ├óu.
├Ø ngh─®a d├Ży hoß║Īt ─æß╗Öng h├│a hß╗Źc cß╗¦a kim loß║Īi
- Mß╗®c ─æß╗Ö hß╗Źat ─æß╗Öng h├│a hß╗Źc cß╗¦a kim loß║Īi giß║Żm dß║¦n tß╗½ tr├Īi qua phß║Żi.
- Kim loß║Īi ─æß╗®ng trŲ░ß╗øc Mg (5 kim loß║Īi ─æß║¦u ti├¬n) t├Īc dß╗źng vß╗øi nŲ░ß╗øc ß╗¤ ─æiß╗üu kiß╗ćn thŲ░ß╗Øng ├Ā kiß╗üm v├Ā kh├Ł hi─æro.
- Kim loß║Īi ─æß╗®ng trŲ░ß╗øc H phß║Żn ß╗®ng vß╗øi mß╗Öt sß╗æ dd axit (HCl, H2SO4 lo├Żng, ŌĆ”) ├Ā kh├Ł H2.
- Kim loß║Īi ─æß╗®ng trŲ░ß╗øc ─æß║®y kim loß║Īi ─æß╗®ng sau ra khß╗Åi dung dß╗ŗch muß╗æi (trß╗½ 5 kim loß║Īi ─æß║¦u ti├¬n).
1.2. T├Łnh tan trong nŲ░ß╗øc cß╗¦a mß╗Öt sß╗æ dung dß╗ŗch bazŲĪ, muß╗æi
|
BazŲĪ tan (kiß╗üm) |
KOH, NaOH, Ba(OH)2, Ca(OH)2 ├Łt tan. |
|
BazŲĪ kh├┤ng tan |
Mg(OH)2, Fe(OH)2, Fe(OH)3, Zn(OH)2, Cu(OH)2, Al(OH)3, Pb(OH)2 |
|
Muối Sunfat (=SO4) |
Hß║¦u hß║┐t tan (trß╗½ BaSO4, PbSO4 kh├┤ng tan). |
|
Muối Sunfit (=SO3) |
Hß║¦u hß║┐t kh├┤ng tan (trß╗½ K2SO3 , Na2SO3 tan). |
|
Muối K,Na, Nitrat (-NO3) |
Tß║źt cß║Ż ─æß╗üu tan. |
|
Muối Photphat (ºPO4) |
Hß║¦u hß║┐t kh├┤ng tan (trß╗½ K3PO4 , Na3PO4 tan ). |
|
Muối Cacbonat (=CO3) |
Hß║¦u hß║┐t kh├┤ng tan (trß╗½ K2CO3 , Na2CO3 tan). |
|
Muối Clorua (-Cl ) |
Hß║¦u hß║┐t ─æß╗üu tan (trß╗½ AgCl kh├┤ng tan). |
1.3. H├│a trß╗ŗ cß╗¦a mß╗Öt sß╗æ nguy├¬n tß╗æ v├Ā nh├│m nguy├¬n tß╗Ł
|
H├│a trß╗ŗ (I) |
H├│a trß╗ŗ (II) |
H├│a trß╗ŗ (III) |
|
|
Kim loß║Īi |
Na, K, Ag |
Ca , Ba , Mg , Zn, Fe, Cu |
Al, Fe |
|
Nh├│m nguy├¬n tß╗Ł |
┬Ł┬Ł-NO3 ; (OH) (I) |
=CO3 ; =SO3 ; =SO4 |
PO4 |
|
Phi kim |
Cl , H , F |
O |
C├Īc phi kim kh├Īc:
S (IV,VI ) ; C (IV) ; N (V) ; P (V).
1.4. C├Īc loß║Īi hß╗Żp chß║źt v├┤ cŲĪ
a. Oxit
Oxit l├Ā hß╗Żp chß║źt gß╗ōm 2 nguy├¬n tß╗æ, trong ─æ├│ c├│ mß╗Öt nguy├¬n tß╗æ l├Ā oxi.
V├Ł dß╗ź: CaO, SO2, CO, Na2O, Fe3O4, P2O5, ŌĆ”
b. Axit
Axit l├Ā hß╗Żp chß║źt m├Ā ph├ón tß╗Ł gß╗ōm c├│ mß╗Öt hay nhiß╗üu nguy├¬n tß╗Ł H li├¬n kß║┐t vß╗øi gß╗æc axit. C├Īc nguy├¬n tß╗Ł H n├Āy c├│ thß╗ā thay thß║┐ bß║▒ng c├Īc ng/tß╗Ł kim loß║Īi.
V├Ł dß╗ź: Vd: HCl, HNO3, H2SO4, H3PO4, ŌĆ”
c. BazŲĪ
BazŲĪ l├Ā hß╗Żp chß║źt m├Ā ph├ón tß╗Ł gß╗ōm c├│ mß╗Öt nguy├¬n tß╗Ł kim loß║Īi li├¬n kß║┐t vß╗øi mß╗Öt hay nhiß╗üu nh├│m hi─æroxit (OH).
V├Ł dß╗ź: Vd: KOH, NaOH, Ba(OH)2┬Ł, Al(OH)3, ŌĆ”
d. Muối
- Muß╗æi l├Ā hß╗Żp chß║źt m├Ā ph├ón tß╗Ł gß╗ōm hay nhiß╗üu nguy├¬n tß╗Ł kim loß║Īi li├¬n kß║┐t vß╗øi mß╗Öt hay nhiß╗üu gß╗æc axit
- C├┤ng thß╗®c h├│a hß╗Źc cß╗¦a muß╗æi gß╗ōm hai phß║¦n: kim loß║Īi v├Ā gß╗æc axit
V├Ł dß╗ź: NaCl, MgSO4, Fe(NO3)2, BaCO3, ŌĆ”
e. Kim loß║Īi
T├Łnh chß║źt vß║Łt l├Į:
- C├│ t├Łnh dß║╗o (dß╗ģ d├Īt mß╗Ång v├Ā dß╗ģ k├®o sß╗Żi)
- Dß║½n ─æiß╗ćn v├Ā dß║½n nhiß╗ćt tß╗æt. (Ag l├Ā kim loß║Īi dß║½n ─æiß╗ćn v├Ā dß║½n nhiß╗ćt tß╗æt nhß║źt, tiß║┐p theo l├Ā Cu, Al, Fe, ŌĆ”)
- C├│ ├Īnh kim.
T├Łnh chß║źt h├│a hß╗Źc:
LŲ░u ├Į: Kim loß║Īi ─æß╗®ng trŲ░ß╗øc H (trong d├Ży hoß║Īt ─æß╗Öng h├│a hß╗Źc cß╗¦a kim loß║Īi) t├Īc dß╗źng vß╗øi mß╗Öt sß╗æ axit (nhŲ░ HCl, H2SO4┬Ł lo├Żng. . .) tß║Īo th├Ānh muß╗æi v├Ā giß║Żi ph├│ng H2
Kim loß║Īi ─æß╗®ng trŲ░ß╗øc (trß╗½ 5 kim loß║Īi ─æß║¦u ti├¬n) ─æß║®y kim loß║Īi ─æß╗®ng sau (trong d├Ży H─ÉHH cß╗¦a kim loß║Īi) ra khß╗Åi dung dß╗ŗch muß╗æi.
f. Phi kim
- ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng, phi kim tß╗ōn tß║Īi ß╗¤ cß║Ż 3 trß║Īng th├Īi: rß║»n (S, P, I2 ...) ; lß╗Ång (Br2) ; kh├Ł (Cl2, O2, N2, H2, ...).
- Phß║¦n lß╗øn c├Īc nguy├¬n tß╗æ phi kim kh├┤ng c├│ ├Īnh kim, dß║½n ─æiß╗ćn, dß║½n nhiß╗ćt k├®m; Nhiß╗ćt ─æß╗Ö n├│ng chß║Ży thß║źp.
- Mß╗Öt sß╗æ phi kim ─æß╗Öc nhŲ░: Cl2, Br2, I2.
- Mß╗®c ─æß╗Ö hoß║Īt ─æß╗Öng h├│a hß╗Źc cß╗¦a phi kim:
+ Mß╗®c ─æß╗Ö hoß║Īt ─æß╗Öng h├│a hß╗Źc mß║Īnh hay yß║┐u cß╗¦a phi kim thŲ░ß╗Øng ─æŲ░ß╗Żc x├®t c─ān cß╗® v├Āo khß║Ż n─āng v├Ā mß╗®c ─æß╗Ö phß║Żn ß╗®ng cß╗¦a phi kim ─æ├│ vß╗øi kim loß║Īi v├Ā hi─æro.
+ Flo, oxi, clo l├Ā nhß╗»ng phi kim hoß║Īt ─æß╗Öng mß║Īnh (flo l├Ā phi kim hoß║Īt ─æß╗Öng mß║Īnh nhß║źt).
+ LŲ░u huß╗│nh, photpho, cacbon, silic l├Ā nhß╗»ng phi kim hoß║Īt ─æß╗Öng yß║┐u hŲĪn.
2. B├ĆI Tß║¼P
C├óu 1: D├Ży chß║źt gß╗ōm c├Īc oxit bazŲĪ l├Ā:
A. CuO, NO, MgO, CaO.
B. CuO, CaO, MgO, Na2O.
C. CaO, CO2, K2O, Na2O.
D. K2O, FeO, P2O5, Mn2O7.
C├óu 2: Chß║źt n├Āo sau ─æ├óy g├│p phß║¦n nhiß╗üu nhß║źt v├Āo sß╗▒ h├¼nh th├Ānh mŲ░a axit ?
A . CO2
B. SO2
C. N2
D. O3
C├óu 3: Cho 0,1 mol kim loß║Īi kß║Įm v├Āo dung dß╗ŗch HCl dŲ░. Khß╗æi lŲ░ß╗Żng muß╗æi thu ─æŲ░ß╗Żc l├Ā:
A. 20,4
B. 1,36 g
C. 13,6 g
D. 27,2 g
C├óu 4: Phß║Żn ß╗®ng n├Āo dŲ░ß╗øi ─æ├óy l├Ā phß║Żn ß╗®ng trao ─æß╗Ģi ?
A. 2Na + 2H2O ŌåÆ 2NaOH + H2
B. BaO + H2O ŌåÆ Ba(OH)2
C. Zn + H2SO4 ŌåÆ ZnSO4 + H2
D. BaCl2 + H2SO4 ŌåÆ BaSO4 + 2HCl
C├óu 5: Khi thß║Ż mß╗Öt c├óy ─æinh sß║»t sß║Īch v├Āo dung dß╗ŗch CuSO4 lo├Żng, c├│ hiß╗ćn tŲ░ß╗Żng sau:
A. Sß╗¦i bß╗Źt kh├Ł, m├Āu xanh cß╗¦a dung dß╗ŗch nhß║Īt dß║¦n.
B. C├│ mß╗Öt lß╗øp ─æß╗ōng m├Āu ─æß╗Å phß╗¦ l├¬n ─æinh sß║»t, m├Āu xanh cß╗¦a dung dß╗ŗch ─æß║Łm dß║¦n.
C. C├│ mß╗Öt lß╗øp ─æß╗ōng m├Āu ─æß╗Å phß╗¦ l├¬n ─æinh sß║»t, dung dß╗ŗch kh├┤ng ─æß╗Ģi m├Āu.
D. C├│ mß╗Öt lß╗øp ─æß╗ōng m├Āu ─æß╗Å phß╗¦ l├¬n ─æinh sß║»t, m├Āu xanh cß╗¦a dung dß╗ŗch nhß║Īt dß║¦n
C├óu 6: C├│ mß╗Öt mß║½u Fe bß╗ŗ lß║½n tß║Īp chß║źt l├Ā nh├┤m, ─æß╗ā l├Ām sß║Īch mß║½u sß║»t n├Āy bß║▒ng c├Īch ng├óm n├│ vß╗øi:
A. Dung dß╗ŗch NaOH dŲ░
B. Dung dß╗ŗch H2SO4 lo├Żng
C. Dung dß╗ŗch HCl dŲ░
D. Dung dß╗ŗch HNO3 lo├Żng
C├óu 7: D├Ży phi kim t├Īc dß╗źng vß╗øi oxi tß║Īo th├Ānh oxit axit l├Ā:
A. S, C, P.
B. S, C, Cl2.
C. C, P, Br2.
D. C, Cl2, Br2.
C├óu 8. H├▓a tan 23,5 gam K2O v├Āo nŲ░ß╗øc. Sau ─æ├│ d├╣ng 250ml dung dß╗ŗch HCl ─æß╗ā trung h├▓a dung dß╗ŗch tr├¬n. T├Łnh nß╗ōng ─æß╗Ö mol HCl cß║¦n d├╣ng.
A. 1,5M
B. 2,0M
C. 2,5 M
D. 3,0 M
C├óu 9. Kh├Ł lŲ░u huß╗│nh ─æioxit SO2 ─æŲ░ß╗Żc tß║Īo th├Ānh tß╗½ cß║Ęp chß║źt l├Ā
A. K2SO4 v├Ā HCl.
B. K2SO4 v├Ā NaCl.
C. Na2SO4 v├Ā CuCl2
D. Na2SO3 v├Ā H2SO4
C├óu 10. Dung dß╗ŗch cß╗¦a chß║źt X c├│ pH > 7 v├Ā khi t├Īc dß╗źng vß╗øi dung dß╗ŗch kali sunfat tß║Īo ra chß║źt kh├┤ng tan. Chß║źt X l├Ā.
A. BaCl2
B. NaOH
C. Ba(OH)2
D. H2SO4.
C├óu 11. Nhß╗Å mß╗Öt giß╗Źt quß╗│ t├Łm v├Āo dung dß╗ŗch KOH, dung dß╗ŗch c├│ m├Āu xanh; nhß╗Å tß╗½ tß╗½ dung dß╗ŗch H2SO4 cho tß╗øi dŲ░, v├Āo dung dß╗ŗch c├│ m├Āu xanh tr├¬n th├¼.
A. M├Āu xanh vß║½n kh├┤ng thay ─æß╗Ģi.
B. M├Āu xanh nhß║Īt dß║¦n rß╗ōi mß║źt hß║│n.
C. M├Āu xanh nhß║Īt dß║¦n rß╗ōi mß║źt hß║│n, rß╗ōi chuyß╗ān sanh m├Āu ─æß╗Å
D. M├Āu xanh ─æß║Łm th├¬m dß║¦n.
C├óu 12. ─Éß╗ā ph├ón biß╗ćt 3 g├│i bß╗Öt: Fe, Cu v├Ā Al c├│ thß╗ā d├╣ng c├Īc dung dß╗ŗch
A. NaOH v├Ā FeCl2
B. HCl v├Ā CuCl2
C. Ca(OH)2 v├Ā NaCl
D. HCl v├Ā NaOH
C├óu 13. C├│ nhß╗»ng chß║źt kh├Ł sau: CO2; H2; O2; SO2; CO. Khi n├Āo l├Ām ─æß╗źc nŲ░ß╗øc v├┤i trong .
A. CO2
B. CO2; CO; H2
C. CO2 ; SO2
D. CO2; CO; O2
C├óu 14. CaO phß║Żn ß╗®ng ─æŲ░ß╗Żc vß╗øi tß║źt cß║Ż c├Īc chß║źt trong d├Ży
A. NaOH; CaO; H2O
B. CaO; K2SO4; Ca(OH)2
C. H2O; Na2O; BaCl2
D.CO2; H2O; HCl
C├óu 15. Kh├Ł CO t├Īc dß╗źng ─æŲ░ß╗Żc vß╗øi tß║źt cß║Ż c├Īc chß║źt trong d├Ży n├Āo sau ─æ├óy?
A. Fe2O3, CuO, O2, PbO
B. CuO, CaO, C, O2
C. Al2O3, C, O2, PbO
D. Fe2O3, Al2O3, CaO, O2
ĐÁP ÁN
|
1B |
2B |
3C |
4D |
5D |
6A |
7A |
8B |
9D |
10C |
|
11C |
12A |
13C |
14D |
15A |
16C |
17 |
18A |
19D |
20B |
|
21A |
22D |
23B |
24A |
25B |
26B |
27A |
28D |
29D |
30C |
|
31A |
33C |
33A |
34B |
35A |
36C |
37A |
38A |
39D |
40C |
Tr├¬n ─æ├óy l├Ā mß╗Öt phß║¦n tr├Łch ─æoß║Īn nß╗Öi dung ─Éß╗ü cŲ░ŲĪng ├┤n tß║Łp HK1 m├┤n H├│a hß╗Źc 9 n─ām hß╗Źc 2022-2023. ─Éß╗ā xem to├Ān bß╗Ö nß╗Öi dung c├Īc em chß╗Źn chß╗®c n─āng xem online hoß║Ęc ─æ─āng nhß║Łp v├Āo trang hoc247.net ─æß╗ā tß║Żi t├Āi liß╗ću vß╗ü m├Īy t├Łnh.
Mß╗Øi c├Īc em tham khß║Żo t├Āi liß╗ću c├│ li├¬n quan:
- ─Éß╗ü cŲ░ŲĪng ├┤n tß║Łp HK1 m├┤n Vß║Łt l├Ł 9 n─ām 2022-2023
- ─Éß╗ü cŲ░ŲĪng ├┤n tß║Łp HK1 m├┤n Tin hß╗Źc 9 n─ām 2022-2023
Hy vß╗Źng t├Āi liß╗ću n├Āy sß║Į gi├║p c├Īc em hß╗Źc sinh ├┤n tß║Łp tß╗æt v├Ā ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp.
T├Āi liß╗ću li├¬n quan
TŲ░ liß╗ću nß╗Ģi bß║Łt tuß║¦n
- Xem thêm