HỌC247 xin giới thiệu đến các em Phân loại các chất vô cơ, tính chất của kim loại – phi kim môn Hóa học 9 năm 2021. Tài liệu được biên soạn nhằm giúp các em tự luyện tập với các câu hỏi lý thuyết đa dạng, ôn tập lại các kiến thức cần nắm một cách hiệu quả, chuẩn bị thật tốt cho các kỳ thi sắp tới. Mời các em cùng tham khảo.
1. KIẾN THỨC CƠ BẢN
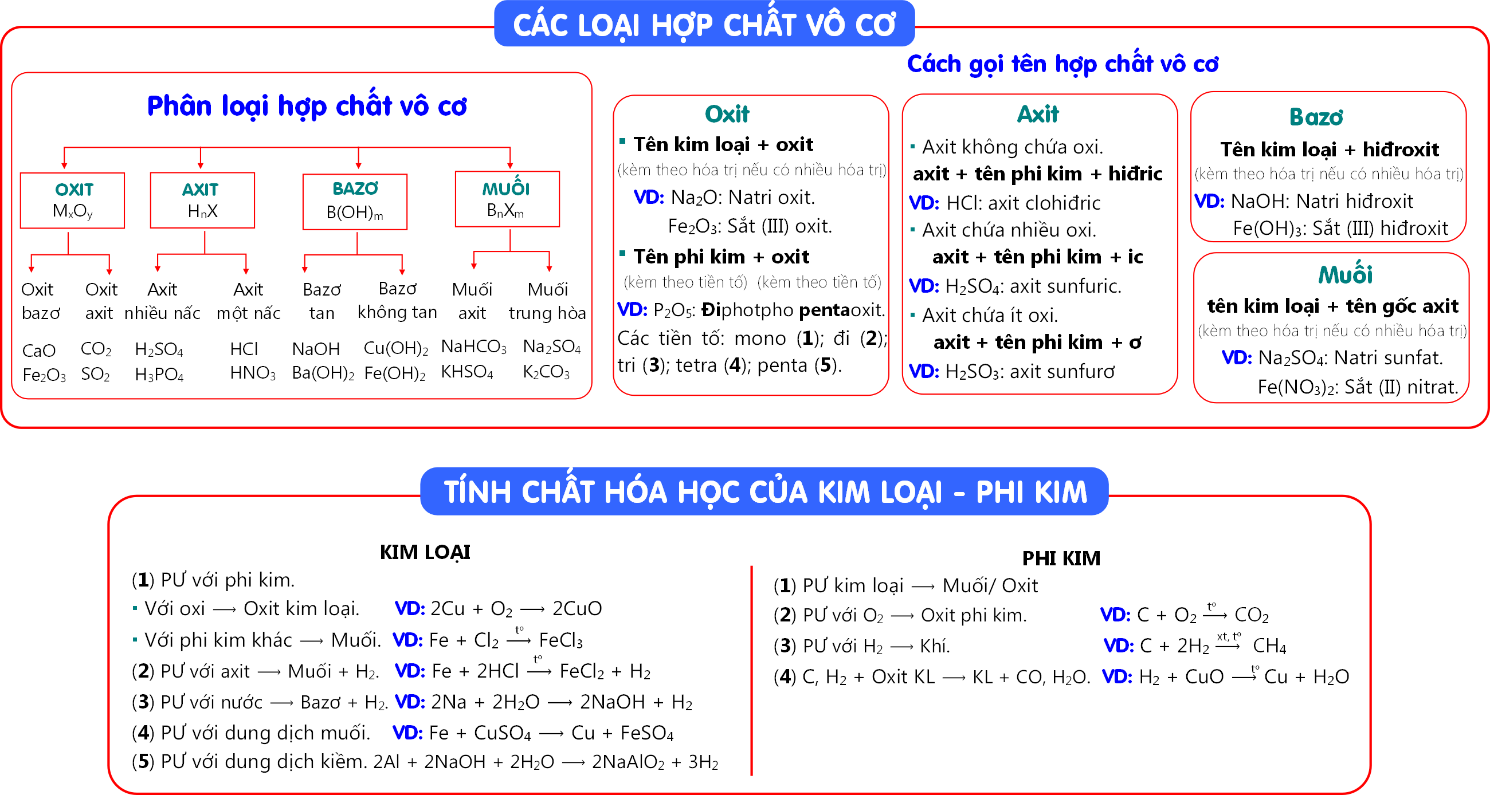
- Một số gốc axit: -Cl (clorua); -Br (bromua); -NO3 (nitrat); -NO2 (nitrit); =CO3 (cacbonat); -HCO3 (hiđrocacbonat); =SO4 (sunfat); -HSO4 (hiđrosunfat); =SO3 (sunfit); -HSO3 (hiđrosunfit); ≡PO4 (photphat); =HPO4 (hiđrophotphat); -H2PO4 (đihiđrophotphat).
2. VÍ DỤ MINH HỌA
Câu 1: Hoàn thành bảng sau:
|
Tên |
Công thức |
Loại hợp chất (oxit axit, oxit bazơ, axit, bazơ, muối) |
Phân tử khối (KLPT) |
|
Natri sunfat |
|
|
|
|
Magie oxit |
|
|
|
|
Bạc nitrat |
|
|
|
|
Lưu huỳnh trioxit oxit |
|
|
|
|
Sắt (III) sunfat |
|
|
|
|
Magie bromua |
|
|
|
|
Cacbon đioxit |
|
|
|
|
Chì nitrat |
|
|
|
|
Nhôm sunfat |
|
|
|
|
Natri cacbonat |
|
|
|
|
Kali photphat |
|
|
|
|
Bari hiđrocacbonat |
|
|
|
|
Natri hiđrophotphat |
|
|
|
|
Bari đihiđrophotphat |
|
|
|
|
Natri hiđrosunfat |
|
|
|
|
Kẽm clorua |
|
|
|
|
Natri sunfit |
|
|
|
|
Kali hiđrosunfit |
|
|
|
|
Đồng (II) sunfua |
|
|
|
|
Magie hiđroxit |
|
|
|
|
Sắt (III) hiđroxit |
|
|
|
|
Thủy ngân (II) sunfua |
|
|
|
|
Axit sunfuric |
|
|
|
|
Axit photphoric |
|
|
|
|
Axit clohiđric |
|
|
|
|
Sắt(III) oxit |
|
|
|
|
Kẽm hiđroxit |
|
|
|
|
Kali nitrit |
|
|
|
|
Bạc oxit |
|
|
|
|
Nhôm photphat |
|
|
|
|
Bạc photphat |
|
|
|
|
Nitơ đioxit |
|
|
|
|
Sắt (II) clorua |
|
|
|
|
Natri clorua |
|
|
|
|
Sắt(II) sunfua |
|
|
|
|
|
PbSO4 |
|
|
|
|
K2HPO4 |
|
|
|
|
Ba(NO3)2 |
|
|
|
|
NaNO2 |
|
|
|
|
Ca(HCO3)2 |
|
|
|
|
KHSO4 |
|
|
|
|
FeO |
|
|
|
|
K2O |
|
|
|
|
SO2 |
|
|
|
|
HBr |
|
|
|
|
Fe(OH)2 |
|
|
Câu 2: Cho Fe, Al và S lần lượt phản ứng với O2, H2, HCl, NaOH, CuSO4. Hãy viết các phương trình phản ứng xảy ra.
Câu 3: Hoàn thành chuỗi phản ứng sau:
(a) Ca → CaO → Ca(OH)2 → CaCO3 → CO2
(b) S → SO2 → SO3 → H2SO4 → FeSO4
Câu 4: Cho 11,2 gam Fe phản ứng với lượng dư dung dịch H2SO4, sau phản ứng thu được dung dịch X và V lít khí H2 (ở đktc).
(a) Viết PTPƯ xảy ra.
(b) Tính V.
(c) Cô cạn dung dịch X thu được m gam muối khan. Tính m.
Câu 5: Cho m gam Mg phản ứng với 100 gam dung dịch HCl dư, sau phản ứng thu được dung dịch Y và 11,2 lít khí H2 (ở đktc).
(a) Viết PTPƯ và tính m.
(b) Tính nồng độ C% của muối có trong dung dịch Y.
Câu 6: Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng dư được dung dịch A. Cho một lượng bột sắt vừa đủ vào dung dịch A, đến khi phản ứng kết thúc thu được dung dịch B. Cho dung dịch B tác dụng với dung dịch KOH dư, được dung dịch D và kết tủa E. Nung E trong không khí ở nhiệt độ cao đến khi khối lượng không đổi, được chất rắn F. Thổi một luồng khí CO qua ống sứ nung nóng chứa F cho đến dư, được chất rắn G và khí X. Sục khí X vào dung dịch Ba(OH)2 thì thu được kết tủa Y và dung dịch C. Loại bỏ kết tủa Y, đun nóng dung dịch C lại tạo ra kết tủa Y. Viết các phương trình phản ứng và xác định A, B, D, E, F, G, X, Y và C.
3. BÀI TẬP TỰ LUYỆN
Câu 7: Cho các chất sau: BaO, Na2SO4, SO2, H2SO3, Fe2O3, P2O5, Mg(OH)2, HCl, Fe(OH)2, KCl, KHSO4.
(a) Phân loại các hợp chất trên thành oxit axit, oxit bazơ, axit, bazơ và muối.
(b) Gọi tên các hợp chất vừa phân loại.
Câu 8: Viết công thức hóa học của những chất có tên sau đây:
Canxi oxit:………… Lưu huỳnh đioxit: ………… Sắt (III) hiđroxit: …………
Axit sunfuric: ………… Kẽm nitrat: ………… Magie cacbonat: …………
Câu 9: Hoàn thành các PTPƯ sau (nếu có):
a. Al + O2 →
b. Cu + S →
c. Fe + Cl2 →
d. Al + NaOH + H2O →
e. Cu + H2SO4 (loãng) →
g. Na + H2O →
h. Mg + H2O →
i. Fe + CuCl2 →
k. C + O2 →
l. S + H2 →
m. FeCl2 + Cl2 →
n. Fe2O3 + H2 (dư) →
Câu 10: Hòa tan hoàn toàn m gam Zn bằng 100 ml dung dịch H2SO4 2M, sau phản ứng thu được dung dịch X và V lít khí H2 (ở đktc).
(a) Viết PTPƯ xảy ra.
(b) Tính m và V.
(c) Tính nồng độ C% của muối có trong dung dịch X biết dung dịch H2SO4 ban đầu có D = 1,2 gam/ml.
Trên đây là phần trích dẫn nội dung Phân loại các chất vô cơ, tính chất của kim loại – phi kim môn Hóa học 9 năm 2021, để xem toàn bộ nội dung chi tiết, mời các bạn cùng quý thầy cô vui lòng đăng nhập để tải về máy.
Chúc các em đạt điểm số thật cao trong kì thi sắp đến!













