Bài tập 36.2 trang 45 SBT Hóa học 9
Đốt cháy hoàn toàn 11,2 lít hỗn hợp khí gồm CH4 và H2 ở đktc thu được 16,2 gam H2O.
a) Viết các phương trình hoá học.
b) Tính thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp.
c) Tính thể tích khí CO2 tạo ra ở đktc.
Hướng dẫn giải chi tiết bài 36.2
a) Các phương trình hóa học:
CH4 + 2O2 to→ CO2 + 2H2O
2H2 + O2 to→ 2H2O
Gọi x là số mol của CH4 ⇒ VCH4 = n.22,4 = 22,4x
y là số mol của H2 ⇒ VH2 = 22,4y
Vhh = VH2 + VCH4 ⇒ 22,4x + 22,4y = 11,2
nH2O = m/M = 16,2/18 = 0,9 mol
Phương trình hóa học :
CH4 + 2O2 to→ CO2 + 2H2O
2H2 + O2 to→ 2H2O
nH2O = 2x + y = 0,9
Từ (1) và (2), ta có hệ phương trình:
22,4x + 22,4y = 11,2 và 2x + y = 0,9
Giải hệ phương trình ta có: x = 0,4 (mol); y= 0,1 (mol)
VCH4 = 22,4x = 22,4.0,4 = 8,96 lít
%VCH4 = 8,96/11,2 x 100% = 80%; VH2 = 100% - 80% = 20%
c) nCO2 = 0,4mol
Thể tích của khí CO2: VCO2 = 0,4.22,4 = 8,96 lít
-- Mod Hóa Học 9 HỌC247
-


Khi đốt cháy hoàn toàn 0,5 mol metan người ta thu được một lượng khí \(C{O_2}\) (đktc) có thể tích là?
bởi Meo Thi
 26/01/2021
Theo dõi (0) 1 Trả lời
26/01/2021
Theo dõi (0) 1 Trả lời -


Thành phần phần trăm về khối lượng của các nguyên tố cacbon và hiđro trong \(C{H_4}\) lần lượt là?
bởi Hương Lan
 26/01/2021
Theo dõi (0) 1 Trả lời
26/01/2021
Theo dõi (0) 1 Trả lời -


Cho các chất sau: \(C{H_4},{\text{ }}C{l_2},{\text{ }}{H_2},{\text{ }}{O_2}\). Có mấy cặp chất có thể tác dụng với nhau từng đôi một ?
bởi Bao Chau
 26/01/2021
Theo dõi (0) 1 Trả lời
26/01/2021
Theo dõi (0) 1 Trả lời -


A. Dẫn hỗn hợp qua nước vôi trong dư.
B. Đốt cháy hỗn hợp rồi dẫn qua nước vôi trong.
C. Dẫn hỗn hợp qua bình đựng dung dịch H2SO4.
D. Dẫn hỗn hợp qua bình đựng dung dịch brom dư.
Theo dõi (0) 1 Trả lời -


Đốt cháy hợp chất hữu cơ nào sau đây thu được số mol \(C{O_2}\) nhỏ hơn số mol \({H_2}O\)?
bởi can tu
 25/01/2021
Theo dõi (0) 1 Trả lời
25/01/2021
Theo dõi (0) 1 Trả lời -


Phản ứng hóa học đặc trưng của metan là gì?
bởi Lê Nguyễn Hạ Anh
 25/01/2021
Theo dõi (0) 1 Trả lời
25/01/2021
Theo dõi (0) 1 Trả lời -


Cho các chất sau: \({H_2}O,{\text{ }}HCl,{\text{ }}C{l_2},{\text{ }}{O_2},{\text{ }}C{O_2}\). Khí metan phản ứng được với
bởi Huong Hoa Hồng
 26/01/2021
26/01/2021
A. H2O, HCl.
B. Cl2, O2.
C. HCl, Cl2.
D. O2, CO2.
Theo dõi (0) 1 Trả lời -


Đốt cháy khí metan bằng khí oxi. Nếu hỗn hợp nổ mạnh thì tỉ lệ thể tích của khí metan và khí oxi là?
bởi Nhật Mai
 26/01/2021
26/01/2021
A. 1 thể tích khí metan và 3 thể tích khí oxi.
B. 2 thể tích khí metan và 1 thể tích khí oxi.
C. 1 thể tích khí metan và 2 thể tích khí oxi.
D. 3 thể tích khí metan và 2 thể tích oxi.
Theo dõi (0) 1 Trả lời -


A. CO2
B. Na
C. C
D. CH4
Theo dõi (0) 1 Trả lời -


Tính chất vật lí cơ bản của metan là
bởi Anh Trần
 25/01/2021
25/01/2021
A. chất lỏng, không màu, tan nhiều trong nước.
B. chất khí, màu vàng lục, tan nhiều trong nước.
C. chất khí, không màu, mùi xốc, nặng hơn không khí, ít tan trong nước.
D. chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
Theo dõi (0) 1 Trả lời -


 Theo dõi (1) 0 Trả lời
Theo dõi (1) 0 Trả lời -


 Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


Metan có nhiều trong?
bởi Levan Tan
 12/06/2020
12/06/2020
Metan có nhiều trong
Theo dõi (0) 1 Trả lời -


Chất nào tác dụng với metan viết phương trình?
bởi Yến Nhi
 08/06/2020
Chất nào tác dụng với metan, etilen, rượu etylic, axit axetic viết phương trình
08/06/2020
Chất nào tác dụng với metan, etilen, rượu etylic, axit axetic viết phương trình Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


Để biết phản ứng: CH4 + Cl2 → CH3Cl + HCl (ánh sáng) đã xảy ra hay chưa người ta?
bởi Ánh tuyết
 20/05/2020
20/05/2020
A. kiểm tra sản phẩm phản ứng bằng quỳ tím ẩm, quỳ tím hóa đỏ tức phản ứng đã xảy ra.
B. chỉ cần cho thể tích CH4 bằng thể tích Cl2.
C. kiểm tra thể tích hỗn hợp khí, nếu có phản ứng xảy ra thì thể tích hỗn hợp tăng.
D. có thể kiểm tra clo, nếu clo còn tức phản nwgs chưa xảy ra.
Theo dõi (0) 2 Trả lời -


Tính phần trăm thể tích mỗi khí trong hỗn hợp X?
bởi Nguyễn Thành An
 17/05/2020
Dẫn 4,48 lít (đktc) hỗn hợp X gồm Metan và Etilen đi qua đựng bình dung dịch Brom dư. Sau phản ứng, thấy khối lượng bình đựng dung dịch Brom tăng 1,4 gam.a)Tính phần trăm thể tích mỗi khí trong hỗn hợp X.b)Tính thể tích không khí cần dùng để đốt cháy hoàn toàn hỗn hợp khí trên, biết Oxi chiếm 20% thể tích không khí.Giúp mình với mình cảm ơn❤❤❤❤❤Theo dõi (0) 0 Trả lời
17/05/2020
Dẫn 4,48 lít (đktc) hỗn hợp X gồm Metan và Etilen đi qua đựng bình dung dịch Brom dư. Sau phản ứng, thấy khối lượng bình đựng dung dịch Brom tăng 1,4 gam.a)Tính phần trăm thể tích mỗi khí trong hỗn hợp X.b)Tính thể tích không khí cần dùng để đốt cháy hoàn toàn hỗn hợp khí trên, biết Oxi chiếm 20% thể tích không khí.Giúp mình với mình cảm ơn❤❤❤❤❤Theo dõi (0) 0 Trả lời -


Viết PTHH của phản ứng?
bởi Hoàng Thị Ngọc
 10/05/2020
.
10/05/2020
. Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


Khi đốt hoàn toàn 3.36 lít khí metan (đktc). Hãy tính khí oxit cần dùng và thể tích khí cacbonic tạo thành? (các khí đo ở đktc)
bởi Hồ Sỹ Quốc Trung
 08/05/2020
không biết làm!!Theo dõi (0) 2 Trả lời
08/05/2020
không biết làm!!Theo dõi (0) 2 Trả lời -


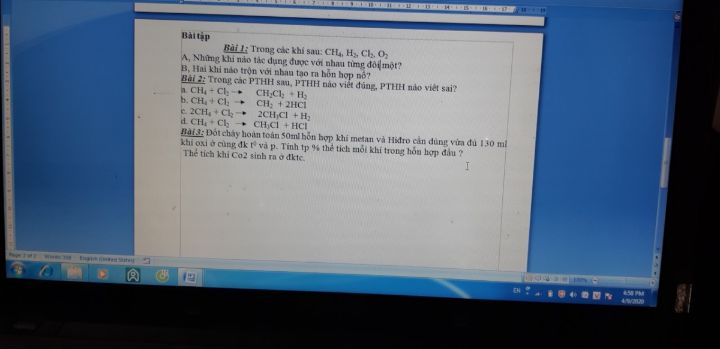 Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời





