Nội dung bài học giúp học sinh nắm bắt sự sắp xếp các electron trong vỏ nguyên tử của các nguyên tố như thế nào? Cách viết cấu hình electron nguyên tử, đặc điểm của electron lớp ngoài cùng
Tóm tắt lý thuyết
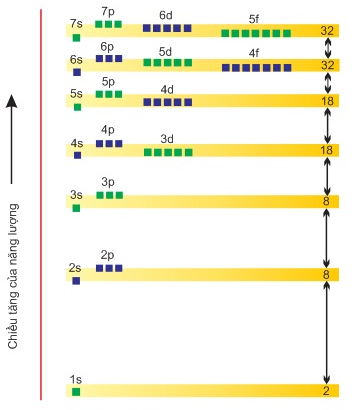
1.1. Thứ tự các mức năng lượng của nguyên tử
Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s…
Hình 1: Sơ đồ phân bố các mức năng lượng của các lớp và phân lớp
1.2. Cấu hình electron của nguyên tử
1.2.1. Cấu hình electron
- Cấu hình e biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
- Cách viết cấu hình e như sau:
- Bước 1: Xác định số electron của nguyên tử
- Bước 2: Phân bố các electron theo thứ tự mức năng lượng ( 1s 2s 2p 3s 3p 4s 3d 4p 5s…) và tuân theo quy tắc sau: phân lớp s chứa tối đa 2 electron, phân lớp p chứa tối đa 6e, phân lớp d chứa tối đa 10 electron, phân lớp f chứa tối đa 14 e.
- Qui ước cách viết cấu hình e:
- Số thứ tự của lớp được viết bằng các số (1,2,3,...)
- Phân lớp được kí hiệu bằng các chữ cái thường: s p d f
- Số e viết trên kí hiệu của các phân lớp như số mũ (s2, p6)
- Ví dụ:
- H (Z=1): 1s1 g H là nguyên tố s
- Li (Z = 3): 122 2s1 g Li là nguyên tố s
- Cl (Z=17): 1s2 2s2 2p6 3s2 3p5 g Cl là nguyên tố p
- Fe (Z = 26): 1s2 2s2 2p6 3s23p6 4s2 3d6 g Fe là nguyên tố d hay 1s2 2s2 2p6 3s23p6 3d6 4s2
- Ghi chú:
- Nguyên tố s: e cuối cùng điền vào phân lớp s.
- Nguyên tố p: e cuối cùng điền vào phân lớp p
- Nguyên tố d: e cuối cùng điền vào phân lớp d
1.2.2. Cấu hình electron của 20 nguyên tố đầu tiên
|
Z |
Kí hiệu |
Cấu hình electron |
|
1 |
H |
1s1 |
|
2 |
He |
1s2 |
|
3 |
Li |
1s22s1 |
|
4 |
Be |
1s22s2 |
|
5 |
B |
1s22s22p1 |
|
6 |
C |
1s22s22p2 |
|
7 |
N |
1s22s22p3 |
|
8 |
O |
1s22s22p4 |
|
9 |
F |
1s22s22p5 |
|
10 |
Ne |
1s22s22p6 |
|
11 |
Na |
1s22s22p6 3s1 |
|
12 |
Mg |
1s22s22p6 3s2 |
|
13 |
Al |
1s22s22p6 3s2 3p1 |
|
14 |
Si |
1s22s22p6 3s2 3p2 |
|
15 |
P |
1s22s22p6 3s2 3p3 |
|
16 |
S |
1s22s22p6 3s2 3p4 |
|
17 |
Cl |
1s22s22p6 3s2 3p5 |
|
18 |
Ar |
1s22s22p6 3s2 3p6 |
|
19 |
K |
1s22s22p6 3s2 3p6 4s1 |
|
20 |
Ca |
1s22s22p6 3s2 3p6 4s2 |
1.2.3. Đặc điểm của lớp electron ngoài cùng
- Nguyên tử của tất cả các nguyên tố có tối đa 8 e lớp ngoài cùng.
|
Số e lớp ngoài cùng |
Tính chất |
|
*1, 2, 3 e *4 e *5, 6, 7 e *8 e (trừ He) |
*kim loại (trừ H, He, B) *kim loại hoặc PK *phi kim *khí hiếm (khí trơ) |
- Ví dụ:
-
Na (Z=11): 1s2 2s2 2p6 3s1(kim loại)
-
Cl (Z=17): 1s2 2s2 2p6 3s2 3p5(phi kim)
-
Ar (Z=18): 1s2 2s2 2p6 3s23p6(khí hiếm)
-
Bài tập minh họa
Bài 1:
Hãy viết cấu hình electron của các nguyên tố có Z = 20, Z = 21, Z = 22,
Z = 24, Z = 29 và cho nhận xét cấu hình electron của các nguyên tố đó khác nhau như thế nào ?
Hướng dẫn:
Cấu hình electron của các nguyên tố có :
- Z = 20 : 1s2 2s2 2p6 3s2 3p6 4s2
- Z = 21 : 1s2 2s2 2p6 3s2 3p6 3d14s2
- Z = 22 : 1s2 2s2 2p6 3s2 3p6 3d2 4s2
- Z = 24 : 1s2 2s2 2p6 3s2 3p6 3d5 4s1
- Z = 29 : 1s2 2s2 2p6 3s2 3p6 3d10 4s1
Nhận xét:
- Cấu hình Z =20 khác với các cấu hình còn lại ở chỗ không có phân lớp 3d.
- Cấu hình Z =24 và Z = 29 có 1 electron ở phân lớp 4s.
Bài 2:
Nguyên tử Fe có Z = 26. Hãy viết cấu hình elctron của Fe.
Nếu nguyên tử Fe bị mất hai electron, mất ba electron thì các cấu hình electron tương ứng sẽ như thế nào ?
Hướng dẫn:
Fe (Z = 26) : 1s2 2s2 2p6 3s2 3p63d6 4s2
Fe2+ (Z = 26) : 1s2 2s2 2p6 3s2 3p63d6
Fe3+ (Z = 26) : 1s2 2s2 2p6 3s2 3p63d5
3. Luyện tập Bài 5 Hóa học 10
Sau bài học cần nắm:
- Sự sắp xếp các electron trong vỏ nguyên tử của các nguyên tố như thế nào?
- Cách viết cấu hình electron nguyên tử, đặc điểm của electron lớp ngoài cùng
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 5 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. s
- B. p
- C. d
- D. f
-
- A. Khi tham gia phản ứng R vừa có tính oxi hóa, vừa có tính khử.
- B. Số oxi hóa cao nhất của R trong hợp chất là +6.
- C. Hợp chất khí của R với hidro có tính khử mạnh.
- D. R ở chu kì 2 nhóm VIA.
-
- A. 7.
- B. 6.
- C. 5.
- D. 8.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao Chương 1 Bài 5
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 5.
Bài tập 1 trang 27 SGK Hóa học 10
Bài tập 2 trang 27 SGK Hóa học 10
Bài tập 3 trang 28 SGK Hóa học 10
Bài tập 4 trang 28 SGK Hóa học 10
Bài tập 5 trang 28 SGK Hóa học 10
Bài tập 6 trang 28 SGK Hóa học 10
Bài tập 5.1 trang 11 SBT Hóa học 10
Bài tập 5.2 trang 12 SBT Hóa học 10
Bài tập 5.3 trang 12 SBT Hóa học 10
Bài tập 5.4 trang 12 SBT Hóa học 10
Bài tập 5.5 trang 12 SBT Hóa học 10
Bài tập 5.6 trang 12 SBT Hóa học 10
Bài tập 5.7 trang 12 SBT Hóa học 10
Bài tập 5.8 trang 13 SBT Hóa học 10
Bài tập 5.9 trang 13 SBT Hóa học 10
Bài tập 5.10 trang 13 SBT Hóa học 10
Bài tập 5.11 trang 13 SBT Hóa học 10
Bài tập 5.12 trang 13 SBT Hóa học 10
Bài tập 5.13 trang 13 SBT Hóa học 10
Bài tập 5.14 trang 13 SBT Hóa học 10
Bài tập 5.15 trang 14 SBT Hóa học 10
Bài tập 5.16 trang 14 SBT Hóa học 10
Bài tập 5.17 trang 14 SBT Hóa học 10
Bài tập 1 trang 32 SGK Hóa học 10 nâng cao
Bài tập 2 trang 32 SGK Hóa học 10 nâng cao
Bài tập 2 trang 32 SGK Hóa học 10 nâng cao
Bài tập 4 trang 32 SGK Hóa học 10 nâng cao
Bài tập 5 trang 32 SGK Hóa học 10 nâng cao
Bài tập 6 trang 32 SGK Hóa học 10 nâng cao
Bài tập 7 trang 32 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 5 Chương 1 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.