Bài tập 5.14 trang 13 SBT Hóa học 10
a) Tại sao trong nguyên tử hiđro ở trạng thái cơ bản, một electron duy nhất lại phân bố trên phân lớp 1s ?
Tại sao trong nguyên tử liti ở trạng thái cơ bản, 2 electron phân bố trên phân lớp 1 s và electron thứ ba phân bố trên phân lớp 2s ?
Hướng dẫn giải chi tiết bài 5.14
a) Theo nguyên tắc, trong nguyên tử, các electron sẽ chiếm lần lượt các phân lớp có năng lượng từ thấp đến cao. Trong nguyên tử hiđro, electron duy nhất phân bố trên phân lớp ls vì trên phân lớp 1s, electron có năng lượng thấp nhất.
b) Vì phân lớp 1s chỉ có thể chứa nhiều nhất là 2 electron và có mức năng lượng thấp nhất nên 2 electron đầu phân bố trên phân lớp này. Với 2 electron, phân lớp 1 s đã bão hoà nên electron thứ ba chiếm phân lớp 2s tiếp theo có năng lượng cao hơn.
-- Mod Hóa Học 10 HỌC247
-


Tổng số hạt trong nguyên tử X là 102. Trong hạt nhân nguyên tử, số hạt mang điện ít hơn số hạt không mang điện là 6.
bởi Ho Ngoc Ha
 22/05/2020
22/05/2020
a. Xác định số p, n, e, A.
b. Viết cấu hình electron và kí hiệu hóa học của nguyên tố đó.
Theo dõi (0) 1 Trả lời -


Phân tử X2Y3 có tổng số hạt electron là 50. Số electron trong nguyên tử X nhiều hơn trong Y là 5. Xác định số hiệu nguyên tử của X, Y và viết cấu hình electron đầy đủ.
bởi Nguyễn Thủy
 22/05/2020
Theo dõi (0) 1 Trả lời
22/05/2020
Theo dõi (0) 1 Trả lời -


Cho nguyên tử A, B với phân lớp ngoài cùng (mức năng lượng cao nhất lần lượt là 4px và 4py. Biết tổng electron của hai phân lớp ngoài là 7 và hiệu của hai phân lớp ngoài là 3.
bởi Trịnh Lan Trinh
 22/05/2020
22/05/2020
a. Tìm x, y. Viết cấu hình đầy đủ của A và B.
b. Dự đoán tính kim loại, phi kim hay khí hiếm của A và B.
Theo dõi (0) 1 Trả lời -


Viết cấu hình electron nguyên tử trong các trường hợp sau và cho biết nguyên tố đó là kim loại, phi kim hay khí hiếm.
bởi Ha Ku
 23/05/2020
23/05/2020
a. Nguyên tử A có tổng số electron trong phân lớp s là 7.
b. Nguyên tử B có số electron ở phân lớp 3d chỉ bằng một nữa ở phân lớp 4s.
Theo dõi (0) 1 Trả lời -


Cho biết cấu hình năng lượng ngoài cùng của nguyên tố A là 3p5 và nguyên tố B là 4s2
bởi Goc pho
 22/05/2020
22/05/2020
a. Viết cấu hình đầy đủ của nguyên tố A và B. Cho biết số hiệu nguyên tử của từng nguyên tố?
b. Nguyên tố nào là kim loại? Phi kim?
Theo dõi (0) 1 Trả lời -


Viết cấu hình electron đầy đủ cho biết số hiệu nguyên tử của các nguyên tố có lớp e ngoài cùng như sau:
bởi Nguyễn Thị Lưu
 22/05/2020
22/05/2020
a. 2s22p3
b. 2s22p6
c. 3s2
d. 3s23p5
Dự đoán tính chất hóa học cơ bản của từng nguyên tố trên.
Theo dõi (0) 1 Trả lời -


Cấu trúc electron nào sau đây là của phi kim:
bởi Mai Bảo Khánh
 22/05/2020
22/05/2020
(1). 1s22s22p63s23p4
(2). 1s22s22p63s23p63d24s2
(3). 1s22s22p63s23p63d104s24p3
(4). [Ar]3d54s1
(5). [Ne]3s23p3
(6). [Ne]3s23p64s2
A. (1), (2), (3)
B. (1), (3), (5)
C. (2), (3), (4)
D. (2), (4), (6)
Theo dõi (0) 1 Trả lời -


Cu2+ có cấu hình electron là
bởi Nguyễn Thủy Tiên
 22/05/2020
22/05/2020
A. 1s22s22p63s23p63d94s2
B. 1s22s22p63s23p63d104s1
C. 1s22s22p63s23p63d9
D. 1s22s22p63s23p63d8
Theo dõi (0) 1 Trả lời -


Một nguyên tử X có số hiệu nguyên tử Z =19. Số lớp electron trong nguyên tử X là
bởi Lê Minh Hải
 21/05/2020
21/05/2020
A. 4
B. 5
C. 3
D. 6
Theo dõi (0) 1 Trả lời -


Nguyên tử sắt có Z= 26. Tổng số electron ở các phân lớp 3p và 3d của ion Fe2+ là?
bởi Mai Linh
 20/05/2020
20/05/2020
A. 10
B. 11
C. 12
D. 13
Theo dõi (0) 1 Trả lời -


Cho nguyên tố niken có số hiệu nguyên tử là 28. Cấu hình electron của nguyên tử niken là
bởi Kieu Oanh
 21/05/2020
21/05/2020
A. 1s22s22p63s23p64s23d8
B. 1s22s22p63s23p63d84s2
C. 1s22s22p63s23p63d94s1
D. 1s22s22p63s23p63d10
Theo dõi (0) 1 Trả lời -


Thể tích dung dịch HNO3 tối thiểu cần dùng là?
bởi Quân Lê
 26/04/2020
X là hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 có tỉ lệ mol lần lượt là 1 :2 :3 :4. hòa tan hoàn toàn 76,8 gam X bằng HNO3 thu được 4,48 lít hỗn hợp khí Y gồm NO và NO2. Thể tích dung dịch HNO3 tối thiểu cần dùng là :Theo dõi (0) 0 Trả lời
26/04/2020
X là hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 có tỉ lệ mol lần lượt là 1 :2 :3 :4. hòa tan hoàn toàn 76,8 gam X bằng HNO3 thu được 4,48 lít hỗn hợp khí Y gồm NO và NO2. Thể tích dung dịch HNO3 tối thiểu cần dùng là :Theo dõi (0) 0 Trả lời -


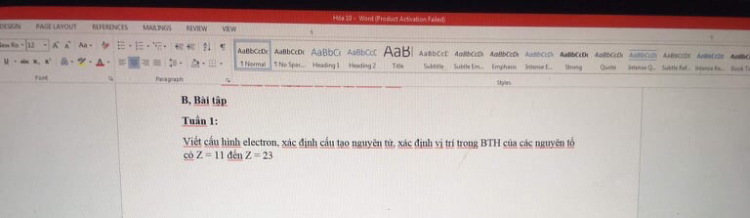
Viết cấu hình electron của Z = 11?
bởi Công Nguyên
 30/03/2020
30/03/2020
 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Có bao nhiêu electron ở lớp thứ 4?
bởi Trần Văn Sơn
 25/12/2019
Trả lời giúpTheo dõi (0) 6 Trả lời
25/12/2019
Trả lời giúpTheo dõi (0) 6 Trả lời
Bài tập SGK khác
Bài tập 5.12 trang 13 SBT Hóa học 10
Bài tập 5.13 trang 13 SBT Hóa học 10
Bài tập 5.15 trang 14 SBT Hóa học 10
Bài tập 5.16 trang 14 SBT Hóa học 10
Bài tập 5.17 trang 14 SBT Hóa học 10
Bài tập 1 trang 32 SGK Hóa học 10 nâng cao
Bài tập 2 trang 32 SGK Hóa học 10 nâng cao
Bài tập 2 trang 32 SGK Hóa học 10 nâng cao
Bài tập 4 trang 32 SGK Hóa học 10 nâng cao
Bài tập 5 trang 32 SGK Hóa học 10 nâng cao





