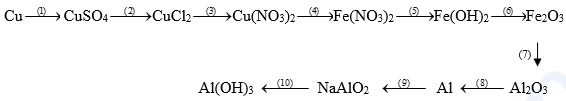Mß╗Øi c├Īc em hß╗Źc sinh lß╗øp 9 c├╣ng tham khß║Żo ─Éß╗ü thi hß╗Źc sinh giß╗Åi m├┤n H├│a hß╗Źc 9- Ph├▓ng GD & ─ÉT Ngß╗Źc Lß║Ęc c├│ ─æ├Īp ├Īn b├¬n dŲ░ß╗øi ─æ├óy. T├Āi liß╗ću gß╗ōm c├Īc c├óu hß╗Åi hay v├Ā kh├│ hi vß╗Źng sß║Į gi├║p c├Īc em ├┤n tß║Łp thß║Łt hiß╗ću quß║Ż v├Ā ─æß║Īt kß║┐t quß║Ż cao trong k├¼ thi sß║»p ─æß║┐n.
PH├ÆNG GD & ─ÉT HUYß╗åN NGß╗īC Lß║ČC
─Éß╗Ć THI Hß╗īC SINH GIß╗ÄI Cß║żP HUYß╗åN
M├öN H├ōA Hß╗īC 9
THỜI GIAN: 150 PHÚT
C├óu 1(2 ─æiß╗ām) Viß║┐t c├Īc phŲ░ŲĪng tr├¼nh h├│a hß╗Źc thß╗▒c hiß╗ćn chuß╗Śi biß║┐n h├│a sau:
C├óu 2(2 ─æiß╗ām):
1. H├▓a tan ho├Ān to├Ān mß╗Öt lŲ░ß╗Żng kim loß║Īi M trong dung dß╗ŗch H2SO4 lo├Żng c├│ nß╗ōng ─æß╗Ö 20% (lß║źy dŲ░ 20% so vß╗øi lŲ░ß╗Żng cß║¦n cho phß║Żn ß╗®ng). Dung dß╗ŗch thu ─æŲ░ß╗Żc c├│ nß╗ōng ─æß╗Ö cß╗¦a muß╗æi tß║Īo th├Ānh l├Ā 23,68%. X├Īc ─æß╗ŗnh kim loß║Īi M ?
2. Hß╗Śn hß╗Żp A gß╗ōm C3H4; C3H6; C3H8 c├│ tß╗ē khß╗æi ─æß╗æi vß╗øi hidro l├Ā 21. ─Éß╗æt ch├Īy ho├Ān to├Ān 1,12 l├Łt hß╗Śn hß╗Żp A(ß╗¤ ─æktc) rß╗ōi dß║½n to├Ān bß╗Ö sß║Żn phß║®m ch├Īy v├Āo b├¼nh ─æß╗▒ng dung dß╗ŗch nŲ░ß╗øc v├┤i trong dŲ░. T├Łnh ─æß╗Ö t─āng khß╗æi lŲ░ß╗Żng cß╗¦a b├¼nh.
C├óu 3(2 ─æiß╗ām)
N├¬u phŲ░ŲĪng ph├Īp h├│a hß╗Źc t├Īch ri├¬ng tß╗½ng kim loß║Īi ri├¬ng biß╗ćt ra khß╗Åi hß╗Śn hß╗Żp rß║»n gß╗ōm: Na2CO3, BaCO3, MgCO3.
C├óu 4(2 ─æiß╗ām):
1. N├¬u phŲ░ŲĪng ph├Īp h├│a hß╗Źc nhß║Łn biß║┐t 5 chß║źt lß╗Ång ─æß╗▒ng trong 5 lß╗Ź ri├¬ng biß╗ćt sau: rŲ░ß╗Żu etylic; benzen; glucozo; axit axetic; etyl axetat.
2. N├¬u hiß╗ćn tŲ░ß╗Żng xß║Ży ra khi cho Na v├Āo tß╗½ng dung dß╗ŗch: FeCl3; NH4NO3; AlCl3; AgNO3.
C├óu 5( 2 ─æiß╗ām)
Cho 80 gam bß╗Öt Cu v├Āo 200 gam dung dß╗ŗch AgNO3, sau mß╗Öt thß╗Øi gian phß║Żn ß╗®ng ─æem lß╗Źc thu ─æŲ░ß╗Żc dung dß╗ŗch A v├Ā 95,2 gam chß║źt rß║»n B. Cho tiß║┐p 80 gam bß╗Öt Pb v├Āo dung dß╗ŗch A, phß║Żn ß╗®ng xong ─æem lß╗Źc th├¼ thu ─æŲ░ß╗Żc dung dß╗ŗch D chß╗ē chß╗®a mß╗Öt muß╗æi duy nhß║źt v├Ā 67,05 gam chß║źt rß║»n E. Cho 40 gam bß╗Öt kim loß║Īi R(c├│ h├│a trß╗ŗ II) v├Āo 1/10 dung dß╗ŗch D, sau phß║Żn ß╗®ng ho├Ān to├Ān ─æem lß╗Źc th├¼ t├Īch ─æŲ░ß╗Żc 44,575 gam chß║źt rß║»n F. T├Łnh nß╗ōng ─æß╗Ö mol cß╗¦a dung dß╗ŗch AgNO3 v├Ā x├Īc ─æß╗ŗnh kim loß║Īi R.
C├óu 6(2 ─æiß╗ām)
Hß╗Śn hß╗Żp X gß╗ōm axetilen, propilen v├Ā metan. ─Éß╗æt ch├Īy ho├Ān to├Ān 11 gam X thu ─æŲ░ß╗Żc 12,6 gam H2O. C├▓n 11,2 dm3 X (ß╗¤ ─æktc) th├¼ phß║Żn ß╗®ng tß╗æi ─æa ─æŲ░ß╗Żc vß╗øi dung dß╗ŗch chß╗®a 100 gam brom. T├Łnh th├Ānh phß║¦n % vß╗ü thß╗ā t├Łch cß╗¦a mß╗Śi kh├Ł trong hß╗Śn hß╗Żp X.
C├óu7(2 ─æiß╗ām)
C├│ 15 gam hß╗Śn hß╗Żp Al v├Ā Mg ─æŲ░ß╗Żc chia th├Ānh 2 phß║¦n bß║▒ng nhau. Phß║¦n 1 cho v├Āo 600 ml dung dß╗ŗch HCl c├│ nß╗ōng ─æß╗Ö x mol/l thu ─æŲ░ß╗Żc kh├Ł A v├Ā dung dß╗ŗch B, c├┤ cß║Īn dung dß╗ŗch B thu ─æŲ░ß╗Żc 27,9 gam muß╗æi khan( th├Ł nghiß╗ćm 1). Phß║¦n 2 cho v├Āo 800 ml dung dß╗ŗch HCl c├│ nß╗ōng ─æß╗Ö x mol/l v├Ā l├Ām tŲ░ŲĪng tß╗▒ thu ─æŲ░ß╗Żc 32,35 gam muß╗æi khan( th├Ł nghiß╗ćm 2). T├Łnh th├Ānh phß║¦n % vß╗ü khß╗æi lŲ░ß╗Żng mß╗Śi kim loß║Īi trong hß╗Śn hß╗Żp ban ─æß║¦u v├Ā trß╗ŗ sß╗æ x.
C├óu 8(2 ─æiß╗ām)
1.Tß╗½ nguy├¬n liß╗ću l├Ā vß╗Å b├Āo, m├╣n cŲ░a chß╗®a 50% xenlulozŲĪ vß╗ü khß╗æi lŲ░ß╗Żng, ngŲ░ß╗Øi ta ─æiß╗üu chß║┐ rŲ░ß╗Żu etylic vß╗øi hiß╗ću suß║źt 75%. T├Łnh khß╗æi lŲ░ß╗Żng nguy├¬n liß╗ću cß║¦n thiß║┐t ─æß╗ā ─æiß╗üu chß║┐ 1000 l├Łt rŲ░ß╗Żu etylic 900. Khß╗æi lŲ░ß╗Żng ri├¬ng cß╗¦a rŲ░ß╗Żu etylic nguy├¬n chß║źt l├Ā 0,8 g/ml.
2. Cho luß╗ōng kh├Ł CO qua ß╗æng sß╗® chß╗®a m gam hß╗Śn hß╗Żp X gß╗ōm MnO v├Ā CuO nung n├│ng. Sau mß╗Öt thß╗Øi gian trong ß╗æng sß╗® c├▓n lß║Īi p gam chß║źt rß║»n. Kh├Ł tho├Īt ra ─æŲ░ß╗Żc hß║źp thß╗ź ho├Ān to├Ān bß║▒ng dung dß╗ŗch Ca(OH)2 ─æŲ░ß╗Żc q gam kß║┐t tß╗¦a v├Ā dung dß╗ŗch Z. Dung dß╗ŗch Z t├Īc dß╗źng vß╗½a ─æß╗¦ vß╗øi V l├Łt dung dß╗ŗch NaOH nß╗ōng ─æß╗Ö c mol/l. Lß║Łp biß╗āu thß╗®c t├Łnh V theo m, p, q, c.
C├óu 9(2 ─æiß╗ām)
Cho hß╗Śn hß╗Żp Z gß╗ōm 2 chß║źt hß╗»u cŲĪ A v├Ā B t├Īc dß╗źng vß╗½a ─æß╗¦ vß╗øi dung dß╗ŗch chß╗®a 4 gam NaOH tß║Īo ra hß╗Śn hß╗Żp 2 muß╗æi R1COONa ; R2COONa v├Ā 1 rŲ░ß╗Żu ROH( Trong ─æ├│ R1; R2 v├Ā R chß╗ē chß╗®a C v├Ā H; R2 = R1 + 14). T├Īch lß║źy to├Ān bß╗Ö rŲ░ß╗Żu rß╗ōi cho t├Īc dß╗źng hß║┐t vß╗øi Na thu ─æŲ░ß╗Żc 1,12 l├Łt H2 (ß╗¤ ─æktc). Mß║Ęt kh├Īc cho 5,14 gam Z t├Īc dß╗źng vß╗øi mß╗Öt lŲ░ß╗Żng vß╗½a ─æß╗¦ NaOH thu ─æŲ░ß╗Żc 4,24 gam muß╗æi, c├▓n ─æß╗ā ─æß╗æt ch├Īy hß║┐t 15,42 gam Z cß║¦n d├╣ng 21,168 l├Łt O2 (ß╗¤ ─æktc) tß║Īo ra 11,34 gam H2O. X├Īc ─æß╗ŗnh c├┤ng thß╗®c h├│a hß╗Źc cß╗¦a A v├Ā B
C├óu10(2─æiß╗ām)
1. Tß║Īi sao khi ─æß╗æt than trong ph├▓ng k├Łn, ─æ├│ng k├Łn cß╗Ła c├│ thß╗ā g├óy tß╗Ł vong? Viß║┐t phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc xß║Ży ra.
2. H├Ży n├¬u 8 hß╗Żp chß║źt chß╗®a K hoß║Ęc Na c├│ nhiß╗üu ß╗®ng dß╗źng trong thß╗▒c tß║┐. Nhß╗»ng ß╗®ng dß╗źng ─æ├│ l├Ā g├¼?
ĐÁP ÁN
|
─É├Īp ├Īn |
─Éiß╗ām |
||||||||
|
C├óu 1 1. Cu + 2H2SO4(─æ) \(\xrightarrow{{{t^o}}}\) CuSO4 + SO2 + 2H2O 2. CuSO4 + BaCl2 ŌåÆ CuCl2 + BaSO4 3. CuCl2 + 2AgNO3 ŌåÆ Cu(NO3)2 + 2AgCl 4. Cu(NO3)2 + Fe ŌåÆ Cu + Fe(NO3)2 5. Fe(NO3)2 + 2NaOH ŌåÆ Fe(OH)2 + 2NaNO3 6. 4Fe(OH)2 + O2 \(\xrightarrow{{{t^o}}}\) 2Fe2O3 + 4H2O 7. Fe2O3 + 2Al \(\xrightarrow{{{t^o}}}\) 2Fe + Al2O3 8. 2Al2O3 \(\xrightarrow{{dpnc,\,c{\text{r}}i{\text{o}}lit}}\) 4Al + 3O2 9. 2Al + 2NaOH + 2H2O ŌåÆ 2NaAlO2 + 3H2 10. NaAlO2 + CO2 + 2H2O ŌåÆ Al(OH)3 + NaHCO3 |
0,2─æ 0,2─æ 0,2─æ 0,2─æ 0,2─æ 0,2─æ 0,2─æ 0,2─æ 0,2─æ 0,2─æ
|
||||||||
|
C├óu 2 1. Gß╗Źi h├│a trß╗ŗ cß╗¦a kim loß║Īi M trong phß║Żn ß╗®ng l├Ā n ( 1 \(\leqslant \) n \(\leqslant \) 3) PTHH: 2M + nH2SO4 ŌåÆ M2(SO4)n + nH2 Gß╗Źi sß╗æ mol cß╗¦a M l├Ā x Theo PTHH : nH2 = nH2SO4 = nx/2 (mol) V├¼ d├╣ng dŲ░ 20% so vß╗øi lŲ░ß╗Żng phß║Żn ß╗®ng \( \Rightarrow {n_{{H_2}S{O_4}\,ban\,dau}} = \frac{{nx \times 120}}{{2 \times 100}} = 0,6nx\,(mol)\) Khß╗æi lŲ░ß╗Żng dung dß╗ŗch H2SO4 ─æ├Ż d├╣ng l├Ā: \(\frac{{98 \times 0,6nx}}{{20}} \times 100 = 294nx(gam)\) Theo ─æß╗ŗnh luß║Łt b├Āo toß║Żn khß╗æi lŲ░ß╗Żng: mdung dß╗ŗch sau phß║Żn ß╗®ng = mkim loß║Īi + mdung dß╗ŗch axit ŌĆō mhidro = M.x + 294nx - = M.x +293nx (gam) Theo PTHH: nmuß╗æi = nM = x (mol) mmuß╗æi = x.(2M + 96.n)= M.x + 48.n.x (g) Theo b├Āi ra ta c├│: \(\frac{{M.x + 48nx}}{{Mx + 293nx}}\) .100% = 23,68% M = 28n.
Vß║Ły kim loß║Īi h├│a trß╗ŗ II khß╗æi lŲ░ß╗Żng mol = 56 l├Ā sß║»t (Fe) ..................................................................................................... 2. Ta c├│: \(\overline {{M_A}} \)= 21. 2 = 42(g/mol) nA= 1,12/22,4= 0,05(mol) Gß╗Źi c├┤ng thß╗®c trung b├¼nh cß╗¦a hß╗Śn hß╗Żp A l├Ā: C3Hy PTHH: C3Hy + (3+ )O2 \(\xrightarrow{{{t^o}}}\) 3CO2 + H2O Theo PTHH : nCO = 3nC3 Hy = 3.0,05 = 0,15(mol) nH O = y/2. nC3 H y= y/2. 0,05 = 0,025y(mol) V├¼ \(\overline {{M_A}} \) = 42 ŌåÆ 12.3 + y = 42 y = 6 ─Éß╗Ö t─āng khß╗æi lŲ░ß╗Żng cß╗¦a b├¼nh nŲ░ß╗øc v├┤i trong bß║▒ng tß╗Ģng khß╗æi lŲ░ß╗Żng CO2 v├Ā H2O \(\Delta \)m = (44. 0,15) + (18. 0,025.6) = 9,3(g) |
0,125─æ
0,125─æ
0,125─æ
0,125─æ
0,25─æ
0,125─æ
0,125─æ
0,25─æ 0,125─æ
0,125─æ 0,125─æ 0,25─æ |
Tr├¬n ─æ├óy l├Ā tr├Łch dß║½n mß╗Öt phß║¦n nß╗Öi dung t├Āi liß╗ću ─Éß╗ü thi hß╗Źc sinh giß╗Åi m├┤n H├│a hß╗Źc 9- Ph├▓ng GD & ─ÉT Ngß╗Źc Lß║Ęc c├│ ─æ├Īp ├Īn. ─Éß╗ā xem th├¬m nhiß╗üu t├Āi liß╗ću tham khß║Żo hß╗»u ├Łch kh├Īc c├Īc em chß╗Źn chß╗®c n─āng xem online hoß║Ęc ─æ─āng nhß║Łp v├Āo trang hoc247.net ─æß╗ā tß║Żi t├Āi liß╗ću vß╗ü m├Īy t├Łnh.
Ngo├Āi ra c├Īc em hß╗Źc sinh c├│ thß╗ā tham khß║Żo c├Īc t├Āi liß╗ću c├╣ng chuy├¬n mß╗źc:
- ─Éß╗ü thi tuyß╗ān chß╗Źn ─æß╗Öi tuyß╗ān hß╗Źc sinh giß╗Åi m├┤n H├│a hß╗Źc 9- TrŲ░ß╗Øng THCS Ti├¬n Du c├│ ─æ├Īp ├Īn
- ─Éß╗ü thi hß╗Źc sinh giß╗Åi m├┤n H├│a hß╗Źc 9- Sß╗¤ GD & ─ÉT V─®nh Ph├║c c├│ ─æ├Īp ├Īn
Ch├║c c├Īc em hß╗Źc tß╗æt!
TŲ░ liß╗ću nß╗Ģi bß║Łt tuß║¦n
- Xem thêm