Để giúp các em học sinh lớp 9 chuẩn bị thật tốt cho kì thi học sinh giỏi sắp đến, HOC247 đã tổng hợp để gửi đến các em Đề thi học sinh giỏi môn Hóa học 9- Sở GD & ĐT tỉnh Thái Nguyên có đáp án. Tài liệu gồm các câu hỏi hay và khó có hướng giải cụ thể và chi tiết, mời các em cùng tham khảo nội dung chi tiết bên dưới đây.
SỞ GD & ĐT TỈNH THÁI NGUYÊN
ĐỀ THI HỌC SINH GIỎI MÔN HÓA HỌC 9
THỜI GIAN: 150 PHÚT
Câu 1 (2,0 điểm):
1. X là hỗn hợp của hai kim loại gồm kim loại R và kim loại kiềm M. Lấy 9,3 gam X cho vào nước dư thu được 4,48 lít khí H2 (đktc). Đem 1,95 gam kali luyện thêm vào 9,3 gam X ở trên, thu được hỗn hợp Y có phần trăm khối lượng kali là 52%. Lấy toàn bộ hỗn hợp Y cho tác dụng với dung dịch KOH dư thu được 8,4 lít khí H2 (đktc). Biết các phản ứng xảy ra hoàn toàn. Xác định kim loại M và R.
2. Cho 500 gam dung dịch CuSO4 nồng độ 16% (dung dịch X). Làm bay hơi 100 gam H2O khỏi dung dịch X thì thu được dung dịch bão hòa (dung dịch Y). Tiếp tục cho m gam CuSO4 vào dung dịch Y thấy tách ra 10 gam CuSO4.5H2O kết tinh. Xác định giá trị của m.
Câu 2 (1,5 điểm): Bằng phương pháp hóa học hãy nhận biết các dung dịch riêng biệt trong các trường hợp sau:
1. Dung dịch AlCl3 và dung dịch NaOH (không dùng thêm hóa chất).
2. Dung dịch Na2CO3 và dung dịch HCl (không dùng thêm hóa chất).
3. Dung dịch NaOH 0,1M và dung dịch Ba(OH)2 0,1M (chỉ dùng thêm dung dịch HCl và phenolphtalein).
Câu 3 (1,5 điểm):
1. Viết phương trình phản ứng và giải thích các hiện tượng hóa học sau:
a) Trong tự nhiên có nhiều nguồn tạo ra H2S nhưng lại không có sự tích tụ H2S trong không khí.
b) Trong phòng thí nghiệm, khi nhiệt kế thủy ngân bị vỡ người ta dùng bột lưu huỳnh rắc lên nhiệt kế bị vỡ.
c) Trong phòng thí nghiệm bị ô nhiễm khí Cl2, để khử độc người ta xịt vào không khí dung dịch NH3.
|
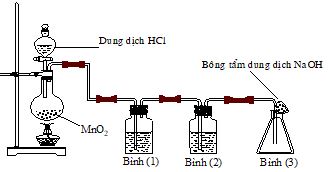
2. Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl. a) Hãy viết phương trình phản ứng điều chế khí Cl2 (ghi rõ điều kiện). b) Giải thích tác dụng của bình (1) (đựng dung dịch NaCl bão hòa); bình (2) (đựng dung dịch H2SO4 đặc) và nút bông tẩm dung dịch NaOH ở bình (3).
|
|
Câu 4 (1,5 điểm ): Hòa tan hết 24,16 gam hỗn hợp X gồm Cu và Fe3O4 trong dung dịch HCl loãng dư thấy còn lại 6,4 gam Cu không tan. Mặt khác hòa tan hết 24,16 gam hỗn hợp trên trong 240 gam dung dịch HNO3 31,5% (dùng dư) thu được dung dịch Y (không chứa NH4NO3). Cho 600 ml dung dịch NaOH 2M vào dung dịch Y. Lọc bỏ kết tủa, cô cạn dung dịch nước lọc sau đó nung tới khối lượng không đổi thu được 78,16 gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn.
1. Tính khối lượng mỗi chất trong X.
2. Tính nồng độ % của Cu(NO3)2 có trong dung dịch Y.
|
Câu 5 (1,0 điểm): Xác định các chất hữu cơ A, D, Y, E, G, H, I và viết các phương trình phản ứng (ghi rõ điều kiện của phản ứng, nếu có) trong dãy biến hóa sau: |
|
Câu 6 (2,5 điểm ):
1. Hiđrocacbon X là chất khí (ở nhiệt độ phòng, 250C). Nhiệt phân hoàn toàn X (trong điều kiện không có oxi) thu được sản phẩm gồm cacbon và hiđro, trong đó thể tích khí hiđro thu được gấp đôi thể tích khí X (đo ở cùng điều kiện nhiệt độ và áp suất). Xác định công thức phân tử và viết công thức cấu tạo mạch hở của X.
2. Cho 0,448 lít hỗn hợp khí X (đktc) gồm hai hiđrocacbon mạch hở (thuộc các dãy đồng đẳng ankan, anken, ankin) lội từ từ qua bình chứa 0,14 lít dung dịch Br2 0,5M. Sau khi phản ứng hoàn toàn, số mol Br2 giảm đi một nửa và không thấy có khí thoát ra. Mặt khác nếu đốt cháy hoàn toàn 0,448 lít X (đktc), lấy toàn bộ sản phẩm cháy cho hấp thụ hết vào 400 (ml) dung dịch Ba(OH)2 0,1M thu được 5,91 gam kết tủa. Xác định công thức phân tử của hai hiđrocacbon.
(Cho biết: H = 1; Li = 7; C = 12; N = 14; O = 16; Na = 23; Mg = 24; P = 31; S = 32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Br = 80; Ba = 137)
----------Hết---------
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
Câu |
NỘI DUNG ĐÁP ÁN |
Điểm |
|
Câu 1 2,0đ |
\({{\text{n}}_{{{\text{H}}_{\text{2}}}{\text{(1)}}}} = \frac{{4,48}}{{22,4}}\) = 0,2 (mol); \({{\text{n}}_{{{\text{H}}_{\text{2}}}{\text{(2)}}}} = \frac{{8,4}}{{22,4}}\)= 0,375 (mol). Khi thêm 1,95 gam K vào 9,3 gam X, nếu trong X không có K thì %mK = \(\frac{{1,95}}{{1,95 + 9,3}}.100 \approx 17,33\% \)< 52%, suy ra trong X có kim loại K=> M chính là K
+ Nếu R tan trực tiếp trong nước, hoặc không tan trong dung dịch KOH, thì khi cho Y tác dụng với KOH so với X có thêm 0,025 mol H2, do có phản ứng K + H2O → KOH + H2 0,05 0,025 =>\(\sum\limits_{}^{} {{n_{{H_2}(2)}}} = 0,2 + 0,025 = 0,225\) (mol)< \({{\text{n}}_{{{\text{H}}_{\text{2}}}{\text{(2)}}}}\)đề cho. =>R không tan trực tiếp trong nước nhưng tan trong dd KOH Đặt số mol của K và R lần lượt là x,y ta có: x = \(\frac{{0,52.(9,3 + 1,95)}}{{39}}\) = 0,15mol => mR = yR = 9,3 - 0,1.39 = 5,4 gam (I)
K + H2O → KOH + 1/2H2 0,15 0,15 0,075 R + (4-n)KOH + (n-2)H2O → K(4-n) RO2 + n/2H2 y dư ny/2 => \({{\text{n}}_{{{\text{H}}_{\text{2}}}{\text{(2)}}}}\)= 0,075 + = 0,375 => ny = 0,6 (II) Từ (I,II) => R = => n = 3; R = 27 (Al) 2. 80 gam mY = 500 - 100 = 400 gam → \({{\text{C}}_{{\text{\% (CuS}}{{\text{O}}_{\text{4}}}{\text{)/Y}}}} = \frac{{80.100\% }}{{400}} = 20\% \) Sau khi CuSO4.5H2O tách ra khỏi Y, phần còn lại vẫn là dung dịch bão hòa nên khối lượng CuSO4 và H2O tách ra khỏi Y cũng phải theo tỉ lệ như dung dịch bão hòa bằng Trong 10 gam CuSO4.5H2O có 6,4 gam CuSO4 và 3,6 gam H2O Khối lượng CuSO4 tách ra khỏi Y là 6,4 - m (gam) → (6,4 - m)/3,6 = 20/80 → m = 5,5 gam |
0,25
0,25
0,25 0,25 0,25 0,25 0,25
0,25 |
|
Câu 2 1,5đ |
1. Trích mỗi dung dịch một ít làm mẫu thử đánh số mẫu 1, mẫu 2:
+ Nếu thấy ban đầu có kết tủa keo sau đó tan tạo dung dịch trong suốt thì mẫu 1 là NaOH, mẫu 2 là AlCl3; + Nếu ban đầu không có kết tủa sau đó mới có kết tủa thì, mẫu 1 là AlCl3; mẫu 2 là NaOH Ptpư: AlCl3 + 3NaOH → Al(OH)3 + 3NaCl Al(OH)3 + NaOH → NaAlO2 + 2H2O AlCl3 + 4NaOH → NaAlO2 + 3NaCl+ 2H2O AlCl3 + 3NaAlO2 + 6H2O → 4Al(OH)3 + 3NaCl 2. Trích mẫu thử, đánh số 1, 2 Nhỏ từ từ 1 vào 2 nếu có khí bay ra luôn thì 1 là Na2CO3 và 2 là HCl; ngược lại nếu không có khí bay ra ngay thì 1 là HCl và 2 là Na2CO3, vì - Khi nhỏ từ từ dung dịch HCl vào dung dịch Na2CO3 thì có phản ứng Na2CO3 + HCl → NaHCO3 + NaCl NaHCO3 + HCl → NaCl + CO2 + H2O. - Khi nhỏ từ từ dung dịch Na2CO3 vào dung dịch HCl có phản ứng Na2CO3 + 2HCl → 2NaCl + CO2 + H2O 3. Trích mẫu thử; đong lấy hai thể tích NaOH và Ba(OH)2 ( sao cho thể tích bằng nhau, đều bằng V); cho vào 2 ống nghiệm, nhỏ vài giọt phenolphtalein cho vào 2 ống nghiệm, đánh số 1, 2; Sau đó lấy dung dịch HCl nhỏ từ từ vào từng ống nghiệm đến khi bắt đầu mất màu hồng thì dừng lại: Đo thể tích dung dịch HCl đã dùng; với ống nghiệm 1 cần V1(l) dd HCl; với 2 cần V2(l) dd HCl + Nếu V2> V1 => Ống 1 đựng Ba(OH)2; ống 2 đựng NaOH + Nếu V2 Giải thích: HCl + NaOH → NaCl + H2O 0,1V 0,1V 2HCl + Ba(OH)2 → BaCl2 + 2H2O 0,2V 0,1V |
0,25
0,25
0,25
0,25
0,25
0,25 |
---Để xem đầy đủ nội dung và đáp án của đề thi các em vui lòng xem online hoặc tải về máy---
Trên đây là trích dẫn một phần nội dung tài liệu Đề thi học sinh giỏi môn Hóa học 9- Sở GD & ĐT tỉnh Thái Nguyên có đáp án. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Ngoài ra các em học sinh có thể tham khảo các tài liệu cùng chuyên mục:
- Đề thi học sinh giỏi môn Hóa học 9- Sở GD & ĐT tỉnh Bắc Giang có đáp án
- Đề thi học sinh giỏi môn Hóa học 9- Trường THCS Nguyễn Chánh có đáp án
Chúc các em học tốt!





.JPG)


