Mời các em học sinh cùng tham khảo nội dung Đề thi học sinh giỏi môn Hóa học 9- Trường THCS Nguyễn Chánh có đáp án dưới đây. Tài liệu được tổng hợp với nội dung đầy đủ, chi tiết, hy vọng đây sẽ là tài liệu hữu ích giúp các em học tập thật tốt.
TRƯỜNG THCS NGUYỄN CHÁNH
ĐỀ THI HỌC SINH GIỎI MÔN HÓA HỌC 9
THỜI GIAN: 150 PHÚT
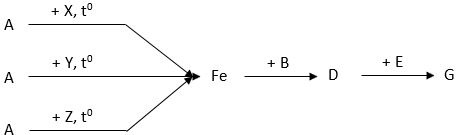
Câu 1 (3 điểm): Cho sơ đồ biến hóa sau:
Biết A + HCl → D + G + H2O
Tìm công thức của các chất kí hiệu bằng các chữ cái (A, B,...). Viết các phương trình phản ứng theo sơ đồ trên.
Câu 2: (3 điểm)
2.2. Nêu hiện tượng và viết phương trình hóa học (nếu có) cho mỗi thí nghiệm sau:
a. Cho kim loại Natri vào dung dịch CuCl2.
b. Sục từ từ đến dư khí CO2 vào nước vôi trong.
c. Nhỏ từ từ đến dư dung dịch HCl đặc vào cốc đựng thuốc tím.
d. Cho lá kim loại đồng vào dung dịch sắt (III) sunfat.
Câu 3 ( 3điểm )
- Cho hỗn hợp gồm CO , SO3 và CO2 bằng phương pháp hóa học hãy nhận ra sự có mặt của mỗi khí trong hỗn hợp
- Chỉ dùng một dung dịch phân biệt 3 hỗn hợp riêng biệt(Al, Fe); ( Al, Al2O3 ) ; ( Fe, Al2O3 )
Câu 4 ( 4điểm):
Cho luồng khí CO đi qua một ống sứ chứa m gam bột ôxit sắt (FexOy) nung nóng cho đến khi phản ứng xảy ra hoàn toàn . Dẫn toàn bộ khí sinh ra đi thật chậm vào 1 lít dung dịch Ba(OH)2 0,1M thu được 9,85 gam kết tủa . Mặt khác khi hòa tan toàn bộ lượng kim loại sắt tạo thành ở trên bằng V lít dung dịch HCl 2M ( có dư ) thì thu được một dung dịch sau khi cô cạn thu được 12,7 gam muối khan .
- Xác định công thức của ôxit sắt .
- Tính m
Câu 5 (3điểm): Tính nồng độ mol (CM) ban đầu của dung dịch H2SO4 (dung dịch A) và dung dịch NaOH (dung dịch B). Biết rằng:
- Nếu đổ 3 lít dung dịch A vào 2 lít dung dịch B thì thu được dung dịch có nồng độ của axit dư là 0,2M.
- Nếu đổ 2 lít dung dịch A vào 3 lít dung dịch B thì thu được dung dịch có nồng độ của NaOH dư là 0,1M.
Câu 6 (4 điểm):
Đốt cháy hoàn toàn 2,24 lít ở đktc một hiđrocacbon A ở thể khí. Sau đó dẫn sản phẩm cháy qua bình đựng 4 lít dung dịch Ca(OH)2 0,05M thấy có 10 gam kết tủa. Khối lượng bình tăng là 18,6 gam.
- Tìm công thức phân tử của A
- Viết các công thức cấu tạo có thể có của A.
ĐÁP ÁN
Câu 1 (3điểm): Chọn đúng mỗi chất được 0,125 điểm:
A: Fe3O4 B: HCl
X: H2 D: FeCl2
Y: Al E: Cl2
Z: CO G: FeCl3
Phương trình hóa học:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O (0,5 điểm)
Fe3O4 + 4H2 3Fe + 4H2O (0,5 điểm)
3Fe3O4 + 8Al 4Al2O3 + 9Fe (0,5 điểm)
Fe3O4 + 4CO 3Fe + 4CO2 (0,5 điểm)
Fe + 2HCl → FeCl2 + H2 (0,5 điểm)
2FeCl2 + Cl2 → 2FeCl3 (0,5 điểm)
Câu 2 (3 điểm):
a. Kim loại Natri tan dần, có khí không màu bay ra, xuất hiện chất kết tủa màu xanh.
2Na + 2H2O → 2NaOH + H2↑
2NaOH + CuCl2 → 2NaCl + Cu(OH)2↓ (1điểm)
b.Ban đầu thấy nước vôi trong vẩn đục, sau đó lại trở nên trong suốt.
Ca(OH)2 + CO2 → CaCO3↓
CaCO3 + CO2 + H2O → Ca(HCO3)2 (1điểm)
c.Thuốc tím mất màu, xuất hiện khí màu vàng lục.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O (0,5 điểm)
d.Dung dịch sắt (III) sunfat màu vàng nâu nhạt màu dần rồi chuyển dần thành dd màu xanh nhạt.
Cu + Fe2(SO4)3 → 2FeSO4 + CuSO4 (0,5 điểm)
Câu 3 (3điểm)
Câu 3a(1,5điểm)
-Cho hỗn hợp 3 khí trên qua dd BaCl2 thấy có kết tủa trắng là SO3 :
PTHH: SO3 + H2O + BaCl2 BaSO4 + 2HCl
- Thu hai khí còn lại không tác dụng đi qua nước vôi trong dư, nếu thấy nước vôi trong vẩn đục thì chứng tỏ có khí CO2.
PTHH: CO2 + Ca(OH)2 CaCO3 + H2O
- Thu khí còn lại dẫn qua bột CuO màu đen nung nóng thấy có kết tủa màu đỏ xuất hiện, hấp thụ sản phẩm khí bằng nước vôi trong dư thấy nước vôi trong vẫn đục chứng tỏ khí ban đầu là CO.
PTHH: CuO + CO Cu + CO2
Câu 3b(1,5điểm)
Cho dd NaOH (dư) vào 3 hỗn hợp trên:
- Hỗn hợp nào có khí bay ra và có một chất không tan là ( Al,Fe)
Al + NaOH + H2O NaAlO2+ 3/2H2
- Hỗn hợp nào có khí bay ra và hổn hợp tan hết là ( Al, Al2O3)
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Al2O3 + 2NaOH → 2NaAlO2 + H2O
- Hỗn hợp có tan nhưng không có khí bay ra là
( Fe , Al2O3 ) :
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Câu 4:(4điểm)
- (3điểm) Xđ công thức oxit sắt FexOy
giả sử có a mol FexOy tham gia phản ứng
Số mol Ba(OH)2 = 1.0,1 = 0,1 (mol)
Số mol BaCO3 = 9,85/197 = 0,05 (mol)
FexOy + y CO →x Fe + y CO2 (1)
a ax ay
CO2 + Ba(OH)2 → BaCO3 ↓ + H2O .(2)
0,05 0,05 0,05
2CO2 + Ba(OH)2 → Ba(HCO3)2 (3)
0,1 0,05
Fe + 2 HCl →FeCl2 + H2
ax ax
+ Nếu tạo muối trung hoà thì:
ay = 0,05 và ax = 12,7/127 = 0,1
x/y = 2 (vô lí)
+ Nếu tạo muối trung hoà và muối axit :
Từ (2), (3) ta có nCO2 = 0,15 mol
Ta có hệ ay = 0,15 và ax = 0,1 x = 2 và y = 3
Vcông thức của Oxit sắt là: Fe2O3
b.Tính m (1điểm)
Fe2O3 + 3CO → 2Fe + 3CO2 (5)
0,05 0,15
→ m = m Fe2O3 = 0,05. 160 = 8 gam
Câu 5 (3điểm)
Gọi x, y lần lượt là nồng độ mol của dung dịch H2SO4 và NaOH
- Trường hợp1: Số mol H2SO4 trong 3 lít là 3x, số mol NaOH trong 2lít là 2y.
H2SO4 + 2NaOH → Na2SO4 + 2H2O (0,5 điểm)
y 2y
- Vì axit dư => tính theo NaOH. 0,25 điểm)
- nH2SO4 dư: 0,2 x 5 = 1 (mol) => ta có phương trình: (0,25 điểm)
3x - y = 1 (*) 0,25 điểm)
- Thí nghiệm 2: Số mol H2SO4 trong 2lít là 2x, số mol NaOH trong 3lít là 3y.
H2SO4 + 2NaOH → Na2SO4 + 2H2O (0,5 điểm)
2x 4x
- Vì NaOH dư => tính theo H2SO4.
- nNaOH (dư): 0,1 x 5 = 0,5 (mol) => ta có phương trình: (0,25 điểm)
3y - 4x = 0,5 (**) (0,25 điểm)
- Từ (*)và (**) giải hệ phương trình ta được: x = 0,7 ; y = 1,1 (0,25 điểm)
Vậy nồng độ ban đầu của dung dịch H2SO4 là 0,7M ; của NaOH là 1,1 M (0,5 điểm)
---Để xem đầy đủ nội dung và đáp án của đề thi các em vui lòng xem online hoặc tải về máy---
Trên đây là trích dẫn một phần nội dung tài liệu Đề thi học sinh giỏi môn Hóa học 9- Trường THCS Nguyễn Chánh có đáp án. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Ngoài ra các em học sinh có thể tham khảo các tài liệu cùng chuyên mục:
- Đề thi học sinh giỏi môn Hóa học 9- Phòng GD & ĐT huyện Bù Gia Mập có đáp án
- Đề thi học sinh giỏi môn Hóa học 9- Phòng GD & ĐT Bù Đăng có đáp án
Chúc các em học tốt!