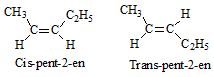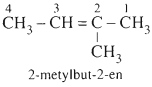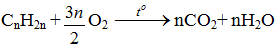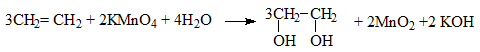Nß╗Öi dung b├Āi hß╗Źc Anken t├¼m hiß╗āu vß╗ü ─æß╗ōng ─æß║│ng, ─æß╗ōng ph├ón, danh ph├Īp anken; T├Łnh chß║źt vß║Łt l├Ł, h├│a hß╗Źc cß╗¦a anken nhŲ░ phß║Żn ß╗®ng cß╗Öng (cß╗Öng hidro, cß╗Öng halogen, cß╗Öng HX, ...), hiß╗āu vß╗ü quy tß║»c Maccopnhicop, phß║Żn ß╗®ng tr├╣ng hß╗Żp, phß║Żn ß╗®ng oxi h├│a ho├Ān to├Ān v├Ā kh├┤ng ho├Ān to├Ān; ─æiß╗üu chß║┐ v├Ā ß╗®ng dß╗źng anken.
T├│m tß║»t l├Į thuyß║┐t
1.1. ─Éß╗ōng ─æß║│ng, ─æß╗ōng ph├ón, danh ph├Īp
- Anken cß║źu tß║Īo c├│ mß╗Öt li├¬n kß║┐t ─æ├┤i gß╗ōm mß╗Öt li├¬n kß║┐t \(\sigma\) bß╗ün vß╗»ng v├Ā mß╗Öt li├¬n kß║┐t \(\pi\) k├®m bß╗ün.
- Anken l├Ā hi─ærocacbon kh├┤ng no mß║Īch hß╗¤, trong ph├ón tß╗Ł c├│ mß╗Öt li├¬n kß║┐t ─æ├┤i C=C.
1.1.1. D├Ży ─æß╗ōng ─æß║│ng cß╗¦a anken
- Etilen (C2H4), propilen (C3H6),butilen (C4H10) ŌĆ” c├│ t├Łnh chß║źt tŲ░ŲĪng tß╗▒ etilen lß║Łp th├Ānh d├Ży ─æß╗ōng ─æß║│ng gß╗Źi l├Ā d├Ży ─æß╗ōng ─æß║│ng cß╗¦a etilen.
- C├┤ng thß╗®c ph├ón tß╗Ł chung CnH2n ( n Ōēź 2 )
(Tß╗½ C2H4, theo kh├Īi niß╗ćm ─æß╗ōng ─æß║│ng: C2H4(CH2)k ŌåÆ C2+kH4+2k ─æß║Ęt 2 + k = n th├¼ c├┤ng thß╗®c ph├ón tß╗Ł chung cß╗¦a anken l├Ā: CnH2n (\(n \ge 2\))
1.1.2. ─Éß╗ōng ph├ón
a) ─Éß╗ōng ph├ón cß║źu tß║Īo
- ─Éß╗ōng ph├ón vß╗ŗ tr├Ł li├¬n kß║┐t ─æ├┤i
CH2=CH-CH2-CH3
CH3-CH=CH-CH3
- ─Éß╗ōng ph├ón mß║Īch cacbon
b) ─Éß╗ōng ph├ón h├¼nh hß╗Źc
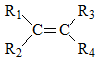
─Éiß╗üu kiß╗ćn: \(\begin{array}{l} {R_1} \ne {R_2}\\ {R_3} \ne {R_4} \end{array}\)
- ─Éß╗ōng ph├ón cis: Khi mß║Īch ch├Łnh nß║▒m c├╣ng mß╗Öt ph├Ła cß╗¦a li├¬n kß║┐t C=C.
- ─Éß╗ōng ph├ón trans: Khi mß║Īch ch├Łnh nß║▒m ß╗¤ ph├Ła kh├Īc nhau cß╗¦a li├¬n kß║┐t C=C.
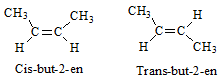
1.1.3. Danh ph├Īp
a) T├¬n th├┤ng thŲ░ß╗Øng
T├¬n anken = T├¬n ankan ─æß╗Ģi ─æu├┤i an th├Ānh ilen
V├Ł dß╗ź :
CH2=CH2: Etilen
CH2=CH-CH3 Propilen
b) Tên thay thế
T├¬n anken = T├¬n ankan ─æß╗Ģi ─æu├┤i an th├Ānh en
*Quy tắc:
- Chß╗Źn mß║Īch ch├Łnh l├Ā mß║Īch C d├Āi nhß║źt c├│ chß╗®a li├¬n kß║┐t ─æ├┤i.
- ─É├Īnh sß╗æ C mß║Īch ch├Łnh tß╗½ ph├Ła gß║¦n li├¬n kß║┐t ─æ├┤i nhß║źt.
- Gß╗Źi t├¬n theo thß╗® tß╗▒:
Sß╗æ chß╗ē vß╗ŗ tr├Ł nh├Īnh + t├¬n nh├Īnh + t├¬n C mß║Īch ch├Łnh + sß╗æ chß╗ē li├¬n kß║┐t ─æ├┤i + en
*V├Ł dß╗ź:
CH2=CH2: Eten
CH2=CH-CH3 : Propen
CH2=CH-CH2-CH3 But-1-en
CH3-CH=CH-CH3 But-2-en
1.2. T├Łnh chß║źt vß║Łt l├Ł
- Tß╗½ C2H4 ŌåÆ C4H8: l├Ā chß║źt kh├Ł
- Tß╗½ C5H10 trß╗¤ ─æi l├Ā chß║źt lß╗Ång hoß║Ęc chß║źt rß║»n.
- Nhiß╗ćt ─æß╗Ö n├│ng chß║Ży , nhiß╗ćt ─æß╗Ö s├┤i v├Ā khß╗æi lŲ░ß╗Żng ri├¬ng t─āng dß║¦n theo chiß╗üu t─āng cß╗¦a ph├ón tß╗Ł khß╗æi.
- C├Īc anken ─æß╗üu nhß║╣ hŲĪn nŲ░ß╗øc v├Ā kh├┤ng tan trong nŲ░ß╗øc
1.3. T├Łnh chß║źt h├│a hß╗Źc
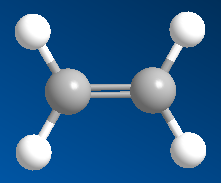
H├¼nh 1: M├┤ h├¼nh ph├ón tß╗Ł etilen
-
─Éß║Ęc ─æiß╗ām cß║źu tß║Īo cß╗¦a anken c├│ mß╗Öt li├¬n kß║┐t ─æ├┤i C=C (gß╗ōm mß╗Öt li├¬n kß║┐t \(\sigma\) bß╗ün vß╗»ng v├Ā mß╗Öt li├¬n kß║┐t \(\pi\) k├®m bß╗ün)
-
Dß╗▒ ─æo├Īn t├Łnh chß║źt h├│a hß╗Źc cß╗¦a anken
-
Li├¬n kß║┐t ─æ├┤i l├Ā trung t├óm phß║Żn ß╗®ng.
-
Phß║Żn ß╗®ng ph├Ī vß╗Ī li├¬n kß║┐t \(\pi\) k├®m bß╗ün.
-
1.3.1. Phß║Żn ß╗®ng cß╗Öng
Phß║Żn ß╗®ng cß╗Öng l├Ā phß║Żn ß╗®ng trong ─æ├│ ph├ón tß╗Ł hß╗Żp chß║źt hß╗»u cŲĪ kß║┐t hß╗Żp vß╗øi ph├ón tß╗Ł kh├Īc tß║Īo th├Ānh ph├ón tß╗Ł hß╗Żp chß║źt mß╗øi.
a) Cß╗Öng hi─ær├┤ (Phß║Żn ß╗®ng hi─æro ho├Ī)
CnH2n + H2 .PNG)
CH2=CH2 + H2 .PNG)
CH3-CH=CH2 + H2 
.PNG)
b) Cß╗Öng halogen (Phß║Żn ß╗®ng halogen ho├Ī)
CnH2n + Br2 ŌåÆ CnH2nBr2
Anken l├Ām mß║źt m├Āu cß╗¦a dung dß╗ŗch brom ŌåÆ Phß║Żn ß╗®ng n├Āy d├╣ng ─æß╗ā nhß║Łn biß║┐t anken.
Video 1: Etilen t├Īc dß╗źng vß╗øi dung dß╗ŗch Brom
CH2=CH2 + Br2 ŌåÆ BrCH2 - CH2Br
(M├Āu n├óu ─æß╗Å) 1,2-─æibrometan
(Kh├┤ng m├Āu)
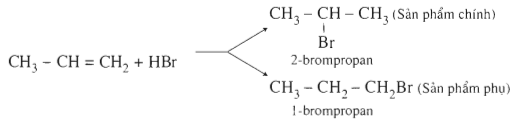
c) Cß╗Öng HX (X l├Ā OH, Cl, Br,ŌĆ”)
CH2=CH2 + HBr ŌåÆ CH3-CH2Br
CH2=CH2 + H-OH 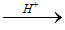
Qui tắc Mac-côp-nhi-côp:
Trong phß║Żn ß╗®ng cß╗Öng HX v├Āo li├¬n kß║┐t ─æ├┤i,nguy├¬n tß╗Ł H (hay phß║¦n mang ─æiß╗ćn t├Łch dŲ░ŲĪng) chß╗¦ yß║┐u cß╗Öng v├Āo nguy├¬n tß╗Ł cacbon bß║Łc thß║źp hŲĪn (c├│ nhiß╗üu H hŲĪn), c├▓n nguy├¬n tß╗Ł hay nh├│m nguy├¬n tß╗Ł X (phß║¦n mang ─æiß╗ćn t├Łch ├óm) cß╗Öng v├Āo nguy├¬n tß╗Ł cacbon bß║Łc cao hŲĪn (c├│ ├Łt H hŲĪn).
1.3.2. Phß║Żn ß╗®ng tr├╣ng hß╗Żp
nCH2=CH2 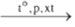
- Phß║Żn ß╗®ng tr├╣ng hß╗Żp l├Ā qu├Ī tr├¼nh kß║┐t hß╗Żp li├¬n tiß║┐p nhiß╗üu ph├ón tß╗Ł nhß╗Å giß╗æng nhau hoß║Ęc tŲ░ŲĪng tß╗▒ nhau tß║Īo th├Ānh nhß╗»ng ph├ón tß╗Ł rß║źt lß╗øn gß╗Źi l├Ā polime .
- Chß║źt ─æß║¦u (CH2=CH2) gß╗Źi l├Ā monome, -CH2ŌĆōCH2- gß╗Źi l├Ā mß║»c x├Łch cß╗¦a polime, n l├Ā hß╗ć sß╗æ tr├╣ng hß╗Żp.
- tên polime = poli + tên monome
1.3.3. Phß║Żn ß╗®ng oxi h├│a
a) Oxi ho├Ī ho├Ān to├Ān
Phß║Żn ß╗®ng ─æß╗æt ch├Īy anken: sß╗æ mol CO2 = sß╗æ mol H2O
b) Oxi ho├Ī kh├┤ng ho├Ān to├Ān
Anken l├Ām mß║źt m├Āu dd KMnO4 ŌåÆ D├╣ng ─æß╗ā nhß║Łn biß║┐t anken
1.4. Điều chế
1.4.1. Trong ph├▓ng th├Ł nghiß╗ćm
Etilen ─æŲ░ß╗Żc ─æiß╗üu chß║┐ tß╗½ ancol etylic theo phŲ░ŲĪng tr├¼nh:
C2H5OH 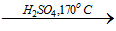
Video 2: Điều chế etilen từ ancol etylic
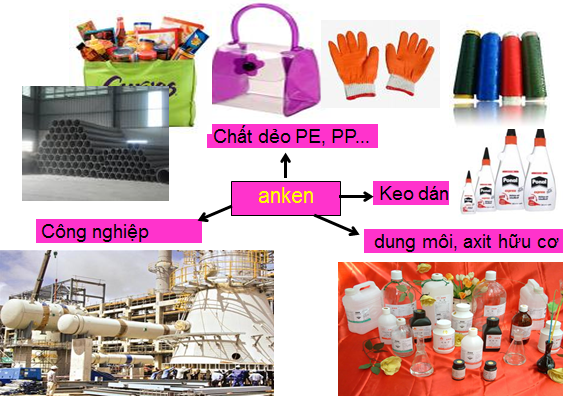
1.4.2. Trong c├┤ng nghiß╗ćp
Anken ─æŲ░ß╗Żc ─æiß╗üu chß║┐ tß╗½ ankan
CnH2n+2 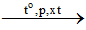
- Nguy├¬n liß╗ću cho tß╗Ģng hß╗Żp h├│a hß╗Źc: keo d├Īn, axit hß╗»u cŲĪ
- Tß╗Ģng hß╗Żp polime: PVC, PVA, PE ...
- L├Ām dung m├┤i ...
H├¼nh 2: ß╗©ng dß╗źng cß╗¦a anken
B├Āi tß║Łp minh hß╗Źa
B├Āi 1:
Sß╗æ ─æß╗ōng ph├ón cß║źu tß║Īo cß╗¦a C4H8 l├Ā:
HŲ░ß╗øng dß║½n:
- ─Éß╗ōng ph├ón cß║źu tß║Īo anken: CH2=CH-CH2-CH3; CH3-CH=CH-CH3; CH2=C(CH3)2
- ─Éß╗ōng ph├ón xicloankan:
ŌĆŗŌĆŗ
B├Āi 2:
Hß╗Śn hß╗Żp X gß╗ōm H2 v├Ā mß╗Öt anken (l├Ā chß║źt kh├Ł ß╗¤ ─æiß╗üu kiß╗ćn thŲ░ß╗Øng) c├│ sß╗æ mol bß║▒ng nhau. Dß║½n X qua Ni nung n├│ng, thu ─æŲ░ß╗Żc hß╗Śn hß╗Żp Y c├│ tß╗ē khß╗æi so vß╗øi He bß║▒ng 11,6. Hiß╗ću suß║źt cß╗¦a phß║Żn ß╗®ng hi─æro h├│a l├Ā:
HŲ░ß╗øng dß║½n:
Giß║Ż sß╗Ł X gß╗ōm 1 mol H2 v├Ā 1 mol CnH2n
CnH2n + H2 ŌåÆ CnH2n+2
x ŌåÆ x x (mol)
Sau phß║Żn ß╗®ng c├▓n: (1 ŌĆō x) mol H2; (1 ŌĆō x) mol CnH2n v├Ā x mol CnH2n+2
mX = mY ŌćÆ 14n + 2 = (2 ŌĆō x)11,6 ├Ś 4
Do x < ŌćÆ 14n + 2 > 46,4 ŌćÆ n > 3,16
M├Ā anken n├Āy ß╗¤ thß╗ā kh├Ł ŌćÆ n Ōēż 4 ŌćÆ n = 4 TM
ŌćÆ x = 0,75 mol
ŌćÆ Hpß╗® = 75%
B├Āi 3:
─Éß╗æt ch├Īy ho├Ān to├Ān 8,96 l├Łt (─æktc) hß╗Śn hß╗Żp hai anken X v├Ā Y l├Ā ─æß╗ōng ─æß║│ng li├¬n tiß║┐p thu ─æŲ░ß╗Żc m gam nŲ░ß╗øc v├Ā (m+39)gam CO2. C├┤ng thß╗®c ph├ón tß╗Ł cß╗¦a hai anken X v├Ā Y l├Ā?
HŲ░ß╗øng dß║½n:
─Éß╗æt ch├Īy anken cho \(n_{H_{2}O}=n_{CO_{2}}\rightarrow \frac{m}{18}=\frac{m+39}{44}\Rightarrow m=27\)
\(n_{CO_{2}}=\frac{27+39}{44}=1,5 mol,n_{hh}=\frac{8,96}{22,4}=0,4 mol\)
─Éß║Ęt hai c├┤ng thß╗®c chung cß╗¦a hai anken l├Ā:
\({C_{\overline n }}{H_{2\overline n }} + \frac{{3\bar n}}{2}{O_2} \to \bar nC{O_2} + \bar n{H_2}O\)
\(0,4\hspace{80pt}0,4\bar{n}\)
\(n_{CO_{2}}=0,4\bar{n}=1,5\Rightarrow \bar{n}=3,75\)
C├┤ng thß╗®c hai anken l├Ā: C4H8 v├Ā C3H6
B├Āi 4:
Hß╗Śn hß╗Żp kh├Ł X gß╗ōm H2 v├Ā mß╗Öt anken c├│ khß║Ż n─āng cß╗Öng HBr cho sß║Żn phß║®m hß╗»u cŲĪ duy nhß║źt. Tß╗ē khß╗æi cß╗¦a X so vß╗øi H2 bß║▒ng 9,1. ─Éun n├│ng X c├│ x├║c t├Īc Ni, sau khi phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān, thu ─æŲ░ß╗Żc hß╗Śn hß╗Żp kh├Ł Y kh├┤ng l├Ām mß║źt m├Āu nŲ░ß╗øc brom; tß╗ē khß╗æi cß╗¦a Y so vß╗øi H2 bß║▒ng 13. C├┤ng thß╗®c cß║źu tß║Īo cß╗¦a anken l├Ā:
HŲ░ß╗øng dß║½n:
\(\\ M_{X} = 18,3; \ M_{Y}= 26 \\ n_{X} = 1 \ mol \Rightarrow m_{Y}=m_{X}=9,1.2=18,2 \ g \\ n_{Y} = \frac{18,2}{26}=0,7 \ mol \Rightarrow n_{H_{2} \ pu}= 1-0,7=0,3 \ mol\)
\(\\ \Rightarrow Y\left\{\begin{matrix} C_{n}H_{2n+2} : 0,3 \\ H_{2}:0,4 \ \ \ \ \ \ \ \end{matrix}\right. \\ (14n+2).0,3 +2. 0,4 =18,2 \Rightarrow n=4 \Rightarrow anken: C_{4}H_{8}\)
Anken c├│ khß║Ż n─āng cß╗Öng HBr cho sß║Żn phß║®m hß╗»u cŲĪ duy nhß║źt CH3ŌĆōCH=CHŌĆōCH3
3. Luyß╗ćn tß║Łp B├Āi 29 H├│a hß╗Źc 11
Sau b├Āi hß╗Źc cß║¦n nß║»m:
- ─Éß╗ōng ─æß║│ng, ─æß╗ōng ph├ón, danh ph├Īp anken
- T├Łnh chß║źt vß║Łt l├Ł, h├│a hß╗Źc cß╗¦a anken nhŲ░ phß║Żn ß╗®ng cß╗Öng (cß╗Öng hidro, cß╗Öng halogen, cß╗Öng HX, ...), hiß╗āu vß╗ü quy tß║»c Maccopnhicop, phß║Żn ß╗®ng tr├╣ng hß╗Żp, phß║Żn ß╗®ng oxi h├│a ho├Ān to├Ān v├Ā kh├┤ng ho├Ān to├Ān
- ─Éiß╗üu chß║┐ v├Ā ß╗®ng dß╗źng anken.
3.1. Trß║»c nghiß╗ćm
B├Āi kiß╗ām tra Trß║»c nghiß╗ćm H├│a hß╗Źc 11 B├Āi 29 c├│ phŲ░ŲĪng ph├Īp v├Ā lß╗Øi giß║Żi chi tiß║┐t gi├║p c├Īc em luyß╗ćn tß║Łp v├Ā hiß╗āu b├Āi.
-
- A. Etilen
- B. Butilen
- C. Hexilen
- D. Tß║źt cß║Ż c├Īc anken
-
- A. Dung dß╗ŗch Brom dŲ░
- B. Dung dß╗ŗch Ba(OH)2 dŲ░
- C. Dung dß╗ŗch H2SO4
- D. Dung dß╗ŗch KMnO4 lo├Żng dŲ░.
-
- A. 8.
- B. 10.
- C. 11.
- D. 9.
C├óu 4-10: Mß╗Øi c├Īc em ─æ─āng nhß║Łp xem tiß║┐p nß╗Öi dung v├Ā thi thß╗Ł Online ─æß╗ā cß╗¦ng cß╗æ kiß║┐n thß╗®c vß╗ü b├Āi hß╗Źc n├Āy nh├®!
3.2. B├Āi tß║Łp SGK v├Ā N├óng cao
C├Īc em c├│ thß╗ā hß╗ć thß╗æng lß║Īi nß╗Öi dung b├Āi hß╗Źc th├┤ng qua phß║¦n hŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp H├│a hß╗Źc 11 B├Āi 29.
B├Āi tß║Łp 1 trang 132 SGK H├│a hß╗Źc 11
B├Āi tß║Łp 2 trang 132 SGK H├│a hß╗Źc 11
B├Āi tß║Łp 3 trang 132 SGK H├│a hß╗Źc 11
B├Āi tß║Łp 4 trang 132 SGK H├│a hß╗Źc 11
B├Āi tß║Łp 5 trang 132 SGK H├│a hß╗Źc 11
B├Āi tß║Łp 6 trang 132 SGK H├│a hß╗Źc 11
B├Āi tß║Łp 29.1 trang 44 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.2 trang 44 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.3 trang 44 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.4 trang 44 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.5 trang 45 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.6 trang 45 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.7 trang 45 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.8 trang 45 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.9 trang 45 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.10 trang 45 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.11 trang 45 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.12 trang 46 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.13 trang 46 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 29.14 trang 46 SBT H├│a hß╗Źc 11
B├Āi tß║Łp 1 trang 158 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 2 trang 158 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 3 trang 158 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 4 trang 158 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 5 trang 158 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 1 trang 164 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 2 trang 164 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 3 trang 164 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 4 trang 164 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 5 trang 164 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 6 trang 164 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 7 trang 165 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 8 trang 165 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 9 trang 165 SGK H├│a hß╗Źc 11 n├óng cao
B├Āi tß║Łp 10 trang 165 SGK H├│a hß╗Źc 11 n├óng cao
4. Hß╗Åi ─æ├Īp vß╗ü B├Āi 29 ChŲ░ŲĪng 6 H├│a hß╗Źc 11
Trong qu├Ī tr├¼nh hß╗Źc tß║Łp nß║┐u c├│ bß║źt k├¼ thß║»c mß║»c g├¼, c├Īc em h├Ży ─æß╗ā lß║Īi lß╗Øi nhß║»n ß╗¤ mß╗źc Hß╗Åi ─æ├Īp ─æß╗ā c├╣ng cß╗Öng ─æß╗ōng H├│a HOC247 thß║Żo luß║Łn v├Ā trß║Ż lß╗Øi nh├®.





.PNG)