Hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Bài 12 Bài 12: Phản ứng oxi hóa khử và ứng dụng trong cuộc sống môn Hóa học lớp 10 CTST giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Giải câu hỏi 1 trang 72 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 12.1, hãy viết quá trình nhường và nhận electron trong phản ứng giữa magnesium và oxygen
.jpg)
Hình 12.1. Magnesium phản ứng với oxygen
-
Giải câu hỏi 2 trang 73 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 12.2a, hydrogen cháy trong chlorine với ngọn lửa sáng, tạo hợp chất hydrogen chlorine (HCl). Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl (Hình 12.2b), hãy xác định điện tích của các nguyên tử trong phân tử HCl
.jpg)
Hình 12.2. Hydrogen phản ứng với chlorine (a) và công thức electron của phân tử hydrogen chloride (b)
-
Giải câu hỏi 3 trang 73 SGK Hóa học 10 Chân trời sáng tạo - CTST
Nêu điểm khác nhau giữa kí hiệu số oxi hóa và kí hiệu điện tích của ion M trong hình sau:
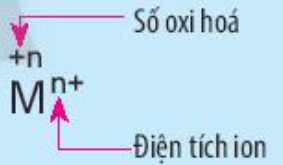
-
Giải câu hỏi 4 trang 73 SGK Hóa học 10 Chân trời sáng tạo - CTST
Dự đoán số oxi hóa của các nguyên tử trong nhóm IA, IIA, IIIA trong các hợp chất. Giải thích.
-
Luyện tập trang 73 SGK Hóa học 10 Chân trời sáng tạo - CTST
Hãy xác định số oxi hóa của các nguyên tử trong các đơn chất, hợp chất và ion sau: Zn, H2, Cl-, O2-, S2-, HSO4-, Na2S2O3, KNO3
-
Luyện tập trang 74 SGK Hóa học 10 Chân trời sáng tạo - CTST
Magnetite là khoáng vật sắt từ có hàm lượng sắt cao nhất được dùng trong ngành luyện gang, thép, với công thức hóa học là Fe3O4

Hãy xác định số oxi hóa của nguyên tử Fe trong hợp chất trên
-
Giải câu hỏi 5 trang 75 SGK Hóa học 10 Chân trời sáng tạo - CTST
Hãy nhận xét và giải thích sự thay đổi số oxi hóa của các nguyên tử trong chất oxi hóa và chất khử trước và sau phản ứng.
-
Luyện tập trang 75 SGK Hóa học 10 Chân trời sáng tạo - CTST
Cho phương trình hóa học của các phản ứng sau:
H2S + Br2 → 2HBr + S↓ (1)
2KClO3 2KCl + 3O2↑ (2)
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O (3)
Phản ứng nào là phản ứng oxi hóa – khử? Vì sao? Hãy xác định quá trình oxi hóa và quá trình khử của các phản ứng đó
-
Giải câu hỏi 6 trang 76 SGK Hóa học 10 Chân trời sáng tạo - CTST
Làm thế nào để biết một phản ứng là phản ứng oxi hóa – khử?
-
Luyện tập trang 76 SGK Hóa học 10 Chân trời sáng tạo - CTST
Hãy nêu 3 ví dụ về phản ứng có sự thay đổi số oxi hóa của nguyên tử và 3 ví dụ về phản ứng không có sự thay đổi số oxi hóa của nguyên tử
-
Luyện tập trang 77 SGK Hóa học 10 Chân trời sáng tạo - CTST
Lập phương trình hóa học của các phản ứng oxi hóa – khử sau, xác định vai trò của các chất tham gia phản ứng.
\(KMn{O_4} + HCl \to KCl + MnC{l_2} + C{l_2} \uparrow + {H_2}O(1)\)
\(N{H_3} + B{r_2} \to {N_2} + HBr(2)\)
\(N{H_3} + CuO\xrightarrow{{{t^o}}}Cu + {N_2} + {H_2}O(3)\)
\(Fe{S_2} + {O_2}\xrightarrow{{{t^o}}}F{e_2}{O_3} + S{O_2}(4)\)
\(KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}KCl + {O_2} \uparrow \)(5)
-
Giải câu hỏi 7 trang 77 SGK Hóa học 10 Chân trời sáng tạo - CTST
Lập phương trình hóa học của phản ứng đốt cháy gas trong không khí và phản ứng kích nổ hỗn hợp nhiên liệu của tàu con thoi. Xác định vai trò của các chất trong mỗi phản ứng
-
Giải câu hỏi 8 trang 78 SGK Hóa học 10 Chân trời sáng tạo - CTST
Quan sát Hình 12.7 và độc thông tin, hãy lập phương trình hóa học của phản ứng quang hợp ở cây xanh. Quá trình quang hợp của thực vật có vai trò quan trọng như thế nào đối với cuộc sống?

Hình 12.7. Quá trình quang hợp của cây xanh
-
Giải câu hỏi 9 trang 78 SGK Hóa học 10 Chân trời sáng tạo - CTST
Từ thông tin về “Luyện kim”, viết phản ứng của khí carbon monoxide khử iron (III) oxide ở nhiệt độ cao. Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron, xác định vai trò của các chất trong phản ứng?
-
Giải câu hỏi 10 trang 78 SGK Hóa học 10 Chân trời sáng tạo - CTST
Đọc thông tin về “Điện hóa” để biết được phản ứng oxi hóa – khử gắn liền với cuộc sống. Lập phương trình hóa học của phản ứng sinh ra dòng điện trong pin khi zinc phản ứng với manganese.
-
Vận dụng trang 78 SGK Hóa học 10 Chân trời sáng tạo - CTST
Hãy nêu thêm một số phản ứng oxi hóa – khử quan trọng gắn với đời sống hằng ngày
-
Giải bài 1 trang 79 SGK Hóa học 10 Chân trời sáng tạo - CTST
Tính số oxi hóa của nguyên tử có đánh dấu * trong các chất và ion dưới đây
a) \({K_2}\mathop {C{r_2}}\limits^* {O_7},\,K\mathop {Mn}\limits^* {O_4},\,K\mathop {Cl}\limits^* {O_4},\,\mathop N\limits^* {H_4}N{O_3}\)
b) \(\mathop {Al}\limits^* O_2^ - ,\,\mathop P\limits^* O_4^{3 - },\,\mathop {Cl}\limits^* O_3^ - ,\,\mathop S\limits^* O_4^{2 - }\)
-
Giải bài 2 trang 79 SGK Hóa học 10 Chân trời sáng tạo - CTST
Lập phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử trong mỗi trường hợp
a) \(HCl + Mn{O_2}\xrightarrow{{{t^o}}}MnC{l_2} + C{l_2} \uparrow + {H_2}O\)
b) \(KMn{O_4} + KN{O_2} + {H_2}S{O_4} \to MnS{O_4} + KN{O_3} + {K_2}S{O_4} + {H_2}O\)
c) \(F{e_3}{O_4} + HN{O_3} \to Fe{(N{O_3})_3} + NO \uparrow + {H_2}O\)
d) \({H_2}{C_2}{O_2} + KMn{O_4} + {H_2}S{O_4} \to C{O_2} \uparrow + MnS{O_4} + {K_2}S{O_4} + {H_2}O\)
-
Giải bài 3 trang 79 SGK Hóa học 10 Chân trời sáng tạo - CTST
Có nhiều hiện tượng xảy ra xung quanh ta, em hãy nêu hai phản ứng oxi hóa - khử gắn liền với cuộc sống hàng ngày và lập phương trình hóa học của các phản ứng đó bằng phương pháp thăng bằng electron.
-
Giải bài 4 trang 79 SGK Hóa học 10 Chân trời sáng tạo - CTST
Viết phương trình hóa học của phản ứng điều chế muối zinc chloride (ZnCl2) bằng một phản ứng oxi hóa - khử và một phản ứng không phải là phản ứng oxi hóa - khử
-
Giải bài 5 trang 79 SGK Hóa học 10 Chân trời sáng tạo - CTST
Nhiên liệu rắn dành cho tên lửa tăng tốc của tàu vũ trụ con thoi là hỗn hợp gồm ammonium perchlorate (NH4ClO4) và bột nhôm. Khi được đốt đến trên 200oC, ammonium perchlorate nổ theo phản ứng sau:
NH4ClO4 → N2 + Cl2 + O2 + H2O
Lập phương trình hóa học của phản ứng bằng phương pháp thăng bằng electron
-
Giải bài 12.1 trang 44 SBT Hóa học 10 Chân trời sáng tạo - CTST
Số oxi hoá của nguyên tử S trong hợp chất SO2 là
A. +2. B. +4. C. +6. D. -1.
-
Giải bài 12.2 trang 44 SBT Hóa học 10 Chân trời sáng tạo - CTST
Dấu hiệu đề nhận ra phản ứng là phản ứng oxi hoá – khử dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A. Số mol.
B. Số oxi hoá.
C. Số khối.
D. Số proton.
-
Giải bài 12.3 trang 44 SBT Hóa học 10 Chân trời sáng tạo - CTST
Calcium chloride dùng trong điện phân đề sản xuất calcium kim loại và điều chế các hợp kim của calcium. Với tính chất hút ẩm lớn, calcium chloride được dùng làm tác nhân sấy khí và chất lỏng. Do nhiệt độ đông đặc thấp nên dung dịch calcium(II) chloride được dùng làm chất tải lạnh trong các hệ thống lạnh,... Ngoài ra, calcium chloride còn được làm chất keo tụ trong hoá dược và dược phẩm hay trong công việc khoan dầu khí.

Trong phản ứng tạo thành calcium(II) chloride từ đơn chất: Ca + Cl2 -> CaCl2. Kết luận nào sau đây đúng?
A. Mỗi nguyên tử calcium nhận 2e.
B. Mỗi nguyên tử chlorine nhận 2e.
C. Mỗi phân tử chlorine nhường 2e.
D. Mỗi nguyên tử calcium nhường 2e.
-
Giải bài 12.4 trang 44 SBT Hóa học 10 Chân trời sáng tạo - CTST
Phản ứng nào sau đây có sự thay đổi số oxi hoá của nguyên tố calcium?
A. Ca(OH)2 + CuCl2 → Cu(OH)2 + CaCl2
B. CaCl2 → Ca + Cl2
C. 3CaCl2 + 2K3PO4 → Ca3(PO4)2 + 6KCl
D. CaO + 2HCl → CaCl2 + H2O
-
Giải bài 12.5 trang 45 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cho các phản ứng sau
(a) Ca(OH)2 + Cl2 -> CaOCl2 + H2O
(b) 2NO2 + 2NaOH -> NaNO3 + NaNO2 + H2O
(c) O3 + 2Ag -> Ag2O + O₂
(d) 2H2S + SO2 -> 3S + 2H2O
(e) 4KClO3 -> KCl + 3KClO4
Số phản ứng oxi hoá – khử là
A. 2.
B. 3.
C. 5.
D. 4.
-
Giải bài 12.6 trang 45 SBT Hóa học 10 Chân trời sáng tạo - CTST
Phương trình phản ứng nào sau đây không thể hiện tính khử của ammonia (NH3)?
A. 4NH3 + 5O2 -> 4NO + 6H2O
B. NH3 + HCl -> NH4Cl
C. 2NH3 + 3Cl2 -> 6HCl + N2
D. 4NH3 + 3O2 -> 2N2 + 6H2O
-
Giải bài 12.7 trang 45 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trong phản ứng: 3Cu + 8HNO3 " 3Cu(NO3)2 + 2NO + 4H2O. Số phân tử - nitric acid (HNO3) đóng vai trò chất oxi hoá là
A. 8.
B. 6.
C. 4.
D. 2.
-
Giải bài 12.8 trang 45 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trong thiên nhiên manganesium là nguyên tố tương đối phổ biến, đứng thứ ba trong các kim loại chuyển tiếp, chỉ sau Fe và Ti. Các khoáng vật chính của manganesium là hausmanite (Mn3O4), pyrolusite (MnO2), braunite (Mn2O3) và manganite (MnOOH). Manganesium tồn tại ở rất nhiều trạng thái oxi hoá khác nhau từ +2 tới +7.
Cho các chất sau: Mn, MnO2, MnCl2, KMnO4 Số oxi hoá của nguyên tố Mn trong các chất lần lượt là
A. 2, -2, -4, +8.
B. 0, +4, +2, +7.
C. 0, +4, -2, +7.
D. 0, +2, -4, -7.
-
Giải bài 12.9 trang 45 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trong thiên nhiên manganesium là nguyên tố tương đối phổ biến, đứng thứ ba trong các kim loại chuyển tiếp, chỉ sau Fe và Ti. Các khoáng vật chính của manganesium là hausmanite (Mn3O4), pyrolusite (MnO2), braunite (Mn2O3) và manganite (MnOOH). Manganesium tồn tại ở rất nhiều trạng thái oxi hoá khác nhau từ +2 tới +7.
Phản ứng nào sau đây không có sự thay đổi số oxi hoá của nguyên tố Mn?
A. MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
B. Mn + O2 -> MnO2
C. 2HCl + MnO -> MnCl2 + H2O
D. 6KI + 2KMnO4 + 4H2O -> 3I2 + 2MnO2 + 8KOH
-
Giải bài 12.10 trang 46 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trong thiên nhiên manganesium là nguyên tố tương đối phổ biến, đứng thứ ba trong các kim loại chuyển tiếp, chỉ sau Fe và Ti. Các khoáng vật chính của manganesium là hausmanite (Mn3O4), pyrolusite (MnO2), braunite (Mn2O3) và manganite (MnOOH). Manganesium tồn tại ở rất nhiều trạng thái oxi hoá khác nhau từ +2 tới +7.
Sục khí SO2 vào dung dịch KMnO4 (thuốc tím), màu tím nhạt dần rồi mất màu (biết sản phẩm tạo thành là MnSO4, H2SO4 và H2O). Nguyên nhân là do
A. SO2 đã oxi hoá KMnO4 thành MnO2.
B. SO2 đã khử KMnO4 thành Mn2+.
C. KMnO4 đã khử SO2 thành S+6.
D. H2O đã oxi hoá KMnO4 thành Mn2+.
-
Giải bài 12.11 trang 46 SBT Hóa học 10 Chân trời sáng tạo - CTST
Xác định số oxi hoá của các nguyên tố trong các chất và ion sau:
a) Fe, N2, SO3, H2SO4, CuS, Cu2S, Na2O2, H3AsO4.
b) Br2, O3, HClO3, KClO4, NaClO, NH4NO3, N2O, NaNO2.
c) Br-, PO43-, MnO4-, ClO3-, H2PO4-, SO42-, NH4+.
d) MnO2, K2MnO4, K2Cr2O7, K2CrO4, Cr2(SO4)3, NaCrO2.
e) FeS2, FeS, FeO, Fe2O3, Fe3O4, FexOy.
-
Giải bài 12.12 trang 46 SBT Hóa học 10 Chân trời sáng tạo - CTST
Viết các quá trình nhường hay nhận electron của các biến đổi trong các dãy sau:
a) \(\mathop S\limits^{ - 2} \to \mathop S\limits^0 \to \mathop S\limits^{ + 4} \to \mathop S\limits^{ + 6} \to \mathop S\limits^{ + 4} \)
b) \(\mathop N\limits^{ - 3} \to \mathop N\limits^0 \to \mathop N\limits^{ + 2} \to \mathop N\limits^{ + 4} \to \mathop N\limits^{ + 5} \to \mathop N\limits^{ + 2} \)
-
Giải bài 12.13 trang 46 SBT Hóa học 10 Chân trời sáng tạo - CTST
Phản ứng nào sau đây là phản ứng oxi hoá – khử? Giải thích.
a) SO3 + H2O → H2SO4
b) CaCO3 + 2HCl → CaCl2 + CO2 + H2O
c) C + H2O → CO + H2
d) CO2 + Ca(OH)2 → CaCO3 + H2O
e) Ca + 2H2O → Ca(OH)2 + H2
g) 2KMnO4 → K2MnO4 + MnO2 + O2↑
-
Giải bài 12.14 trang 46 SBT Hóa học 10 Chân trời sáng tạo - CTST
Gỉ sét là quá trình oxi hoá kim loại, mỗi năm phá huỷ khoảng 25 % sắt thép. Gỉ sét được hình thành do kim loại sắt (Fe) trong gang hay thép kết hợp với oxygen khi có mặt nước hoặc không khí ẩm. Trên bề mặt gang hay thép bị gỉ hình thành những lớp xốp và giòn dễ vỡ, thường có màu nâu, nâu đỏ hoặc đỏ. Lớp gỉ này không có tác dụng bảo vệ sắt ở phía trong. Sau thời gian dài, bất kỉìkhối sắt nào cũng sẽ bị gỉ hoàn toàn và phân huỷ. Thành phần chính của sắt gỉ gồm Fe(OH)2, Fe2O3.nH2O.
Một số phản ứng xảy ra trong quá trình gỉ sắt
Fe + O2 + H2O → Fe(OH)2(1)
Fe + O2 + H2O + CO2 → Fe(HCO3)2 (2)
Fe(HCO3)2 → Fe(OH)2 + CO2 (3)
Fe (OH)2 + O2 + H2O → Fe2O3.nH2O (4)
a) Phản ứng nào ở trên là phản ứng oxi hoá – khử?
b) Xác định sự thay đổi số oxi hoá của các nguyên tố, nêu rõ chất oxi hoá, chất khử.
c) Cân bằng phản ứng trên bằng phương pháp thăng bằng electron.
-
Giải bài 12.15 trang 47 SBT Hóa học 10 Chân trời sáng tạo - CTST
Rượu gạo là một thức uống có cồn lên men được chưng cất từ gạo theo truyền thống. Rượu gạo được làm từ quá trình lên men tinh bột gạo đã được chuyển thành đường. Vi khuẩn là nguồn gốc của các enzyme chuyển đổi tinh bột thành đường. Nhiệt độ phù hợp để lên men rượu khoảng 20 - 25°C.
Phản ứng thuỷ phân và phản ứng lên men.
(1) (C6H10O5)n + nH2O -> nC6H12O6
(2) C6H12O6 -> 2C2H5OH + 2CO2
a) Phản ứng nào ở trên là phản ứng oxi hoá – khử? Giải thích.
b) Trong phản ứng oxi hoá – khử, em hãy xác định số oxi hoá của các nguyên tố, nêu rõ chất oxi hoá, chất khử.
c) Cân bằng phản ứng oxi hoá – khử trên bằng phương pháp thăng bằng electron.
-
Giải bài 12.16 trang 47 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cân bằng phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hoá, chất khử trong mỗi trường hợp sau:
a) H2S + SO2 -> S + H2O
b) SO2 + H2O + Cl2 -> H2SO4 + HCl
c) FeS2 + O2 -> Fe2O3 + SO2
d) C12H22O11 + H2SO4 -> CO2 + SO2 + H2O
-
Giải bài 12.17 trang 48 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cho potassium iodide (KI) tác dụng với potassium permanganate (KMnO4) trong dung dịch sulfuric acid (H2SO4), thu được 3,02 g manganese(II) sulfate (MnSO4), I2 và K2SO4.
a) Tính số gam iodine (I2) tạo thành.
b) Tính khối lượng potassium iodide (KI) đã tham gia phản ứng.
-
Giải bài 12.18 trang 48 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hoà tan 14 g Fe trong dung dịch H2SO4 loãng, dư, thu được dung dịch X. Thêm dung dịch KMnO4 1 M vào dung dịch X. Biết KMnO4 có thể oxi hoá FeSO4 trong môi trường H2SO4 thành Fe2(SO4)3 và bị khử thành MnSO4. Phản ứng xảy ra hoàn toàn. Lập phương trình hoá học cho phản ứng oxi hoá - khử trên. Tính thể tích dung dịch KMnO4 1 M đã phản ứng.
-
Giải bài 12.19 trang 48 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nitric acid (HNO3) là hợp chất vô cơ, trong tự nhiên, được hình thành trong những con mưa giông kèm sấm chớp. Nitric acid là một acid độc, ăn mòn và dễ gây chảy là một trong những tác nhân gây ra mưa acid.
Thực hiện thí nghiệm xác định công thức của một oxide của kim loại sắt bằng nitric acid đặc nóng, thu được 2,479 lít (đkc) khí màu nâu là nitrogen dioxide. Phần dung dịch đem cô cạn thì được 72,6 g Fe(NO3)3. Giả sử phản ứng không tạo thành các sản phẩm khác (biết 1 mol khí chiếm 24,79 lít đo ở đkc 25°C, 1 bar).
a) Viết phản ứng và cân bằng bằng phương pháp thăng bằng electron.
b) Xác định công thức của iron oxide.
-
Giải bài 12.20 trang 48 SBT Hóa học 10 Chân trời sáng tạo - CTST
Có nhiều vụ tai nạn giao thông xảy ra do người lái xe uống rượu. Theo luật định, hàm lượng ethanol trong máu người lái xe không vượt quá 0,02% theo khối lượng. Để xác định hàm lượng ethanol trong máu của người lái xe cần chuẩn độ ethanol bằng K2Cr2O7 trong môi trường acid. Khi đó Cr+6 bị khử thành Cr+3, ethanol (C2H5OH) bị oxi hoá thành acetaldehyde (CH3CHO).
a) Hãy viết phương trình hoá học của phản ứng.
b) Khi chuẩn độ 25 g huyết tương máu của một lái xe cần dùng 20 mL dung dịch K2Cr2O7 0,01M. Người lái xe đó có vi phạm luật hay không? Tại sao? Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7.






