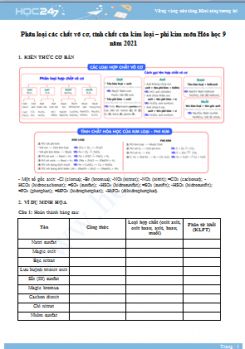
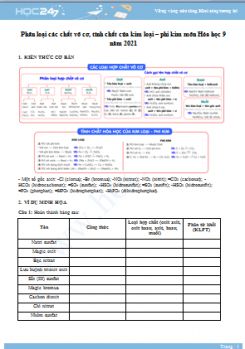
T├Āi liß╗ću PhŲ░ŲĪng ph├Īp giß║Żi mß╗Öt sß╗æ dß║Īng b├Āi tß║Łp h├│a hß╗Źc v├┤ cŲĪ bß║Łc THCS n─ām 2021 dŲ░ß╗øi ─æ├óy ─æŲ░ß╗Żc HOC247 bi├¬n soß║Īn v├Ā tß╗Ģng hß╗Żp nhß║▒m gi├║p c├Īc em tß╗▒ luyß╗ćn tß║Łp vß╗øi c├Īc c├óu hß╗Åi ─æa dß║Īng, ├┤n tß║Łp lß║Īi c├Īc kiß║┐n thß╗®c cß║¦n nß║»m mß╗Öt c├Īch hiß╗ću quß║Ż, chuß║®n bß╗ŗ thß║Łt tß╗æt cho c├Īc kß╗│ thi sß║»p tß╗øi. Mß╗Øi c├Īc em c├╣ng tham khß║Żo.
1. Dß║Īng 1: PhŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp x├Īc ─æß╗ŗnh c├┤ng thß╗®c ph├ón tß╗Ł hß╗Żp chß║źt v├┤ cŲĪ
1.1. Lß║Łp CTHH cß╗¦a hß╗Żp chß║źt khi biß║┐t % nguy├¬n tß╗æ v├Ā khß╗æi lŲ░ß╗Żng mol chß║źt
* PhŲ░ŲĪng ph├Īp:
- ─ÉŲ░a c├┤ng thß╗®c vß╗ü dß║Īng chung AxBy hoß║Ęc AxByCz (x, y, z nguy├¬n dŲ░ŲĪng)
- T├¼m MA, MB, MCŌĆ”
- ─Éß║Ęt ─æß║│ng thß╗®c: \(\frac{{{M_A}}}{{\% A}} = \frac{{{M_B}}}{{\% B}} = \frac{{{M_C}}}{{\% C}} = \frac{{{M_{chat}}}}{{100}}\)
- T├¼m x, y, z lß║Łp CTHH cß╗¦a hß╗Żp chß║źt.
* V├Ł dß╗ź cß╗ź thß╗ā:
Lß║Łp CTHH cß╗¦a hß╗Żp chß║źt c├│ th├Ānh phß║¦n
%K = 38,6 %;
%N = 13,8%
% 0 = 47,6% biß║┐t khß╗æi lŲ░ß╗Żng mol hß╗Żp chß║źt l├Ā 101g.
Giß║Żi
Gß╗Źi CTHH cß╗¦a hß╗Żp chß║źt l├Ā KxNyOx (x, y, z nguy├¬n dŲ░ŲĪng)
Biß║┐t MK = x; MN = 14y; M0 = 16z; Mchß║źt = 101g
Ta c├│: \(\frac{{39x}}{{38,6}} = \frac{{14y}}{{13,8}} = \frac{{16z}}{{47,6}} = \frac{{101}}{{100}} = 1,01\)
x = (38,6.1,01)/39 1
y = (13,8.1,01)/14 1
z = (47,6.1,01)/16 3
Vß║Ły CTHH cß╗¦a hß╗Żp chß║źt: KNO3
1.2. Lß║Łp CTHH dß╗▒a v├Āo th├Ānh phß║¦n % khß╗æi lŲ░ß╗Żng nguy├¬n tß╗æ.
* PhŲ░ŲĪng ph├Īp:
- ─ÉŲ░a c├┤ng thß╗®c vß╗ü dß║Īng chung AxByCz (x, y , z nguy├¬n dŲ░ŲĪng)
- Tìm MA; MB; MC.
- ─Éß║Ęt tß╗ē lß╗ć: MA : MB : MC = %A : %B : %C
- T├¼m x, y, z lß║Łp c├┤ng thß╗®c ─æŲĪn giß║Żn cß╗¦a hß╗Żp chß║źt.
* V├Ł dß╗ź cß╗ź thß╗ā: T├¼m c├┤ng thß╗®c ─æŲĪn giß║Żn cß╗¦a hß╗Żp chß║źt A gß╗ōm 43,4%Na, 11,3%C, 43,5%O.
Giß║Żi
Gß╗Źi CTHH cß╗¦a A l├Ā NaxCyOz (x, y, z nguy├¬n dŲ░ŲĪng).
Biết MNa = 23x; MC = 12y; MO = 16z
Ta c├│: 23x : 12y : 16z = 43,4 : 11,3 : 43,5
x : y : z = \(\frac{{43,4}}{{23}}:\frac{{11,3}}{{12}}:\frac{{43,5}}{{16}} = 1,88:0,94:2,85\)
x : y : z = 2 : 1 : 3
=> x = 1; y = 1; z = 4. Vß║Ły c├┤ng thß╗®c ─æŲĪn giß║Żn cß╗¦a A l├Ā Na2CO3
1.3. Lß║Łp CTHH dß╗▒a v├Āo sß╗æ phß║¦n khß╗æi lŲ░ß╗Żng nguy├¬n tß╗æ.
* PhŲ░ŲĪng ph├Īp:
- ─ÉŲ░a c├┤ng thß╗®c vß╗ü dß║Īng chung AxByCz (x, y , z nguy├¬n dŲ░ŲĪng)
- Tìm MA; MB; MC.
- ─Éß║Ęt tß╗ē lß╗ć: MA : MB : MC = mA : mB : mC
- T├¼m x, y, z . T├¼m c├┤ng thß╗®c ─æŲĪn giß║Żn cß╗¦a hß╗Żp chß║źt.
* V├Ł dß╗ź cß╗ź thß╗ā: T├¼m CTHH cß╗¦a hß╗Żp chß║źt A biß║┐t rß║▒ng trong th├Ānh phß║¦n gß╗ōm 112 phß║¦n khß╗æi lŲ░ß╗Żng nguy├¬n tß╗æ Sß║»t kß║┐t hß╗Żp vß╗øi 48 phß║¦n khß╗æi lŲ░ß╗Żng nguy├¬n tß╗æ ├┤xi.
Giß║Żi
Gß╗Źi c├┤ng thß╗®c ho├Ī hß╗Źc cß╗¦a A l├Ā: FexOy (x, y nguy├¬n dŲ░ŲĪng)
Ta c├│: MFe = 56x; MO = 16y
56x : 16y = 112 : 48
x : y = \(\frac{{112}}{{56}}:\frac{{48}}{{16}} = 2:3\)
Vß║Ły x = 2; y = 3 => CTHH ─æŲĪn giß║Żn cß╗¦a A l├Ā Fe2O3
1.4. Lß║Łp CTHH dß╗▒a v├Āo PTHH.
* PhŲ░ŲĪng ph├Īp:
- ─Éß╗Źc kß╗╣ ─æß╗ü, x├Īc ─æß╗ŗnh CTHH cß╗¦a chß║źt tham gia v├Ā sß║Żn phß║®m.
- Viết PTHH
- Dß╗▒a v├Āo lŲ░ß╗Żng cß╗¦a c├Īc chß║źt ─æ├Ż cho t├Łnh theo PTHH. T├¼m M nguy├¬n tß╗æ.
* V├Ł dß╗ź cß╗ź thß╗ā: Cho 5,6 gam kim loß║Īi A ho├Ī trß╗ŗ II t├Īc dß╗źng vß╗øi dung dß╗ŗch H2SO4 lo├Żng dŲ░ thß║źy giß║Żi ph├│ng 2,24l├Łt H2 (─ÉKTC). H├Ży x├Īc ─æß╗ŗnh kim loß║Īi A.
Giß║Żi
nH2 = 2,24 : 22,4 = 0,1mol
PTHH: A + H2SO4 ŌåÆ ASO4 + H2
Theo PTPŲ»: 1mol 1mol
Theo b├Āi ra: 0,1mol 0,1mol
MA = \(\frac{m}{n} = \frac{{5,6}}{{0,1}} = 56(g)\)
Vß║Ły A l├Ā nguy├¬n tß╗æ Fe.
2. Dß║Īng 2: PhŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp t├Łnh theo PTHH dß╗▒a v├Āo lŲ░ß╗Żng cß╗¦a mß╗Öt chß║źt tham gia hoß║Ęc sß║Żn phß║®m
* PhŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp t├Łnh theo PTHH dß╗▒a v├Āo lŲ░ß╗Żng mß╗Öt chß║źt.
- Chuyß╗ān ─æß╗Ģi c├Īc lŲ░ß╗Żng chß║źt ─æ├Ż cho ra sß╗æ mol.
- Lß║Łp PTHH
- Viß║┐t tß╗ē lß╗ć mol c├Īc chß║źt.
- Dß╗▒a v├Āo sß╗æ mol chß║źt ─æ├Ż cho t├¼m sß╗æ mol chß║źt cß║¦n biß║┐t.
- T├Łnh c├Īc lŲ░ß╗Żng chß║źt theo y├¬u cß║¦u cß╗¦a ─æß╗ü b├Āi.
2.1. Khi hiß╗ću suß║źt phß║Żn ß╗®ng 100% (phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān)
a) Khi chß╗ē xß║Ży ra 1 phß║Żn ß╗®ng
V├Ł dß╗ź: ─Éß╗ā trung ho├Ā 150 gam dung dß╗ŗch NaOH 5% cß║¦n bao nhi├¬u gam dung dß╗ŗch HCl 3,65%?
Giß║Żi
m NaOH = \(\frac{{150.5}}{{100}} = 7,5(g)\) ŌåÆ nNaOH = \(\frac{{7,5}}{{40}} = 0,1875(mol)\)
PTHH: NaOH + HCl ŌåÆ NaCl + H2O
Theo PTPŲ»: 1mol 1mol
Theo b├Āi ra: 0,1875mol 0,1875mol
mHCl = 0,1875 . 36,5 = 6,84 (g)
m dung dß╗ŗch HCl = \(\frac{{6,84.100}}{{3,65}} = 187,4(g)\)
b) Khi xß║Ży ra 2 phß║Żn ß╗®ng
V├Ł dß╗ź: Nung ho├Ān to├Ān m gam CaCO3, dß║½n kh├Ł thu ─æŲ░ß╗Żc ─æi qua dung dß╗ŗch Ba(OH)2 dŲ░ thu ─æŲ░ß╗Żc 1,97g kß║┐t tß╗¦a. T├¼m m?
Giß║Żi
C├Īc PTHH xß║Ży ra:
CaCO3 ŌåÆ CaO + CO2 (1)
CO2 + Ba(OH)2 ŌåÆ BaCO3 + H2O (2)
Theo PTHH (1) v├Ā (2): nCaCO3 = n CO2 = \(\frac{{1,97}}{{197}} = 0,01(mol)\)
m CaCO3 = m = 0,01 . 100 = 1(g)
2.2. Khi hiß╗ću suß║źt nhß╗Å hŲĪn 100% (phß║Żn ß╗®ng xß║Ży ra kh├┤ng ho├Ān to├Ān)
a) Khi xß║Ży ra 1 phß║Żn ß╗®ng
V├Ł dß╗ź: Nung 1 tß║źn ─æ├Ī v├┤i (chß╗®a 30% tß║Īp chß║źt) thu ─æŲ░ß╗Żc bao nhi├¬u tß║źn v├┤i sß╗æng biß║┐t H phß║Żn ß╗®ng = 85%.
Giß║Żi
1 tß║źn = 1000kg
mtß║Īp chß║źt = \(\frac{{30}}{{100}}.1000 = 300(kg)\) ŌåÆ mCaCO3 = 1000 - 300 = 700 (kg)
CaCO3 ŌåÆ CaO + CO2
Theo PTPŲ»: 100(g) 56(g)
Theo b├Āi ra: 700(kg) x(kg)
Suy ra x = \(\frac{{700}}{{100}}.56 = 392(kg)\)
V├¼ H phß║Żn ß╗®ng l├Ā 85% n├¬n ta c├│:
mCaO = x = \(392.\frac{{85}}{{100}} = 333,2(kg)\)
b) Khi xß║Ży ra nhiß╗üu phß║Żn ß╗®ng:
V├Ł dß╗ź: T├Łnh khß╗æi lŲ░ß╗Żng H2SO4 thu ─æŲ░ß╗Żc khi sß║Żn xuß║źt tß╗½ 12 tß║źn quß║Ęng FeS2 biß║┐t hiß╗ću suß║źt cß╗¦a c├Īc giai ─æoß║Īn l├Ā 75%.
Giß║Żi
Sß║Żn xuß║źt H2SO4 gß╗ōm 3 giai ─æoß║Īn:
- Giai ─æoß║Īn 1: ─Éiß╗üu chß║┐ SO2
4FeS2 + 11O2 ŌåÆ 2FeO3 + 8SO2
Theo PTPŲ»: 480(g) 512g
Theo b├Āi ra: 12tß║źn x(tß║źn)
Suy ra x = \(\frac{{12}}{{480}}.512 = 12,8(t\^a n)\)
Vì H = 75% nên ta có:
mSO2 = x = \(\frac{{12,8}}{{100}}.75\% = 9,6\) (tß║źn)
- Giai ─æoß║Īn 2: ├öxi ho├Ī SO2 ŌåÆ SO3.
2SO2 + O2 ŌåÆ 2SO3
Theo PTPŲ»: 128(g) 160g
Theo b├Āi ra: 9,6 tß║źn y (tß║źn)
Suy ra y = \(\frac{{9,6}}{{128}}.160 = 12(t\^a n)\) Vì H = 75% nên ta có:
mSO3 = y = \(\frac{{12}}{{100}}.75\% = 9\) (tß║źn)
- Giai ─æoß║Īn 3: Cho SO3 phß║Żn ß╗®ng vß╗øi nŲ░ß╗øc.
SO3 + H2SO4 ŌåÆ H2SO4
Theo PTPŲ»: 80(g) 98(g)
Theo b├Āi ra: 9(tß║źn) z (tß║źn)
Suy ra y = \(\frac{9}{{80}}.98 = 11,025(t\^a n)\)
Vì H = 75% nên ta có:
mH2SO4 = z = \(\frac{{11,025}}{{100}}.75\% = 8,27\) (tß║źn)
3. Dß║Īng 3: PhŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp t├Łnh theo PTHH dß╗▒a v├Āo lŲ░ß╗Żng 2 chß║źt phß║Żn ß╗®ng
* PhŲ░ŲĪng ph├Īp giß║Żi
- Chuyß╗ān ─æß╗Ģi c├Īc lŲ░ß╗Żng chß║źt ra sß╗æ mol
- Lß║Łp PTHH - Viß║┐t tß╗ē lß╗ć mol
- So s├Īnh tß╗ē lß╗ć sß╗æ mol chß║źt phß║Żn ß╗®ng t├¼m chß║źt phß║Żn ß╗®ng hß║┐t, chß║źt dŲ░.
- Dß╗▒a v├Āo sß╗æ mol chß║źt phß║Żn ß╗®ng hß║┐t t├Łnh sß╗æ mol c├Īc chß║źt theo PTHH.
- T├Łnh c├Īc lŲ░ß╗Żng chß║źt theo y├¬u cß║¦u cß╗¦a ─æß╗ü b├Āi.
* V├Ł dß╗ź cß╗ź thß╗ā
V├Ł dß╗ź 1: Ho├Ā tan 8 g CuO trong 150 gam dung dß╗ŗch HNO3 10%.
a) T├Łnh khß╗æi lŲ░ß╗Żng HNO3 tham gia phß║Żn ß╗®ng?
b) Khß╗æi lŲ░ß╗Żng muß╗æi ─æß╗ōng ─æŲ░ß╗Żc tß║Īo th├Ānh l├Ā bao nhi├¬u gam?
c) T├Łnh nß╗ōng ─æß╗Ö phß║¦n tr─ām c├Īc chß║źt c├│ trong dung dß╗ŗch sau khi phß║Żn ß╗®ng kß║┐t th├║c.
Giß║Żi
nCuO = 8 : 80 = 0,1 (mol)
mHNO3 = \(\frac{{150.10}}{{100}} = 15(g)\) -> nHNO3 = 15 : 63 = 0,238 (mol)
Do nCuO < nHNO3 n├¬n nCuO ─æŲ░ß╗Żc t├Łnh theo phŲ░ŲĪng tr├¼nh.
PTHH: CuO + 2HNO3 ŌåÆ Cu(NO3)2┬Ł + H2O
Theo PTHH: 1mol 2mol 1mol
Theo phß║Żn ß╗®ng: 0,1mol 0,2 mol 0,1mol
a) Theo PTHH ta c├│: nHNO3 = 2.nCuO = 0,2 mol
Suy ra ta c├│: mHNO3 phß║Żn ß╗®ng = 0,2 . 63 = 12,6 (g)
b) Theo PTHH nCu(NO3┬Ł)2 = nCuO = 0,1 mol
Suy ra ta c├│: mCu(NO3┬Ł)2 = 0,1 . 188 = 18,8(g)
c) Dung dß╗ŗch sau phß║Żn ß╗®ng gß╗ōm HNO3 dŲ░ v├Ā Cu(NO3)┬Ł2
mHNO3 dŲ░ = 0,038 . 63 = 2,394(g)
m dung dß╗ŗch sau phß║Żn ß╗®ng = mCuO + m dung dß╗ŗch HNO3 = 8 + 150 = 158(g)
C% HNO3 dŲ░ = \(\frac{{2,394.100}}{{158}} = 1,515\% \)
C% Cu(NO3)2 = \(\frac{{18,8.100}}{{158}} = 11,89\% \)
V├Ł dß╗ź 2: Cho 200 g dung dß╗ŗch H2SO4 10% v├Āo 300 gam dung dß╗ŗch BaCl2 5%.
a) Viß║┐t PTHH. T├Łnh khß╗æi lŲ░ß╗Żng cß╗¦a sß║Żn phß║®m.
b) T├Łnh nß╗ōng ─æß╗Ö phß║¦n tr─ām cß╗¦a c├Īc chß║źt c├│ trong dung dß╗ŗch sau khi t├Īc bß╗Å kß║┐t tß╗¦a?
Giß║Żi
mBaCl2 = \(\frac{{5.300}}{{100}} = 15(g)\) -> nBaCl2 = 15 : 208 = 0,072(mol)
mH2SO4 = \(\frac{{10.200}}{{100}} = 25(g)\) -> nH2SO4 = 20 : 98 = 0,204(mol)
a) PTHH: H2SO4 + BaCl2 -> BaSO4 + 2HCl
Theo b├Āi ra nH2SO4 > nBaCl2 . Vß║Ły H2SO4 dŲ░ t├Łnh theo nBaCl2
Theo PTHH nBaSO4 = nBaCl2 = 0,072 mol, nên ta có mBaSO4= 0,072 . 233 = 16,77 (g)
mH2SO4 dŲ░ = 20 - (0,072 . 98) = 12,944(g)
mHCl = 0,144 . 36,5 = 5,256 (g)
b) T├Łnh nß╗ōng ─æß╗Ö phß║¦n tr─ām cß╗¦a c├Īc chß║źt c├│ trong dung dß╗ŗch sau khi t├Īc bß╗Å kß║┐t tß╗¦a.
m dung dß╗ŗch sau phß║Żn ß╗®ng = (m dung dß╗ŗch H2SO4 + m dung dß╗ŗch BaCl2) ŌĆō mBaSO4 = (200 + 300) ŌĆō 16,77 = 483,23 (g)
C% H2SO4 dŲ░ = \(\frac{{12,944.100}}{{483,23}} \approx 2,678\% \)
C%HCl = \(\frac{{5,256.100}}{{483,23}} \approx 1,087\% \)
4. Dß║Īng 4: PhŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp ├Īp dß╗źng ─æß╗ŗnh luß║Łt bß║Żo to├Ān khß╗æi lŲ░ß╗Żng
* PhŲ░ŲĪng ph├Īp:
- Tß╗Ģng khß╗æi lŲ░ß╗Żng cß╗¦a sß║Żn phß║®m bß║▒ng tß╗Ģng khß╗æi lŲ░ß╗Żng cß╗¦a c├Īc chß║źt tham gia phß║Żn ß╗®ng
- Trong mß╗Öt phß║Żn ß╗®ng h├│a hß╗Źc c├│ n chß║źt (kß╗ā cß║Ż chß║źt tham gia v├Ā tß║Īo th├Ānh), nß║┐u biß║┐t khß╗æi lŲ░ß╗Żng cß╗¦a (n - 1) chß║źt th├¼ vß║Łn dß╗źng ─æß╗ŗnh luß║Łt bß║Żo to├Ān khß╗æi lŲ░ß╗Żng.
* V├Ł dß╗ź cß╗ź thß╗ā:
V├Ł dß╗ź 1: Cho luß╗ōng kh├Ł CO ─æi qua m (g) Fe3O4. Sau phß║Żn ß╗®ng thu ─æŲ░ß╗Żc 24,7 gam chß║źt rß║»n v├Ā 17,6 gam CO2. T├¼m m ?
HŲ░ß╗øng dß║½n giß║Żi
Khi ph├ón t├Łch giß╗» liß╗ću b├Āi ra ta thß║źy kh├┤ng thß╗ā t├Łnh trß╗▒c tiß║┐p ngay v├¼ sß╗æ lŲ░ß╗Żng chß║źt tham gia v├Ā tß║Īo th├Ānh l├Ā 4 m├Ā ta chß╗ē biß║┐t khß╗æi lŲ░ß╗Żng cß╗¦a 2 chß║źt. Mß║Ęt kh├Īc chŲ░a biß║┐t khß╗æi lŲ░ß╗Żng cß╗¦a Fe3O4 tham gia phß║Żn ß╗®ng c├▓n dŲ░ hay hß║┐t. Do ─æ├│ ta dß╗▒a v├Āo phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng ─æß╗ā t├¼m giß╗» liß╗ću cho b├Āi to├Īn.
- PTHH: Fe3O4 + CO ŌåÆ 3FeO + CO2
FeO + CO ŌåÆ Fe + CO2
Qua phŲ░ŲĪng tr├¼nh ta thß║źy nCO = nCO2 = \(\frac{{17,6}}{{44}}\) = 0,4 mol
Khi ─æß╗¦ giß╗» liß╗ću ta ├Īp dß╗źng ─æß╗ŗnh luß║Łt bß║Żo to├Ān khß╗æi lŲ░ß╗Żng.
mFe3O4 + mCO = m(r) + mCO2 mFe3O4 = 31,1(g)
V├Ł dß╗ź 2: H├▓a tan hß║┐t 7,74 gam hß╗Śn hß╗Żp Mg, Al bß║▒ng 500ml dung dß╗ŗch HCl 1M v├Ā H2SO4 0,28M thu ─æŲ░ß╗Żc dung dß╗ŗch X v├Ā 8,7361 l├Łt kh├Ł H2 (─æktc). C├┤ cß║Īn dung dß╗ŗch X thu ─æŲ░ß╗Żc bao nhi├¬u gam muß╗æi khan?
HŲ░ß╗øng dß║½n giß║Żi.
- Theo b├Āi ra ta c├│:
nH2 = \(\frac{{8,7361}}{{22,4}}\) = 0,39 mol
nHCl = 0,5.1 = 0,5 mol
nH2SO4 = 0,28.0,5 = 0,14 mol
- ├üp dß╗źng ─æß╗ŗnh luß║Łt bß║Żo to├Ān khß╗æi lŲ░ß╗Żng ta c├│:
mhh + mHCl + mH2SO4 = m(muối) + mH2
m(muối) = 7,74 + 0,5.36,5 + 0,14.98 - 0,39.2 = 38,93 gam.
5. Dß║Īng 5: PhŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp t─āng - giß║Żm khß╗æi lŲ░ß╗Żng
* PhŲ░ŲĪng ph├Īp:
- Khi chuyß╗ān tß╗½ chß║źt n├Āy sang chß║źt kh├Īc th├¼ khß╗æi lŲ░ß╗Żng t─āng hay giß║Żm mß╗Öt lŲ░ß╗Żng m (hay V ─æß╗æi vß╗øi chß║źt kh├Ł) do c├Īc chß║źt kh├Īc nhau c├│ khß╗æi lŲ░ß╗Żng mol kh├Īc nhau. Dß╗▒a v├Āo sß╗▒ tŲ░ŲĪng quan tß╗ē lß╗ć thuß║Łn cß╗¦a sß╗▒ t─āng - giß║Żm, t├Łnh ─æŲ░ß╗Żc khß╗æi lŲ░ß╗Żng (hay thß╗ā t├Łch) chß║źt tham gia hay tß║Īo th├Ānh sau phß║Żn ß╗®ng.
- B├Āi to├Īn giß║Żi ─æŲ░ß╗Żc theo phŲ░ŲĪng ph├Īp bß║Żo to├Ān khß╗æi lŲ░ß╗Żng sß║Į ├Īp dß╗źng ─æŲ░ß╗Żc cho phŲ░ŲĪng ph├Īp n├Āy. NhŲ░ng vß╗øi phŲ░ŲĪng ph├Īp t─āng - giß║Żm khß╗æi lŲ░ß╗Żng kh├┤ng cß║¦n biß║┐t hß║┐t (n - 1) ─æß║Īi lŲ░ß╗Żng ta vß║½n giß║Żi ─æŲ░ß╗Żc nß║┐u biß║┐t ─æŲ░ß╗Żc sß╗▒ biß║┐n thi├¬n m hay V
* V├Ł dß╗ź cß╗ź thß╗ā:
V├Ł dß╗ź 1: Nh├║ng mß╗Öt thanh Sß║»t c├│ khß╗æi lŲ░ß╗Żng 50 gam v├Āo 400 ml dung dß╗ŗch CuSO4 0,5M. Sau phß║Żn ß╗®ng lß║źy thanh Sß║»t ra l├Ām kh├┤ c├ón lß║Īi thß║źy khß╗æi lŲ░ß╗Żng l├Ā 51 gam.
a) T├Łnh khß╗æi lŲ░ß╗Żng cß╗¦a ─Éß╗ōng tß║Īo th├Ānh b├Īm tr├¬n thanh Sß║»t?
b) T├Łnh CM c├Īc chß║źt trong dung dß╗ŗch sau phß║Żn ß╗®ng?
HŲ░ß╗øng dß║½n giß║Żi:
PTHH: Fe + CuSO4 ŌåÆ FeSO4 + Cu
1 mol 1 mol 1 mol 1 mol
Cß╗® 1 mol Fe (56g) tß║Īo ra 1 mol Cu (64 g) t─āng 8 gam
Vß║Ły x mol Fe phß║Żn ß╗®ng sß║Į tß║Īo ra x mol Cu t─āng 51 - 50 = 1 g
x = 1/8 = 0,125 mol
Suy ra: nFe = nCu = nFeSO4 = nCuSO4 = 0,125 mol.
Vß║Ły mCu = 0,125.64 = 8 g
Nß╗ōng ─æß╗Ö mol/lit cß╗¦a dung dß╗ŗch FeSO4 l├Ā: CM (FeSO4) = \(\frac{{0,125}}{{0,4}}\) = 0,3125 M
Nß╗ōng ─æß╗Ö mol/lit cß╗¦a dung dß╗ŗch CuSO4 ─æ├Ż phß║Żn ß╗®ng l├Ā: 0,3125 M
Suy ra CM(CuSO4) = 0,5 - 0,3125 = 0,1875 M.
V├Ł dß╗ź 2: Khi lß║źy 14,25 gam muß╗æi Clorua cß╗¦a mß╗Öt kim loß║Īi X c├│ h├│a trß╗ŗ II v├Ā mß╗Öt lŲ░ß╗Żng muß╗æi Nitrat cß╗¦a X vß╗øi sß╗æ mol nhŲ░ nhau, th├¼ thß║źy khß╗æi lŲ░ß╗Żng kh├Īc nhau 7,95 g. H├Ży t├¼m c├┤ng thß╗®c cß╗¦a hai muß╗æi.
HŲ░ß╗øng dß║½n giß║Żi:
Ta c├│ c├┤ng thß╗®c cß╗¦a hai muß╗æi l├Ā: XCl2 (M = X + 71) v├Ā X(NO3)2 (M = X + 124)
Ta thß║źy cß╗® 1 mol muß╗æi X(NO3)2 lß╗øn hŲĪn 1 mol XCl2 l├Ā:
X + 124 - X + 71 = 53.
- Theo giß║Ż thiß║┐t khß╗æi lŲ░ß╗Żng kh├Īc nhau l├Ā 7,95 g. V├¼ gß╗æc NO c├│ khß╗æi lŲ░ß╗Żng lß╗øn hŲĪn gß╗æc Cl n├¬n tß╗½ giß║Ż thiß║┐t ─æ├│ ta c├│:
mX(NO3)2 - mXCl2 = 7,95.
Sß╗æ mol muß╗æi cß╗¦a kim loß║Īi X l├Ā: nX = \(\frac{{7,95}}{{53}}\) .1 = 0,15 mol
Khß╗æi lŲ░ß╗Żng mol cß╗¦a muß╗æi XCl2 l├Ā: M = \(\frac{{14,25}}{{0,15}}\) = 95 X + 71 = 95 ŌåÆ X = 24. Vß║Ły X l├Ā Magie (Mg).
6. Dß║Īng 6: PhŲ░ŲĪng ph├Īp biß╗ćn luß║Łn ─æß╗ā t├¼m c├┤ng thß╗®c ph├ón tß╗Ł
* PhŲ░ŲĪng ph├Īp:
- Khi x├Īc ─æß╗ŗnh t├¬n nguy├¬n tß╗æ hay x├Īc ─æß╗ŗnh c├┤ng thß╗®c ph├ón tß╗Ł thŲ░ß╗Øng phß║Żi x├Īc ─æß╗ŗnh ch├Łnh x├Īc khß╗æi lŲ░ß╗Żng mol, nhŲ░ng mß╗Śi trŲ░ß╗Øng hß╗Żp M chŲ░a c├│ gi├Ī trß╗ŗ ch├Łnh x├Īc ─æ├▓i hß╗Åi phß║Żi biß╗ćn luß║Łn.
- Phß║Īm vi ß╗®ng dß╗źng: Biß╗ćn luß║Łn theo h├│a trß╗ŗ, theo lŲ░ß╗Żng chß║źt, theo giß╗øi hß║Īn, theo phŲ░ŲĪng tr├¼nh v├┤ ─æß╗ŗnh hoß║Ęc theo kß║┐t quß║Ż b├Āi to├Īn, theo khß║Ż n─āng phß║Żn ß╗®ng.
- Khi giß║Żi dß║Īng n├Āy c├Īc em thŲ░ß╗Øng l├║ng t├║ng, giß║Żi ─æß║┐n giß╗»a chß╗½ng thß║źy xuß║źt hiß╗ćn nhiß╗üu ß║®n th├¼ dß╗½ng lß║Īi, do kh├┤ng thß╗ā ├Īp dß╗źng phŲ░ŲĪng ph├Īp kh├Īc nhŲ░ gh├®p ß║®n sß╗æ, hay phŲ░ŲĪng ph├Īp bß║Żo to├Ān khß╗æi lŲ░ß╗Żng. L├║c n├Āy c├Īc em phß║Żi t├¼m c├Īch biß╗ćn lusnj th├Łch hß╗Żp.
* V├Ł dß╗ź cß╗ź thß╗ā:
Cho 3,06 g oxit MxOy t├Īc dß╗źng hß║┐t vß╗øi dung dß╗ŗch HNO3, khi c├┤ cß║Īn dung dß╗ŗch thß║źy tß║Īo ra 5,22 g muß╗æi khan. X├Īc ─æß╗ŗnh kim loß║Īi M biß║┐t n├│ chß╗ē c├│ mß╗Öt gi├Ī trß╗ŗ duy nhß║źt.
HŲ░ß╗øng dß║½n giß║Żi:
- PTHH: MxOy + 2yHNO3 ŌåÆ xM(NO3)2y/x + yH2O
Bß║Żo to├Ān nguy├¬n tß╗æ H: nH2O = a ŌåÆ nHNO3 = 2a
Bß║Żo to├Ān khß╗æi lŲ░ß╗Żng: 3,06 + 63.2a = 5,22 + 18a ŌåÆ a = 0,02 mol ŌåÆ nHNO3 = 0,04 mol
Bß║Żo to├Ān nguy├¬n tß╗æ N: nMuß╗æi = \(\frac{{nHNO3/2y}}{x}\) = \(\frac{{nHNO3}}{n}\) (n: l├Ā h├│a trß╗ŗ M)
MMuß╗æi = \(\frac{{5,22}}{{nHNO3}}\).n = 130,5n ŌåÆ M = 130,5n - 62n = 68,5n
- Biß╗ćn luß║Łn M theo h├│a trß╗ŗ n:
|
n |
1 |
2 |
3 |
4 |
|
M |
68,5 |
137 |
205,5 |
274 |
Vß║Ły kim loß║Īi M l├Ā Bari (Ba)
Tr├¬n ─æ├óy l├Ā phß║¦n tr├Łch dß║½n PhŲ░ŲĪng ph├Īp giß║Żi mß╗Öt sß╗æ dß║Īng b├Āi tß║Łp h├│a hß╗Źc v├┤ cŲĪ bß║Łc THCS n─ām 2021, ─æß╗ā xem to├Ān bß╗Ö nß╗Öi dung chi tiß║┐t, mß╗Øi c├Īc bß║Īn c├╣ng qu├Į thß║¦y c├┤ vui l├▓ng ─æ─āng nhß║Łp ─æß╗ā tß║Żi vß╗ü m├Īy.
Ch├║c c├Īc em ─æß║Īt ─æiß╗ām sß╗æ thß║Łt cao trong k├¼ thi sß║»p ─æß║┐n!
T├Āi liß╗ću li├¬n quan
TŲ░ liß╗ću nß╗Ģi bß║Łt tuß║¦n
- Xem thêm