DŲ░ß╗øi ─æ├óy l├Ā HŲ░ß╗øng dß║½n giß║Żi H├│a 12 SGK n├óng cao ChŲ░ŲĪng 8 B├Āi 51 Chuß║®n ─æß╗Ö Axit - Bazo ─æŲ░ß╗Żc hoc247 bi├¬n soß║Īn v├Ā tß╗Ģng hß╗Żp, nß╗Öi dung b├Īm s├Īt theo chŲ░ŲĪng tr├¼nh SGK H├│a hß╗Źc 12 n├óng cao gi├║p c├Īc em hß╗Źc sinh nß║»m vß╗»ng phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp v├Ā ├┤n tß║Łp kiß║┐n thß╗®c hiß╗ću quß║Ż hŲĪn.
B├Āi 1 trang 245 SGK H├│a 12 n├óng cao
Kh├Īi niß╗ćm sß╗▒ chuß║®n ─æß╗Ö? Kh├Īi niß╗ćm ─æiß╗ām tŲ░ŲĪng ─æŲ░ŲĪng? Kh├Īi niß╗ćm ─æiß╗ām cuß╗æi? Cho th├Ł dß╗ź minh hoß║Ī?
HŲ░ß╗øng dß║½n giß║Żi:
Sß╗▒ chuß║®n ─æß╗Ö l├Ā c├Īch x├Īc ─æß╗ŗnh nß╗ōng ─æß╗Ö cß╗¦a dung dß╗ŗch.
- Dung dß╗ŗch thuß╗æc thß╗Ł ─æ├Ż biß║┐t ch├Łnh x├Īc nß╗ōng ─æß╗Ö gß╗Źi l├Ā dung dß╗ŗch chuß║®n
- Thß╗Øi ─æiß╗ām m├Ā chß║źt cß║¦n x├Īc ─æß╗ŗnh nß╗ōng ─æß╗Ö vß╗½a t├Īc dß╗źng hß║┐t vß╗øi dung dß╗ŗch chuß║®n gß╗Źi l├Ā ─æiß╗ām tŲ░ŲĪng ─æŲ░ŲĪng
- Thß╗Øi ─æiß╗ām kß║┐t th├║c chuß║®n ─æß╗Ö l├Ā ─æiß╗ām cuß╗æi.
B├Āi 2 trang 245 SGK H├│a 12 n├óng cao
Cß║¦n phß║Żi th├¬m bao nhi├¬u ml dung dß╗ŗch NaOH 0,25 M v├Āo 50 ml dung dß╗ŗch hß╗Śn hß╗Żp HCl 0,1M v├Ā H2SO4 0,05M ─æß╗ā thu ─æŲ░ß╗Żc dung dß╗ŗch c├│ ─æß╗Ö pH = 2,0?
A. 43,75 ml
B. 36,54 ml
C. 27,75 ml
D. 40,75 ml
HŲ░ß╗øng dß║½n giß║Żi:
─É├Īp ├Īn B.
Ta c├│ nHCl = 0,005; nH2SO4 = 0,0025 ŌćÆ nH+ = 2.nH2SO4 + nHCl = 0,01 mol.
nOH- = 0,25V (vß╗øi V l├Ā thß╗ü t├Łch NaOH th├¬m v├Āo)
Phß║Żn ß╗®ng: H+ + OH- ŌåÆ H2O
Dung dß╗ŗch thu ─æŲ░ß╗Żc c├│ pH = 2 ŌćÆ axit dŲ░
nH+ dŲ░ = 0,01 - 0,25V
CM H+ sau phß║Żn ß╗®ng = \(\frac{{0,01 - 0,25V}}{{0,05 + V}} = {10^{ - 2}}\)
V = 0,03654 l├Łt = 36,54 ml.
B├Āi 3 trang 245 SGK H├│a 12 n├óng cao
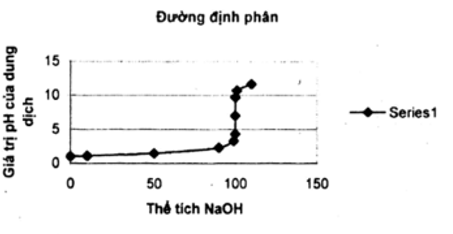
Tß╗½ c├Īc sß╗æ liß╗ću sau h├Ży vß║Į ─æß╗ō thß╗ŗ biß╗āu diß╗ģn sß╗▒ biß║┐n thi├¬n pH cß╗¦a dung dß╗ŗch trong qu├Ī tr├¼nh chuß║®n ─æß╗Ö dung dß╗ŗch HCl 0,100 M bß║▒ng dung dß╗ŗch NaOH 0,100 M. Trß╗źc ho├Ānh ghi thß╗ā t├Łch dung dß╗ŗch NaOH, trß╗źc tung ghi pH cß╗¦a dung dß╗ŗch. ─ÉŲ░ß╗Øng biß╗āu diß╗ģn tr├¬n ─æß╗ō thß╗ŗ ─æ├│ gß╗Źi l├Ā ─æŲ░ß╗Øng ─æß╗ŗnh ph├ón.
|
VNaOH |
0 |
10 |
50 |
90 |
99 |
99,9 |
100 |
100,1 |
101 |
110 |
|
pH |
1 |
1,1 |
1,48 |
2,28 |
3,30 |
4,30 |
7,0 |
9,7 |
10,7 |
11,68 |
HŲ░ß╗øng dß║½n giß║Żi:
─Éß╗ō thß╗ŗ ─æŲ░ß╗Øng ─æß╗ŗnh ph├ón
Tr├¬n ─æ├óy l├Ā nß╗Öi dung chi tiß║┐t Giß║Żi b├Āi tß║Łp n├óng cao H├│a 12 ChŲ░ŲĪng 8 Chuß║®n ─æß╗Ö axit - bazo, vß╗øi hŲ░ß╗øng dß║½n giß║Żi chi tiß║┐t, r├Ą r├Āng, tr├¼nh b├Āy khoa hß╗Źc. Hoc247 hy vß╗Źng ─æ├óy sß║Į l├Ā t├Āi liß╗ću hß╗»u ├Łch gi├║p c├Īc bß║Īn hß╗Źc sinh lß╗øp 12 hß╗Źc tß║Łp thß║Łt tß╗æt!
T├Āi liß╗ću li├¬n quan
TŲ░ liß╗ću nß╗Ģi bß║Łt tuß║¦n
- Xem thêm












