Để giúp các em học sinh lớp 12 có thêm tài liệu ôn tập, rèn luyện chuẩn bị cho kì thi tốt nghiệp THPT sắp tới HOC247 giới thiệu đến quý thầy cô và các em học sinh tài liệu Bộ 5 đề thi thử THPT QG môn Hóa học năm 2021-2022 Trường THPT Hiệp Thành dưới đây được biên tập và tổng hợp với phần đề và đáp án, lời giải chi tiết giúp các em tự luyện tập làm đề. Hi vọng tài liệu này sẽ có ích cho các em, chúc các em có kết quả học tập tốt!
|
TRƯỜNG THPT HIỆP THÀNH |
ĐỀ THI THỬ THPT QUỐC GIA MÔN HÓA HỌC NĂM HỌC 2021-2022 Thời gian làm bài 50 phút |
ĐỀ THI SỐ 1
Câu 41: Dung dịch (Gly)2Ala không phản ứng được với chất nào sau đây?
A. Cu(OH)2/OH-. B. HCl. C. KNO3. D. KOH.
Câu 42: Lưu huỳnh không phản ứng trực tiếp với chất nào sau đây?
A. HNO3 đặc nóng. B. N2. C. H2SO4 đặc nóng. D. O2.
Câu 43: Metylmetacrylat là este được dùng để tổng hợp thủy tinh hữu cơ. Công thức phân tử của metylmetacrylat là.
A. C4H6O2. B. C3H4O2. C. C5H10O2. D. C5H8O2.
Câu 44: Trong công nghiệp, kim loại nào được điều chế bằng phương pháp điện phân nóng chảy oxit của nó?
A. Na. B. Fe. C. Al. D. Ba.
Câu 45: M là kim loại có nhiệt độ nóng chảy cao nhất, M thường được dùng để chế tạo dây tóc bóng đèn sợi đốt, M là
A. Ag. B. W. C. Cr. D. Cu.
Câu 46: Oxit nào là oxit axit?
A. Al2O3. B. SiO2. C. Fe2O3. D. K2O.
Câu 47: Nước cứng là nước có chứa nhiều các ion
A. SO42-. Cl- B. Al3+, Fe3+. C. Na+, K+ D. Mg2+, Ca2+.
Câu 48: Cho Ba(OH)2 đến dư vào dung dịch chất X, kết thúc phản ứng chỉ thu được một kết tủa. Chất X là
A. AlCl3. B. Ca(HCO3)2. C. Fe2(SO4)3. D. Al2(SO4)3.
Câu 49: Ở điều kiện thường, kim loại nào sau đây không tan trong nước
A. Ba. B. K. C. Fe. D. Na.
Câu 50: Nguyên tố nào sau đây là kim loại
A. Cacbon. B. Lưu huỳnh. C. Nhôm. D. Nitơ.
Câu 51: Chất nào sau đây thuộc loại đisaccarit?
A. Saccarozơ. B. Tinh bột. C. Glucozơ. D. Xenlulozơ.
Câu 52: Poli (vinyl clorua) được điều chế từ phản ứng trùng hợp chất nào sau đây?
A. CH2=CH2. B. CH2=CH-CN. C. CH3-CH2Cl. D. CH2=CHCl.
Câu 53: Đốt cháy peptit nào sau đây thu được H2O và CO2 có số mol bằng nhau:
A. Gly-Gly-Ala. B. Gly-Ala. C. Gly-Lys D. Glu-Val
Câu 54: Tiến hành phản ứng este hóa hỗn hợp gồm 6,4 gam CH3OH và 6,0 gam CH3COOH với hiệu suất 75% thu được m gam este. Giá trị của m là
A. 9,30 gam. B. 7,40 gam. C. 5,55 gam. D. 4,50 gam.
Câu 55: Cho V lít CO2 (đktc) tác dụng hoàn toàn với 200ml dung dịch Ba(OH)2 1M và NaOH 0,5M. Kết thúc phản ứng thu được 19,7 gam kết tủa. Giá trị lớn nhất của V là
A. 2,24 lít. B. 6,72 lít. C. 11,2 lít. D. 8,96 lít.
Câu 56: Cho các este sau: etyl fomat (1); vinyl axetat (2); triolein (3); metyl acrylat (4); phenyl axetat (5). Dãy gồm các este đều phản ứng được với dung dịch NaOH dư, đun nóng sinh ra ancol là
A. (1), (2), (3) B. (1), (3), (4) C. (3), (4), (5) D. (2), (3), (5)
Câu 57: Thực hiện sơ đồ phản ứng sau:
(1) X (CH5O2N) → X1 + X2 + H2O.
(2) Y (C2H7O3N) → Y1 + Y2 + H2O.
Biết rằng X2 và Y2 là hai khí hơn kém nhau 14 đvC và đều có khả năng làm quì tím ẩm hóa xanh. Nhận định nào sau đây là sai?
A. Chất Y1 là muối vô cơ có tính bazơ. B. Chất Y có tính lưỡng tính.
C. Chất X1 cho được phản ứng tráng gương. D. Chất X2 và Y2 đều là hợp chất hữu cơ.
Câu 58: Cho các chất sau: Na2CO3, K3PO4, H2S, Ca(OH)2, Na2SO4. Số chất có thể sử dụng để làm mềm nước cứng tạm thời là
A. 4. B. 2. C. 5. D. 3.
Câu 59: Cho hỗn hợp gồm axit X (C2H4O2) và este Y (C4H6O2) tác dụng vừa đủ với dung dịch NaOH, thu được một muối duy nhất và chất hữu cơ Z. Tên gọi của Y là.
A. vinyl axetat B. vinyl axetic C. metyl acrylat D. anlyl fomat
Câu 60: Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ dung dịch X
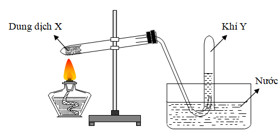
Hình vẽ trên minh họa phản ứng nào sau đây?
A. NaCl (rắn) + H2SO4 (đặc) → NaHSO4 + HCl.
B. NH4Cl + NaOH → NaCl + NH3 + H2O.
C. CH3COONa (rắn) + NaOH (rắn) → Na2CO3 + CH4.
D. C2H5OH → C2H4 + H2O.
Câu 61: Cho các phát biểu sau:
(a) Chất béo là trieste của glixerol và các axit béo
(b) Glucozơ vừa có tính oxi hóa vừa có tính khử
(c) Phân tử amilozơ và amilopectin có mạch phân nhánh
(d) Anilin ít tan trong nước nhưng tan nhiều trong dung dịch NaOH
Số phát biểu sai là
A. 2. B. 4. C. 1. D. 3.
Câu 62: Cho 6,2 gam metylamin tác dụng với dung dịch HCl dư thu được m gam muối, giá trị của m là
A. 13,50 gam. B. 10,40 gam. C. 9,85 gam. D. 6,75 gam.
Câu 63: Cho 9,2 gam hỗn hợp MgCO3 và CaCO3 tác dụng với HCl dư. Sau khi phản ứng xẩy ra hoàn toàn thu được 2,24 lít khí (đktc) và m gam muối cloua. Giá trị m là
A. 8,1 gam. B. 12,1 gam. C. 11,2 gam D. 10,3 gam.
Câu 64: Đun nóng dung dịch chứa 18,0 gam glucozơ với lượng dư dung dịch AgNO3 trong NH3, đến khi phản ứng xảy ra hoàn toàn thu được m gam Ag. Giá trị của m là
A. 10,8. B. 32,4. C. 21,6. D. 16,2.
Câu 65: Hòa tan hoàn toàn a gam Ba vào 100 ml dung dịch Y gồm H2SO4 0,5M và HCl 1M, thấy thoát ra 6,72 lít khí (đktc). Cô cạn dung dịch sau phản ứng thu được m gam chất rắn khan. Giá trị của m gần nhất với giá trị nào sau đây?
A. 41. B. 45. C. 49. D. 56.
Câu 66: Đốt cháy hoàn toàn x mol axit cacboxylic E, thu được y mol CO2 và z mol H2O (với z = y – x). Cho x mol E tác dụng với NaHCO3 (dư) thu được y mol CO2. Tên của E là
A. axit ađipic. B. axit acrylic. C. axit fomic. D. axit oxalic.
Câu 67: Tiến hành các thí nghiệm sau:
1. Cho thanh kẽm vào dung dịch H2SO4 loãng rồi thêm ít giọt CuSO4.
2. Cho thanh đồng nguyên chất và dung dịch HCl loãng.
3. Nhỏ dung dịch FeCl2 vào dung dịch AgNO3.
4. Cho thanh nhôm vào dung dịch NaOH.
5. Để một vật bằng gang trong không khí ẩm.
6. Cho một vật bằng kẽm dư vào dung dịch FeCl3.
Số thí nghiệm kim loại bị ăn mòn điện hóa học là
A. 5. B. 2. C. 4. D. 3.
Câu 68: Hỗn hợp X gồm các triglixerit và các axit béo. Lấy 57,36 gam X cho tác dụng vừa đủ với 112 gam dung dịch KOH 10%. Làm bay hơi dung dịch sau phản ứng thu được m gam muối khan và phần hơi Y. Cho hơi Y qua bình đựng natri dư thấy bình đựng natri tăng 100,88 gam. Biết các phản ứng xẩy ra hoàn toàn, tính giá trị của m?
A. 62,04 gam. B. 68,20 gam. C. 62,68 gam. D. 68,48 gam.
Câu 69: Tiến hành thí như sau:
- Bước 1: Cho vào ống nghiệm vài giọt dung dịch CuSO4 0,5%.
- Bước 2: Thêm tiếp vào ống nghiệm 2 ml dung dịch NaOH 10%, lắc đều rồi gạn bỏ phần dung dịch dư.
- Bước 3: Thêm tiếp vào ống nghiệm 2ml dung dịch glucozơ 1%, lắc nhẹ ống nghiệm.
Hiện tượng quan sát được sau bước 3 là
A. Xuất hiện kết tủa đỏ gạch. B. Dung dịch thu được có màu xanh lam.
C. Dung dịch thu được có màu xanh tím. D. Xuất hiện kết tủa xanh lam.
Câu 70: X, Y, Z là các dung dịch không màu. Trích các mẫu thử rồi lần lượt cho mỗi mẫu thử vào mẫu các chất còn lại, ta có kết quả theo bảng sau (Kí hiệu: : Có chất kết tủa; : Có chất bay hơi; (-): không phản ứng hoặc không có hiện tượng)
.jpg)
Các chất X, Y, Z lần lượt là.
A. NaHSO4, Ba(OH)2, Na2CO3 B. Ba(HCO3)2, NaHSO4, Ba(OH)2
C. NaHSO4, Ba(HCO3)2, Na2CO3. D. Ba(HCO3)2, NaHSO4, Na2CO3.
Câu 71: X là một este đa chức, mạch hở có công thức phân tử C5H6O4. Cho X tác dụng vừa đủ với KOH thu được dung dich Y gồm 2 chất. Biết dung dịch Y có phản ứng tráng gương. Số đồng phân cấu tạo thỏa mãn X là
A. 6. B. 5. C. 8. D. 4.
Câu 72: Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 vào dung dịch Ca(OH)2 dư.
(2) Sục khí NH3 dư vào dung dịch AlCl3.
(3) Sục khí CO2 dư vào dung dịch NaAlO2.
(4) Cho dung dịch AgNO3 vào dung dịch FeCl3.
(5) Cho dung dịch HCl vào dung dịch K2CO3.
(6) Cho ure vào dung dịch Ca(OH)2. S
au khi kết thúc thí nghiệm, số trường hợp thu được kết tủa là
A. 5. B. 4. C. 3. D. 6.
Câu 73: Cho rất từ từ và khuấy đều dung dịch H3PO4 vào dung dịch chứa a mol Ca(OH)2. Mối quan hệ giữa khối lượng kết tủa (gam) và số mol H3PO4 cho vào được biểu diễn bằng đồ thị sau:
.jpg)
Biết muối photphat và hidrophotphat của canxi đều là chất kết tủa. Giá trị x là
A. 27,90 gam. B. 18,60 gam. C. 23,12 gam. D. 24,48 gam.
Câu 74: Lấy 20,8 gam hỗn hợp A gồm Al, Mg, Zn tác dụng vừa đủ với dung dịch loãng chứa 1,5 mol HNO3 thu được dung dịch B và thấy thoát ra 0,05 mol khí N2O duy nhất. Khối lượng muối trong dung dịch B là
A. 95,2 gam. B. 102,4 gam. C. 103,2 gam. D. 120,0 gam.
Câu 75: Hỗn hợp X gồm 2 muối A (C3H11O5N3) là muối của aminoaxit và B (C4H10O4N2) là muối của axit cacboxylic đa chức. Lấy 48,8 gam X tác dụng với dung dịch NaOH vừa đủ rồi cô cạn cẩn thận thì thu được hỗn hợp Y chứa 3 muối (trong đó có 2 muối có cùng số nguyên tử C) và phần hơi Z có 2 amin (hơn kém nhau 1 nguyên tử C). Hòa Y vào dung dịch H2SO4 loãng dư được dung dịch T. T hòa tan tối đa 19,2 gam Cu thu được dung dịch Q và tạo khí NO (là sản phẩm khử duy nhất). Làm bay hơi Q được m gam các muối trung hòa. Giá trị của m là
A. 125,0 gam. B. 90,6 gam. C. 115,4 gam. D. 134,0 gam.
Câu 76: Hòa tan hoàn toàn hai chất rắn X, Y (có số mol bằng nhau) vào nước thu được dung dịch Z không màu. Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho dung dịch NaOH dư vào V ml dung dịch Z, thu được n1 mol khí.
- Thí nghiệm 2: Cho dung dịch HCl dư vào V ml dung dịch Z, thu được n2 mol khí.
- Thí nghiệm 3: Cho dung dịch Ba(OH)2 dư vào V ml dung dịch Z, thu được n3 mol kết tủa.
Biết các phản ứng xảy ra hoàn toàn và n1 = n2 = n3. Hai chất X, Y lần lượt là chất nào trong các cặp chất sau?
A. (NH4)2CO3, NaHCO3.
B. NH4HCO3, Na2CO3.
C. NH4HCO3, (NH4)2CO3.
D. NH4HCO3 và NaHCO3.
Câu 77: Tiến hành điện phân 100ml dung dịch hỗn hợp Cu(NO3)2 xM, Fe(NO3)3 0,3M, H2SO4 aM với điện cực trơ, cường độ dòng điện I = 19,3(A). Sau thời gian t giây, ở catot bắt đầu thoát khí thì dừng điện phân, dung dịch sau điện phân hòa tan hết 8,4 gam Fe thu được dung dịch chỉ chứa một muối và khí NO (là sản phẩm khử duy nhất). Tổng các giá trị t thỏa mãn bài toán là
A. 900 giây B. 700 giây C. 500 giây D. 200 giây
Câu 78: Cho những phát biểu sau:
(1) Thủy phân hoàn toàn este dạng RCOOR’ bằng dung dịch NaOH thu được khối lượng muối lớn hơn khối lượng este ban đầu thì R’ là gốc CH3-.
(2) Dùng dung dịch Fe(NO3)3 dư để tách Ag ra khỏi hỗn hợp Fe, Cu và Ag.
(3) Quặng xiderit có chứa hàm lượng sắt cao hơn quặng manhetit.
(4) Có thể dùng Cu(OH)2/OH- để phân biệt Ala-Ala và Ala-Ala-Ala.
(5) Tơ nilon-6,6 được tạo thành bởi phản ứng trùng ngưng hexametylenđiamin và axit ađipic.
(6) Tripanmitin có nhiệt độ nóng chảy thấp hơn triolein.
Số mệnh đề đúng là
A. 5. B. 2. C. 3. D. 4.
Câu 79: Lấy 10,8 gam Al chia thành 2 phần:
- Phần 1: Hòa tan hoàn toàn trong 500ml dung dịch hỗn hợp H2SO4 0,8M và HCl 0,8M thu được dung dịch X.
- Phần 2: Hòa tan hoàn toàn trong 500ml dung dịch KOH 0,41M và Ba(OH)2 xM thu được dung dịch Y.
Trộn X với Y thu được 97,1 gam hỗn hợp kết tủa Z. Thành phần % khối lượng Al(OH)3 trong Z lớn nhất là
A. 4,016. B. 22,733. C. 13,275. D. 32,092.
Câu 80: Lấy m gam hỗn hợp X gồm 3 este đơn chức A, B, C (MA < MB < MC) tác dụng với lượng vừa đủ dung dịch KOH thì thu được dung dịch Y. Làm bay hơi Y thu được 15,36 gam hỗn hợp Z gồm 2 muối và phần hơi chứa 2,84 gam hai ancol là đồng đẳng kế tiếp nhau. Đốt cháy toàn bộ hỗn hợp Z thu được 11,04 gam K2CO3, 12,32 gam CO2 và 2,88 gam H2O. Thành phần % khối lượng của B trong X gần nhất với
A. 13,6 B. 16,9 C. 16,0 D. 14,9
ĐỀ THI SỐ 2
ĐỀ THI THỬ THPT QG MÔN HÓA HỌC NĂM 2022 TRƯỜNG THPT HIỆP THÀNH - ĐỀ 02
Câu 41: Kim loại nào sau đây thường được dùng trong các dây dẫn điện?
A. Vàng. B. Sắt. C. Đồng. D. Nhôm.
Câu 42: Kim loại nào sau đây phản ứng được với dung dịch H2SO4 đặc, nguội?
A. Al. B. Cr. C. Fe. D. Cu.
Câu 43: Xút ăn da là hiđroxit của kim loại nào sau đây?
A. Ca. B. Na. C. Mg. D. Fe.
Câu 44: Để khử ion Cu2+ trong dung dịch CuSO4 có thể dùng kim loại
A. Ag. B. Ba. C. Fe. D. Na.
Câu 45: Kim loại không phản ứng được với dung dịch H2SO4 loãng là
A. Ag. B. Mg. C. Fe. D. Al.
Câu 46: Tính chất nào sau đây là tính chất vật lí chung của kim loại?
A. nhiệt độ nóng chảy.
B. khối lượng riêng.
C. tính dẫn điện.
D. tính cứng.
Câu 47: Thành phần chính của quặng boxit là
A. Al2O3. B. Fe2O3. C. Cr2O3. D. Fe3O4.
Câu 48: Kim loại nào sau đây không phải là kim loại kiềm?
A. Ca. B. K. C. Cs. D. Li.
Câu 49: Một mẫu nước cứng chứa các ion: \(M{{g}^{2+}}\), \(C{{a}^{2+}}\), \(C{{l}^{-}}\), \(SO_{4}^{2-}\). . Chất được dung để làm mềm mẫu nước cứng trên là
A. BaCl2. B. Na3PO4. C. NaHCO3. D. H2SO4.
Câu 50: Cho dung dịch NaOH vào dung dịch chất X, thu được kết tủa màu trắng xanh (xanh rêu). Chất X là
A. FeCl3. B. MgCl2. C. CuCl2. D. FeCl2.
---(Để xem tiếp nội dung từ câu 51 đến câu 80 của đề thi số 2 các em vui lòng xem Online hoặc Đăng nhập vào HOC247 để tải về máy)---
ĐÁP ÁN ĐỀ THI SỐ 2
|
41-C |
42-D |
43-B |
44-C |
45-A |
46-C |
47-A |
48-A |
49-B |
50-D |
|
51-D |
52-C |
53-D |
54-D |
55-D |
56-A |
57-A |
58-C |
59-B |
60-C |
|
61-D |
62-A |
63-B |
64-B |
65-D |
66-A |
67-B |
68-A |
69-C |
70-D |
|
71-A |
72-C |
73-B |
74-A |
75-D |
76-B |
77-A |
78-B |
79-A |
80-C |
ĐỀ THI SỐ 3
ĐỀ THI THỬ THPT QG MÔN HÓA HỌC NĂM 2022 TRƯỜNG THPT HIỆP THÀNH - ĐỀ 03
Câu 41. Kim loại nào sau đây có độ cứng cao nhất?
A. Cs. B. Fe. C. Cu. D. Cr.
Câu 42. Kim loại nào sau đây tan tốt trong nước dư ở điều kiện thường?
A. Na. B. Al. C. Be. D. Mg.
Câu 43. Kim loại nào sau đây có tính khử yếu nhất?
A. Fe. B. Cu. C. Mg. D. Ag.
Câu 44. Kim loại nào sau đây không bị thụ động hóa bởi dung dịch H2SO4 đặc, nguội?
A. Cu. B. Fe C. Al D. Cr.
Câu 45. Kim loại nào sau đây điều chế được bằng phương pháp nhiệt luyện với chất khử là CO?
A. Mg. B. Al. C. Ag. D. Fe.
Câu 46. Thạch cao nung được dùng để đúc tượng vì khi trộn với nước thì giãn nở về thể tích, nên rất ăn khuôn. Công thức của thạch cao nung là
A. CaSO4. B. CaSO4.H2O. C. CaCO3. D. CaSO4.2H2O.
Câu 47. Các đồ vật bằng nhôm bền trong không khí vì có lớp chất X bảo vệ. Chất X là
A. Al(OH)3. B. Al2(SO4)3. C. Al2O3. D. AlCl3.
Câu 48. Điện phân dung dịch NaCl với điện cực trơ, màng ngăn xốp thì ở catot thu được khí nào sau đây?
A. H2. B. Cl2. C. CO2. D. O2.
Câu 49. Hóa chất nào sau đây được dùng để nhận biết MgO và Al là
A. dung dịch NaOH. B. dung dịch NaCl. C. dung dịch KNO3. D. nước.
Câu 50. Kim loại Fe không phản ứng với
A. khí Cl2, to. B. dung dịch H2SO4 loãng, nguội.
C. dung dịch AgNO3. D. dung dịch AlCl3.
---(Để xem tiếp nội dung từ câu 51 đến câu 80 của đề thi số 3 các em vui lòng xem Online hoặc Đăng nhập vào HOC247 để tải về máy)---
ĐÁP ÁN ĐỀ THI SỐ 3
|
41-D |
42-A |
43-D |
44-A |
45-D |
46-B |
47-C |
48-A |
49-A |
50-D |
|
51-D |
52-C |
53-C |
54-B |
55-A |
56-B |
57-A |
58-C |
59-A |
60-D |
|
61-B |
62-B |
63-D |
64-D |
65-D |
66-B |
67-C |
68-B |
69-A |
70-C |
|
71-C |
72-B |
73-B |
74-B |
75-B |
76-D |
77-A |
78-A |
79-A |
80-B |
ĐỀ THI SỐ 4
ĐỀ THI THỬ THPT QG MÔN HÓA HỌC NĂM 2022 TRƯỜNG THPT HIỆP THÀNH - ĐỀ 04
Câu 1. Cho chất X tác dụng với dung dịch NaOH, thu được C2H5COONa và CH3OH. Chất X là
A. C2H5COOCH3. B. CH3COOC2H5. C. C2H5COOH. D. CH3COOH.
Câu 2. Công thức của axit oleic là
A. C17H33COOH. B. HCOOH. C. C15H31COOH. D. CH3COOH
Câu 3. Cacbonhidrat nào có nhiều trong nho hoặc hoa quả chín?
A. Glucozơ. B. Xenlulozơ. C. Fructozơ. D. Saccarozơ.
Câu 4. Chất nào dưới đây làm quỳ tím hóa xanh?
A. CH3COOH. B. C6H5NH2. C. CH3OH. D. C2H5NH2.
Câu 5. Số nguyên tử oxi trong phân tử glixin là
A. 2. B. 1. C. 4. D. 3.
Câu 6. Tên gọi của polime có công thức (-CH2-CH2-) n là
A. poly (vinyl clorua). B. polietilen.
C. poly (metyl metacrylat). D. polistiren.
Câu 7. Tính chất nào sau đây của kim loại không phải do các electron tự do gây ra?
A. Tính dẻo. B. Độ cứng. C. Tính dẫn điện. D. Ánh kim.
Câu 8. Cho dãy kim loại: Na, Mg, Fe, Cu. Kim loại có tính khử yếu nhất là
A. Mg. B. Cu. C. Na. D. Fe.
Câu 9. Sự ăn mòn hóa học là quá trình
A. khử. B. oxi hóa. C. điện phân. D. oxi hóa – khử.
Câu 10. Kim loại nào sau đây có thể điều chế được bằng phản ứng nhiệt nhôm?
A. Na. B. Al. C. Ca. D. Fe.
---(Để xem tiếp nội dung từ câu 11 đến câu 40 của đề thi số 4 các em vui lòng xem Online hoặc Đăng nhập vào HOC247 để tải về máy)---
ĐÁP ÁN ĐỀ THI SỐ 4
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
A |
A |
A |
D |
A |
B |
B |
B |
D |
D |
D |
C |
D |
C |
A |
A |
D |
A |
B |
A |
|
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
|
B |
C |
A |
C |
C |
D |
A |
C |
B |
A |
D |
A |
C |
A |
D |
A |
B |
D |
C |
B |
ĐỀ THI SỐ 5
ĐỀ THI THỬ THPT QG MÔN HÓA HỌC NĂM 2022 TRƯỜNG THPT HIỆP THÀNH - ĐỀ 05
Câu 41: Kim loại được dùng phổ biến để tạo trang sức, có tác dụng bảo vệ sức khỏe là
A. Sắt tây.
B. Sắt.
C. Đồng.
D. Bạc.
Câu 42: Dãy gồm các kim loại đều tác dụng với dung dịch H2SO4 loãng là
A. Al, Mg, Cu.
B. Zn, Mg, Ag.
C. Mg, Zn, Fe.
D. Al, Fe, Ag.
Câu 43: Dãy gồm các ion kim loại có tính oxi hóa giảm dần là
A. Fe3+, Fe2+, Cu2+.
B. Cu2+, Fe3+, Fe2+.
C. Fe3+, Cu2+, Fe2+.
D. Fe2+, Cu2+, Fe3+.
Câu 44: Kim loại phản ứng được với dung dịch FeSO4 là
A. Cu.
B. Pb.
C. Mg.
D. Ni
Câu 45: Kim loại nào sau đây tan hết trong nước dư ở nhiệt độ thường tạo ra dung dịch bazơ?
A. K.
B. Fe.
C. Zn.
D. Al.
Câu 46: Dung dịch nào sau đây tác dụng được với kim loại Cu?
A. HCl.
B. HNO3 loãng.
C. H2SO4 loãng.
D. KOH.
Câu 47: Cho biết số hiệu nguyên tử của Al là Z=13. Vị trí của Al trong bảng tuần hoàn là
A. chu kì 3, nhóm IIIA
B. chu kì 3, nhóm IA
C. chu kì 2, nhóm IIIA
D. chu kì 3, nhóm IIIB
Câu 48: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử Na là
A. 2s1. B. 3s1. C. 4s1. D. 3p1.
Câu 49: Để phân biệt dung dịch BaCl2 với dung dịch NaCl, người ta dùng dung dịch
A. HNO3. B. Na2SO4. C. KNO3. D. NaNO3.
Câu 50: Cho dung dịch NaOH đến dư vào dung dịch FeSO4 (không có không khí), sau khi phản ứng hoàn toàn thu được chất kết tủa có màu
A. nâu đỏ. B. vàng. C. trắng hơi xanh. D. trắng.
---(Để xem tiếp nội dung từ câu 51 đến câu 80 của đề thi số 5 các em vui lòng xem Online hoặc Đăng nhập vào HOC247 để tải về máy)---
ĐÁP ÁN ĐỀ THI SỐ 5
|
41-D |
42-C |
43-C |
44-C |
45-A |
46-B |
47-A |
48-B |
49-B |
50-C |
|
51-B |
52-D |
53-C |
54-B |
55-D |
56-C |
57-C |
58-B |
59-A |
60-C |
|
61-B |
62-B |
63-B |
64-C |
65-A |
66-C |
67-A |
68-A |
69-B |
70-D |
|
71-A |
72-B |
73-A |
74-B |
75-B |
76-A |
77-D |
78-A |
79-A |
80-B |
Trên đây là trích dẫn một phần nội dung Bộ 5 đề thi thử THPT QG môn Hóa học năm 2021-2022 có đáp án Trường THPT Hiệp Thành. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Ngoài ra các em có thể tham khảo thêm một số tư liệu cùng chuyên mục tại đây:
- Bộ 5 đề thi thử THPT QG môn Hóa học năm 2021-2022 có đáp án Trường THPT Lý Tự Trọng
- Bộ 5 đề thi thử THPT QG môn Hóa học năm 2021-2022 có đáp án Trường THPT Hà Huy Tập
Thi Online:
Chúc các em học tốt!













