Vß╗øi mong muß╗æn gi├║p c├Īc em hß╗Źc sinh lß╗øp 12 c├│ th├¬m t├Āi liß╗ću ├┤n tß║Łp chuß║®n bß╗ŗ cho k├¼ thi ─æß╗Öi tuyß╗ān sß║»p tß╗øi, HOC247 xin giß╗øi thiß╗ću ─æß║┐n c├Īc em t├Āi liß╗ću Bß╗Ö 5 ─æß╗ü thi HSG m├┤n H├│a hß╗Źc 12 n─ām 2021-2022 Sß╗¤ GD&─ÉT Nam ─Éß╗ŗnh gß╗ōm phß║¦n ─æß╗ü v├Ā ─æ├Īp ├Īn giß║Żi chi tiß║┐t, gi├║p c├Īc em ├┤n tß║Łp, r├©n luyß╗ćn k─® n─āng l├Ām ─æß╗ü. Mß╗Øi c├Īc em c├╣ng tham khß║Żo. Ch├║c c├Īc em ─æß║Īt kß║┐t quß║Ż hß╗Źc tß║Łp tß╗æt.
|
Sß╗× GI├üO Dß╗żC V├Ć ─É├ĆO Tß║ĀO NAM ─Éß╗ŖNH |
─Éß╗Ć THI CHß╗īN Hß╗īC SINH GIß╗ÄI M├öN H├ōA Hß╗īC 12 N─éM Hß╗īC 2021-2022 Thß╗Øi gian l├Ām b├Āi 50 ph├║t |
─Éß╗Ć THI Sß╗É 1
C├óu 1: Th├Ānh phß║¦n ch├Łnh cß╗¦a cao su thi├¬n nhi├¬n l├Ā
A. poliisopren. B. polibuta─æien. C. polistiren. D. poli(vinyl clorua).
C├óu 2: Cacbon monooxit l├Ā chß║źt kh├Ł rß║źt ─æß╗Öc. C├┤ng thß╗®c cß╗¦a cacbon monooxit l├Ā
A. CO2. B. CH4. C. CCl4. D. CO.
C├óu 3: T├¬n gß╗Źi cß╗¦a este CH3COOC2H5 l├Ā
A. etyl propionat. B. propyl axetat. C. etyl axetat. D. metyl propionat.
C├óu 4: Monosaccarit X c├│ khß║Ż n─āng l├Ām mß║źt m├Āu nŲ░ß╗øc brom. T├¬n gß╗Źi cß╗¦a X l├Ā
A. saccarozŲĪ. B. fructozŲĪ. C. glucozŲĪ. D. amilozŲĪ.
C├óu 5: Sß╗æ nguy├¬n tß╗Ł oxi trong ph├ón tß╗Ł saccarozŲĪ l├Ā
A. 22. B. 11. C. 12. D. 6.
C├óu 6: Chß║źt n├Āo sau ─æ├óy l├Ā amin bß║Łc hai?
A. ─Éimetylamin. B. Anilin. C. Hexametylen─æiamin. D. Propan-2-amin.
C├óu 7: Vß║Łt liß╗ću polime n├Āo sau ─æ├óy kh├┤ng chß╗®a nguy├¬n tß╗æ nitŲĪ trong ph├ón tß╗Ł?
A. TŲĪ axetat. B. TŲĪ capron. C. TŲĪ nitron. D. TŲĪ nilon-6,6.
C├óu 8: Hß╗Żp chß║źt n├Āo sau ─æ├óy d├╣ng ─æß╗ā sß║Żn xuß║źt kim loß║Īi nh├┤m?
A. Al2(SO4)3. B. Al2O3. C. AlCl3. D. Al4C3.
C├óu 9: PhŲ░ŲĪng ph├Īp thß╗¦y luyß╗ćn ─æiß╗üu chß║┐ ─æŲ░ß╗Żc kim loß║Īi n├Āo sau ─æ├óy?
A. Na. B. Mg. C. Cu. D. Ca.
C├óu 10: Trong c├Īc kim loß║Īi sau ─æ├óy, kim loß║Īi dß║╗o nhß║źt l├Ā
A. Cs. B. Al. C. Ag. D. Au.
C├óu 11: Nh├ó╠Żn ─æß╗ŗnh na╠Ćo sau ─æ├óy ─æu╠üng?
A. CaSO4.2H2O du╠Ćng ─æ├¬╠ē bo╠ü b├┤╠Żt khi ga╠āy xŲ░ŲĪng.
B. Na2CO3 dß╗ģ bß╗ŗ nhiß╗ćt ph├ón khi nung n├│ng.
C. C├│ thß╗ā la╠Ćm m├¬╠Ćm nŲ░ŲĪ╠üc cŲ░╠üng vi╠ānh cŲ░╠ēu bß║▒ng c├Īch ─æun n├│ng.
D. CaCO3 tan dß║¦n trong nŲ░ß╗øc c├│ h├▓a tan kh├Ł CO2.
C├óu 12: Th├Ł nghiß╗ćm n├Āo sau ─æ├óy chß╗ē xß║Ży ra hiß╗ćn tŲ░ß╗Żng ─ān m├▓n h├│a hß╗Źc?
A. Nh├║ng thanh Zn nguy├¬n chß║źt v├Āo dung dß╗ŗch CuSO4.
B. Nh├║ng thanh Fe v├Āo dung dß╗ŗch HCl lo├Żng c├│ nhß╗Å th├¬m mß╗Öt v├Āi giß╗Źt CuSO4.
C. Nh├║ng thanh Cu nguy├¬n chß║źt v├Āo dung dß╗ŗch FeCl3.
D. ─Éß╗ā thanh th├®p (hß╗Żp kim Fe-C) ngo├Āi kh├┤ng kh├Ł ß║®m.
C├óu 13: Cho hß╗Śn hß╗Żp axit axetic v├Ā axit acrylic t├Īc dß╗źng vß╗øi glixerol thu ─æŲ░ß╗Żc tß╗æi ─æa bao nhi├¬u trieste kh├┤ng no mß║Īch hß╗¤?
A. 2. B. 4. C. 5. D. 6.
C├óu 14: Nhß║Łn ─æß╗ŗnh n├Āo sau ─æ├óy l├Ā ─æ├║ng?
A. C├Īc aminoaxit l├Ā c├Īc hß╗Żp chß║źt hß╗»u cŲĪ ─æa chß╗®c.
B. Anbumin cß╗¦a l├▓ng trß║»ng trß╗®ng thuß╗Öc loß║Īi protein phß╗®c tß║Īp.
C. Dung dß╗ŗch lysin l├Ām quß╗│ t├Łm h├│a xanh.
D. Anilin c├│ t├Łnh bazŲĪ v├Ā l├Ām xanh quß╗│ t├Łm ß║®m.
C├óu 15: Th├¬m NaOH v├Āo dung dß╗ŗch chß║źt X thß║źy tho├Īt ra kh├Ł c├│ m├╣i khai. Nß║┐u th├¬m AgNO3 v├Āo dung dß╗ŗch X th├¼ thu ─æŲ░ß╗Żc kß║┐t tß╗¦a m├Āu v├Āng. C├┤ng thß╗®c cß╗¦a X l├Ā
A. Na2SO4. B. NH4Cl. C. Na3PO4. D. (NH4)3PO4.
C├óu 16: Nhß║Łn ─æß╗ŗnh n├Āo sau ─æ├óy l├Ā ─æ├║ng?
A. C├Īc este thŲ░ß╗Øng l├Ā chß║źt lß╗Ång, tan tß╗æt trong nŲ░ß╗øc.
B. Phß║Żn ß╗®ng x├Ā ph├▓ng h├│a chß║źt b├®o l├Ā phß║Żn ß╗®ng mß╗Öt chiß╗üu.
C. Chß║źt b├®o rß║»n chß╗¦ yß║┐u chß╗®a c├Īc gß╗æc axit b├®o kh├┤ng no.
D. Benzyl axeat c├│ m├╣i thŲĪm cß╗¦a chuß╗æi ch├Łn.
C├óu 17: Hß╗Żp chß║źt X c├│ c├┤ng thß╗®c C7H8O chß╗®a v├▓ng benzen trong ph├ón tß╗Ł, biß║┐t X t├Īc dß╗źng ─æŲ░ß╗Żc vß╗øi dung dß╗ŗch NaOH. Sß╗æ ─æß╗ōng ph├ón cß║źu tß║Īo ph├╣ hß╗Żp vß╗øi X l├Ā
A. 5. B. 2. C. 3. D. 4.
C├óu 18: Nhß║Łn ─æß╗ŗnh n├Āo sau ─æ├óy ─æ├║ng?
A. Ph├©n chua c├│ c├┤ng thß╗®c NaAl(SO4)2.12H2O c├│ khß║Ż n─āng l├Ām trong nŲ░ß╗øc sinh hoß║Īt.
B. C├│ thß╗ā d├╣ng kh├Ł CO2 ─æß╗ā dß║Łp tß║»t c├Īc ─æ├Īm ch├Īy cß╗¦a kim loß║Īi Mg .
C. Hß╗Śn hß╗Żp chß╗®a c├Īc chß║źt Na2O, Al2O3 c├│ c├╣ng sß╗æ mol tan ho├Ān to├Ān trong nŲ░ß╗øc dŲ░.
D. Al l├Ā chß║źt lŲ░ß╗Īng t├Łnh, tan ─æŲ░ß╗Żc trong dung dß╗ŗch HCl v├Ā dung dß╗ŗch NaOH.
C├óu 19: Ph├Īt biß╗āu n├Āo sau ─æ├óy l├Ā sai?
A. GlucozŲĪ tß╗ōn tß║Īi ß╗¤ dß║Īng mß║Īch hß╗¤ v├Ā dß║Īng mß║Īch v├▓ng.
B. FructozŲĪ l├Ā ─æß╗ōng ph├ón cß╗¦a glucozŲĪ.
C. Thß╗¦y ph├ón glucozŲĪ thu ─æŲ░ß╗Żc ancol etylic.
D. SaccarozŲĪ thuß╗Öc loß║Īi ─æisaccarit.
C├óu 20: Hß╗Śn hß╗Żp X gß╗ōm Fe v├Ā Cu, trong ─æ├│ Fe chiß║┐m 28% khß╗æi lŲ░ß╗Żng. Cho 40 gam X t├Īc dß╗źng vß╗øi dung dß╗ŗch HCl dŲ░, thß║źy c├│ V l├Łt kh├Ł (─æktc) bay ra. Gi├Ī trß╗ŗ cß╗¦a V l├Ā
A. 6,72. B. 4,48. C. 14,56. D. 7,28.
C├óu 21: Cho c├Īc kim loß║Īi Ba, Mg, Al, Fe, Cu lß║¦n lŲ░ß╗Żt t├Īc dß╗źng vß╗øi lŲ░ß╗Żng dŲ░ dung dß╗ŗch FeCl3. Sß╗æ phß║Żn ß╗®ng tß║Īo ─æŲ░ß╗Żc kß║┐t tß╗¦a l├Ā
A. 1. B. 2. C. 3. D. 4.
C├óu 22: Vitamin A (retinol) rß║źt cß║¦n thiß║┐t ─æß╗æi vß╗øi sß╗®c khß╗Åe con ngŲ░ß╗Øi, vitamin A l├Ā chß║źt kh├┤ng tan trong nŲ░ß╗øc, h├▓a tan tß╗æt trong chß║źt b├®o. C├┤ng thß╗®c cß╗¦a vitamin A nhŲ░ sau:
.jpg?enablejsapi=1)
Nhß║Łn ─æß╗ŗnh n├Āo sau ─æ├óy vß╗ü vitamin A l├Ā ─æ├║ng?
A. C├┤ng thß╗®c ph├ón tß╗Ł l├Ā C20H30O.
B. Cacbon chiß║┐m 72,10% khß╗æi lŲ░ß╗Żng ph├ón tß╗Ł. .
C. L├Ā mß╗Öt hß╗Żp chß║źt phenol.
D. Hi─æro chiß║┐m 10,72% khß╗æi lŲ░ß╗Żng ph├ón tß╗Ł.
C├óu 23: Cho c├Īc polime sau: Polietilen, poli (metyl metacrylat), xenlulozŲĪ, tŲĪ nitron, tŲĪ nilon-6,6. Sß╗æ polime ─æiß╗üu chß║┐ bß║▒ng phß║Żn ß╗®ng tr├╣ng hß╗Żp l├Ā
A. 2. B. 1. C. 4. D. 3.
C├óu 24: Thß╗¦y ph├ón pentapeptit X (Ala-Ala-Gly-Ala-Ala) thu ─æŲ░ß╗Żc tß╗æi ─æa bao nhi├¬u ─æipeptit?
A. 1. B. 2. C. 4. D. 3.
C├óu 25: Cho c├Īc h├│a chß║źt sau: NaOH, Ca(OH)2, Na2CO3, Na3PO4, HCl. Sß╗æ chß║źt c├│ thß╗ā sß╗Ł dß╗źng ─æß╗ā l├Ām mß╗üm nŲ░ß╗øc c├│ t├Łnh cß╗®ng tß║Īm thß╗Øi l├Ā
A. 2. B. 3. C. 5. D. 4.
C├óu 26: Cß║Ęp chß║źt n├Āo sau ─æ├óy kh├┤ng xß║Ży ra phß║Żn ß╗®ng trong dung dß╗ŗch?
A. NH4Cl v├Ā NaOH. B. NaOH v├Ā K2CO3.
C. NaCl v├Ā AgNO3. D. NaHSO4 v├Ā NaHCO3.
C├óu 27: Cho 20,4 gam HCOOC6H4CH3 t├Īc dß╗źng vß╗øi 200 ml dung dß╗ŗch NaOH 2,25M ─æun n├│ng. Sau khi phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān thu ─æŲ░ß╗Żc dung dß╗ŗch X, c├┤ cß║Īn X thu ─æŲ░ß╗Żc a gam chß║źt rß║»n khan. Gi├Ī trß╗ŗ cß╗¦a a l├Ā
A. 35,7 gam. B. 18,3 gam. C. 19,8 gam. D. 24,3 gam.
C├óu 28: Cho 3,5a gam hß╗Śn hß╗Żp X gß╗ōm C v├Ā S t├Īc dß╗źng vß╗øi lŲ░ß╗Żng dŲ░ dung dß╗ŗch HNO3 ─æß║Ęc, n├│ng, thu ─æŲ░ß╗Żc 3,584 lit hß╗Śn hß╗Żp kh├Ł Y (─æo ß╗¤ ─æktc) gß╗ōm NO2 v├Ā CO2. Dß║½n to├Ān bß╗Ö Y qua b├¼nh ─æß╗▒ng dung dß╗ŗch nŲ░ß╗øc v├┤i trong dŲ░ thu ─æŲ░ß╗Żc 12,5a gam kß║┐t tß╗¦a. Biß║┐t c├Īc phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān. Gi├Ī trß╗ŗ cß╗¦a a l├Ā
A. 0,40. B. 0,24. C. 0,32. D. 0,16.
C├óu 29: Cho 5,6 gam Fe v├Āo dung dß╗ŗch chß╗®a 0,15 mol AgNO3 v├Ā 0,2 mol Cu(NO3)2, sau mß╗Öt thß╗Øi gian thu ─æŲ░ß╗Żc 11,425 gam chß║źt rß║»n v├Ā dung dß╗ŗch X. T├Īch lß║źy chß║źt rß║»n, th├¬m 6,5 gam Zn v├Ā 4,8 gam Mg v├Āo dung dß╗ŗch X, sau khi c├Īc phß║Żn ß╗®ng ho├Ān to├Ān thu ─æŲ░ß╗Żc th├¬m m gam chß║źt rß║»n. Gi├Ī trß╗ŗ cß╗¦a m l├Ā
A. 21,05 gam. B. 24,8 gam. C. 29,0 gam. D. 23,75 gam.
C├óu 30: Tiß║┐n h├Ānh phß║Żn ß╗®ng theo c├Īc bŲ░ß╗øc sau:
BŲ░ß╗øc 1: Lß║źy 2 ml dung dß╗ŗch AgNO3 v├Āo ß╗æng nghiß╗ćm sß║Īch.
BŲ░ß╗øc 2: Nhß╗Å tß╗½ tß╗½ dung dß╗ŗch NH3 v├Āo ß╗æng nghiß╗ćm thu ─æŲ░ß╗Żc kß║┐t tß╗¦a, sau ─æ├│ kß║┐t tß╗¦a tan dß║¦n ─æß║┐n hß║┐t, tß║Īo dung dß╗ŗch trong suß╗æt kh├┤ng m├Āu.
BŲ░ß╗øc 3: Sß╗źc kh├Ł axetilen v├Āo dung dung dß╗ŗch trong ß╗æng nghiß╗ćm, quan s├Īt hiß╗ćn tŲ░ß╗Żng.
Cho c├Īc ph├Īt nhß║Łn x├®t sau:
(a) Sau bŲ░ß╗øc 3 trong ß╗æng nghiß╗ćm xuß║źt hiß╗ćn kß║┐t tß╗¦a m├Āu trß║»ng bß║Īc.
(b) ß╗× bŲ░ß╗øc 3 xß║Ży ra phß║Żn ß╗®ng oxi h├│a axetilen.
(c) Trong sß║Żn phß║®m kß║┐t tß╗¦a thu ─æŲ░ß╗Żc ß╗¤ bŲ░ß╗øc 3, cacbon chiß║┐m 10% khß╗æi lŲ░ß╗Żng.
(d) C├│ thß╗ā ph├ón biß╗ćt axetilen vß╗øi propin dß╗▒a v├Āo th├Ł nghiß╗ćm tr├¬n.
(e) ß╗× bŲ░ß╗øc 3, nß║┐u cho glucozŲĪ v├Āo ß╗æng nghiß╗ćm, ─æun n├│ng th├¼ hiß╗ćn tŲ░ß╗Żng xß║Ży ra tŲ░ŲĪng tß╗▒ nhŲ░ th├Ł nghiß╗ćm tr├¬n.
Sß╗æ nhß║Łn x├®t ─æ├║ng l├Ā
A. 1. B. 2. C. 3. D. 4.
C├óu 31: Chß║źt b├®o X tß║Īo bß╗¤i 3 axit b├®o Y, Z, T. Cho 39,18 gam E gß╗ōm X, Y, Z, T t├Īc dß╗źng vß╗øi H2 dŲ░ (Ni, t┬░) thu ─æŲ░ß╗Żc 39,48 gam hß╗Śn hß╗Żp chß║źt b├®o no v├Ā c├Īc axit b├®o no. Mß║Ęt kh├Īc, ─æß╗ā t├Īc dß╗źng ho├Ān to├Ān vß╗øi 39,18 gam E cß║¦n vß╗½a ─æß╗¦ 0,135 mol NaOH, thu ─æŲ░ß╗Żc glixerol v├Ā 41,01 gam muß╗æi. ─Éß╗ā ─æß╗æt ch├Īy hß║┐t 39,18 gam E cß║¦n vß╗½a ─æß╗¦ a mol O2. Gi├Ī trß╗ŗ cß╗¦a a l├Ā
A. 3,75. B. 5,01. C. 3,54. D. 4,29.
C├óu 32: Hß╗Śn hß╗Żp E gß╗ōm amin X no, mß║Īch hß╗¤ v├Ā hi─ærocacbon Y (sß╗æ mol X lß╗øn hŲĪn sß╗æ mol Y). ─Éß╗æt ch├Īy hß║┐t 0,52 mol E cß║¦n d├╣ng vß╗½a ─æß╗¦ 5,02 mol O2, thu ─æŲ░ß╗Żc N2, CO2 v├Ā 3,88 mol H2O. Mß║Ęt kh├Īc, nß║┐u cho 0,52 mol E t├Īc dß╗źng vß╗øi dung dß╗ŗch HCl dŲ░ th├¼ lŲ░ß╗Żng HCl phß║Żn ß╗®ng tß╗æi ─æa l├Ā 0,56 mol. Khß╗æi lŲ░ß╗Żng cß╗¦a X trong 0,52 mol E l├Ā
A. 21,18 gam. B. 28,56 gam C. 24,00 gam D. 24,08 gam
C├óu 33: Cho hß╗Śn hß╗Żp X gß╗ōm muß╗æi A (C5H16O3N2) v├Ā B (C4H12O4N2) t├Īc dß╗źng vß╗øi mß╗Öt lŲ░ß╗Żng dung dß╗ŗch NaOH vß╗½a ─æß╗¦, ─æun n├│ng ─æß║┐n khi phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān rß╗ōi c├┤ cß║Īn thu ─æŲ░ß╗Żc m gam hß╗Śn hß╗Żp Y gß╗ōm hai muß╗æi khan D, E (MD < ME) v├Ā 0,1 mol hß╗Śn hß╗Żp Z gß╗ōm hai amin no, ─æŲĪn chß╗®c ─æß╗ōng ─æß║│ng kß║┐ tiß║┐p c├│ tß╗ē khß╗æi hŲĪi so vß╗øi H2 l├Ā 18,3. Khß╗æi lŲ░ß╗Żng cß╗¦a muß╗æi E trong hß╗Śn hß╗Żp Y l├Ā
A. 4,02 gam. B. 5,2 gam. C. 3,66 gam. D. 6,24 gam.
C├óu 34: Thß╗▒c hiß╗ćn c├Īc th├Ł nghiß╗ćm sau:
(a) Cho dung dß╗ŗch KOH v├Āo dung dß╗ŗch Ba(HCO3)2.
(b) Cho dung dß╗ŗch Ba(OH)2 ─æß║┐n dŲ░ v├Āo dung dß╗ŗch NH4HSO4.
(c) Cho Fe(OH)2 v├Āo dung dß╗ŗch HNO3 lo├Żng.
(d) Cho HCl v├Āo dung dß╗ŗch Fe(NO3)2.
(e) ─Éun n├│ng nhß║╣ dung dß╗ŗch NaHCO3.
(f) Cho CuS t├Īc dß╗źng vß╗øi dung dß╗ŗch HCl.
Sß╗æ th├Ł nghiß╗ćm thu ─æŲ░ß╗Żc chß║źt kh├Ł sau phß║Żn ß╗®ng l├Ā
A. 3. B. 5. C. 4. D. 6.
C├óu 35: Cho c├Īc ph├Īt biß╗āu sau:
(a) ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng, c├Īc amino axit l├Ā chß║źt rß║»n kh├┤ng m├Āu, tan tß╗æt trong nŲ░ß╗øc.
(b) Thß╗¦y ph├ón ho├Ān to├Ān amilopectin v├Ā xenlulozŲĪ ─æß╗üu thu ─æŲ░ß╗Żc sß║Żn phß║®m duy nhß║źt l├Ā glucozŲĪ.
(c) C├│ thß╗ā chuyß╗ān h├│a c├Īc chß║źt b├®o lß╗Ång th├Ānh chß║źt b├®o rß║»n bß║▒ng phß║Żn ß╗®ng hi─æro h├│a.
(d) C├Īc polime sß╗Ł dß╗źng l├Ām cao su ─æß╗üu ─æŲ░ß╗Żc tß╗Ģng hß╗Żp bß║▒ng phß║Żn ß╗®ng tr├╣ng ngŲ░ng.
(e) 1 mol tripeptit Gly-Ala-Glu t├Īc dß╗źng tß╗æi ─æa 3 mol HCl hoß║Ęc 4 mol NaOH.
Sß╗æ ph├Īt biß╗āu ─æ├║ng l├Ā
A. 3. B. 4. C. 5. D. 2.
C├óu 36: Cho 23,8 gam hß╗Śn hß╗Żp X gß╗ōm alanin, axit glutamic, isopropylamin v├Ā etylamin t├Īc dß╗źng vß╗øi dung dß╗ŗch NaOH dŲ░ th├¼ c├│ 0,25 mol NaOH ─æ├Ż tham gia phß║Żn ß╗®ng. ─Éß╗æt ch├Īy ho├Ān to├Ān 23,8 gam X, thu ─æŲ░ß╗Żc CO2, N2 v├Ā 18 gam H2O. Cho 47,6 gam X t├Īc dß╗źng vß╗øi dung dß╗ŗch HCl dŲ░, thu ─æŲ░ß╗Żc dung dß╗ŗch Y chß╗®a m gam muß╗æi. Gi├Ī trß╗ŗ cß╗¦a m l├Ā
A. 69,5. B. 70,75. C. 77,8. D. 81,4.
C├óu 37: H├▓a tan ho├Ān to├Ān 4,48 gam kim loß║Īi M v├Āo lŲ░ß╗Żng vß╗½a ─æß╗¦ dung dß╗ŗch H2SO4 lo├Żng th├¼ thu ─æŲ░ß╗Żc 1,792 l├Łt kh├Ł H2 (─æktc). T├Īch hß║┐t lŲ░ß╗Żng muß╗æi khß╗Åi dung dß╗ŗch sau phß║Żn ß╗®ng th├¼ thu ─æŲ░ß╗Żc 22,24 gam mß╗Öt muß╗æi X. Phß║¦n tr─ām khß╗æi lŲ░ß╗Żng cß╗¦a oxi trong X gß║¦n nhß║źt vß╗øi gi├Ī trß╗ŗ n├Āo sau ─æ├óy?
A. 28,8 % B. 63,3%. C. 57,6%. D. 21,1%.
C├óu 38: Hß║źp thß╗ź hß║┐t V l├Łt kh├Ł CO2 v├Āo dung dß╗ŗch X chß╗®a a mol NaOH v├Ā 0,2 mol Na2CO3 th├¼ thu ─æŲ░ß╗Żc dung dß╗ŗch Y chß╗ē chß╗®a c├Īc muß╗æi. Chia Y th├Ānh hai phß║¦n bß║▒ng nhau. Nhß╗Å tß╗½ tß╗½ 210 ml HCl 1 M v├Āo phß║¦n mß╗Öt, thu ─æŲ░ß╗Żc 2,912 l├Łt kh├Ł. Nhß╗Å tß╗½ tß╗½ phß║¦n hai v├Āo 210 ml HCl 1M thu ─æŲ░ß╗Żc 3,36 l├Łt kh├Ł tho├Īt ra. C├Īc kh├Ł ─æß╗üu ─æo ß╗¤ ─æiß╗üu kiß╗ćn ti├¬u chuß║®n. Gi├Ī trß╗ŗ cß╗¦a V v├Ā a lß║¦n lŲ░ß╗Żt l├Ā
A. 2,24 v├Ā 0,08. B. 3,36 v├Ā 0,1. C. 5,04 v├Ā 0,2. D. 4,48 v├Ā 0,16.
C├óu 39: Cho c├Īc th├Ł nghiß╗ćm sau:
(1) Cho hß╗Śn hß╗Żp Al v├Ā Na2O (tß╗ē lß╗ć mol 2:1) v├Āo nŲ░ß╗øc dŲ░.
(2) Cho dung dß╗ŗch NaHSO4 t├Īc dß╗źng vß╗øi dung dß╗ŗch Ba(HCO3)2 (tß╗ē lß╗ć mol 1:1).
(3) Cho dung dß╗ŗch NaHCO3 t├Īc dß╗źng vß╗øi dung dß╗ŗch K2CO3 (tß╗ē lß╗ć mol 1:1).
(4) Cho CO2 t├Īc dß╗źng vß╗øi dung dß╗ŗch KOH (tß╗ē lß╗ć mol 1:1).
(5) Cho dung dß╗ŗch (NH4)2SO4 t├Īc dß╗źng dung dß╗ŗch Ba(OH)2 (tß╗ē lß╗ć mol 1:1).
Sß╗æ th├Ł nghiß╗ćm sau phß║Żn ß╗®ng thu ─æŲ░ß╗Żc dung dß╗ŗch chß╗ē chß╗®a 1 chß║źt tan l├Ā
A. 2. B. 3. C. 4. D. 5.
C├óu 40: Cho 38,06 gam hß╗Śn hß╗Żp X gß╗ōm Na2O, K2O, CaO, BaO v├Ā Al (trong ─æ├│ oxi chiß║┐m 11,771% vß╗ü khß╗æi lŲ░ß╗Żng) tan ho├Ān to├Ān v├Āo nŲ░ß╗øc thu ─æŲ░ß╗Żc 1 lit dung dß╗ŗch Y v├Ā 13,44 l├Łt H2 (─æktc). Gi├Ī trß╗ŗ pH cß╗¦a Y gß║¦n nhß║źt vß╗øi gi├Ī trß╗ŗ n├Āo sau ─æ├óy?
A. 11,6. B. 13,1 C. 12,9. D. 12.
─É├üP ├üN ─Éß╗Ć THI Sß╗É 1
|
1A |
2D |
3C |
4C |
5B |
6A |
7A |
8B |
9C |
10D |
|
11D |
12C |
13C |
14C |
15D |
16B |
17C |
18C |
19C |
20B |
|
21A |
22A |
23D |
24D |
25D |
26B |
27A |
28D |
29B |
30A |
|
31C |
32B |
33A |
34C |
35B |
36A |
37B |
38D |
39B |
40B |
─Éß╗Ć THI Sß╗É 2
─Éß╗Ć THI HSG M├öN H├ōA Hß╗īC 12 N─éM 2021-2022 Sß╗× GD&─ÉT NAM ─Éß╗ŖNH ─Éß╗Ć Sß╗É 2
C├óu 1. (4,5 ─æiß╗ām)
1. Cho c├Īc sŲĪ ─æß╗ō phß║Żn ß╗®ng sau, trong ─æ├│ X1, X2, X3, X4, X5 l├Ā c├Īc hß╗Żp chß║źt v├┤ cŲĪ kh├Īc nhau v├Ā X1, X4 l├Ā nhß╗»ng chß║źt kß║┐t tß╗¦a trong dung dß╗ŗch.
AlCl3 + NaHCO3 ŌåÆ X1 + CO2 + NaCl
X1 + X2 ŌåÆ Al2(SO4)3 + Na2SO4 + H2O
NaHCO3 + X2 ŌåÆ CO2 + ......
X1 + Ba(OH)2 ŌåÆ H2O + X3
X2 + X3 + H2O ŌåÆ X1 + X4 + ........
NaHCO3 + NaOH ŌåÆ X5 + H2O
Al2(SO4)3 + X5 + H2O ŌåÆ X1 + CO2 + ......
X├Īc ─æß╗ŗnh X1, X2, X3, X4, X5. Viß║┐t c├Īc phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng xß║Ży ra.
2. Hß╗Śn hß╗Żp X gß╗ōm hai kim loß║Īi h├│a trß╗ŗ I v├Ā mß╗Öt kim loß║Īi h├│a trß╗ŗ II. H├▓a tan ho├Ān to├Ān 19,9 gam hß╗Śn hß╗Żp X v├Āo nŲ░ß╗øc, thu ─æŲ░ß╗Żc V1 l├Łt dung dß╗ŗch Y v├Ā 4,48 l├Łt kh├Ł H2 (─æktc). Dung dß╗ŗch Z l├Ā dung dß╗ŗch hß╗Śn hß╗Żp cß╗¦a hai axit: H2SO4 v├Ā HCl, trong ─æ├│ sß╗æ mol HCl gß║źp 2 lß║¦n sß╗æ mol H2SO4. Trung h├▓a V1 l├Łt dung dß╗ŗch Y bß║▒ng V2 l├Łt dung dß╗ŗch Z tß║Īo ra m gam hß╗Śn hß╗Żp muß╗æi. T├Łnh gi├Ī trß╗ŗ cß╗¦a m.
C├óu 2. (4,0 ─æiß╗ām)
1. C├│ n─ām lß╗Ź kh├┤ng nh├Żn, mß╗Śi lß╗Ź chß╗®a mß╗Öt trong n─ām dung dß╗ŗch sau: MgSO4, NaCl, H2SO4, Na2CO3, HCl. Chß╗ē ─æŲ░ß╗Żc d├╣ng th├¬m mß╗Öt thuß╗æc thß╗Ł l├Ā dung dß╗ŗch BaCl2, h├Ży tr├¼nh b├Āy phŲ░ŲĪng ph├Īp h├│a hß╗Źc nhß║Łn biß║┐t c├Īc lß╗Ź dung dß╗ŗch tr├¬n v├Ā viß║┐t c├Īc phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng xß║Ży ra.
2. H├▓a tan mß╗Öt lŲ░ß╗Żng Fe3O4 v├Āo dung dß╗ŗch HCl lo├Żng vß╗½a ─æß╗¦, thu ─æŲ░ß╗Żc dung dß╗ŗch X. Cho kim loß║Īi Cu dŲ░ v├Āo dung dß╗ŗch X, thu ─æŲ░ß╗Żc dung dß╗ŗch Y. Cho dung dß╗ŗch NaOH lo├Żng dŲ░ v├Āo dung dß╗ŗch Y thu ─æŲ░ß╗Żc kß║┐t tß╗¦a Z. Lß╗Źc, t├Īch kß║┐t tß╗¦a Z, ─æem nung trong kh├┤ng kh├Ł ─æß║┐n khß╗æi lŲ░ß╗Żng kh├┤ng ─æß╗Ģi, thu ─æŲ░ß╗Żc chß║źt rß║»n T. Viß║┐t c├Īc phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng h├│a hß╗Źc xß║Ży ra, x├Īc ─æß╗ŗnh th├Ānh phß║¦n cß╗¦a dung dß╗ŗch X, dung dß╗ŗch Y, kß║┐t tß╗¦a Z v├Ā chß║źt rß║»n T. Giß║Ż thiß║┐t c├Īc phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān.
C├óu 3. Cho 9,12 gam FeSO4 v├Ā 13,68 gam Al2(SO4)3 v├Āo 100 gam dung dß╗ŗch H2SO4 9,8% thu ─æŲ░ß╗Żc dung dß╗ŗch A. H├▓a tan 38,8 gam NaOH nguy├¬n chß║źt v├Āo dung dß╗ŗch A thu ─æŲ░ß╗Żc kß║┐t tß╗¦a B v├Ā dung dß╗ŗch C.
- T├Īch kß║┐t tß╗¦a B, sau ─æ├│ ─æem nung trong kh├┤ng kh├Ł ─æß║┐n khß╗æi lŲ░ß╗Żng kh├┤ng ─æß╗Ģi. T├Łnh khß╗æi lŲ░ß╗Żng chß║źt rß║»n c├▓n lß║Īi sau khi nung kß║┐t tß╗¦a B.
- Cho V l├Łt dung dß╗ŗch HCl 2M v├Āo dung dß╗ŗch C thu ─æŲ░ß╗Żc kß║┐t tß╗¦a, lß╗Źc kß║┐t tß╗¦a, ─æem nung ─æß║┐n khß╗æi lŲ░ß╗Żng kh├┤ng ─æß╗Ģi thu ─æŲ░ß╗Żc chß║źt rß║»n c├│ khß╗æi lŲ░ß╗Żng 2,55 gam. T├¼m gi├Ī trß╗ŗ cß╗¦a V.
Câu 4.
1. Chß╗ē d├╣ng hai h├│a chß║źt l├Ā kh├Ł CO2 v├Ā dung dß╗ŗch NaOH, n├¬u hai phŲ░ŲĪng ph├Īp ─æiß╗üu chß║┐ Na2CO3 trong ph├▓ng th├Ł nghiß╗ćm. Giß║Ż sß╗Ł c├Īc dß╗źng cß╗ź v├Ā ─æiß╗üu kiß╗ćn th├Ł nghiß╗ćm cß║¦n thiß║┐t c├│ ─æß╗¦.
2. Trong nŲ░ß╗øc thß║Żi c├┤ng nghiß╗ćp c├│ chß╗®a mß╗Öt lŲ░ß╗Żng c├Īc muß╗æi tan cß╗¦a mß╗Öt sß╗æ kim loß║Īi nß║Ęng nhŲ░: Pb, Fe, ... ─Éß╗ā xß╗Ł l├Į sŲĪ bß╗Ö nŲ░ß╗øc thß║Żi tr├¬n (l├Ām giß║Żm h├Ām lŲ░ß╗Żng c├Īc muß╗æi cß╗¦a kim loß║Īi nß║Ęng) c├│ thß╗ā sß╗Ł dß╗źng mß╗Öt h├│a chß║źt rß║╗ tiß╗ün, dß╗ģ kiß║┐m n├Āo? H├Ży viß║┐t c├Īc phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng minh hß╗Źa.
3. Hß╗Śn hß╗Żp rß║»n A gß╗ōm CuO v├Ā MgO. Cho luß╗ōng kh├Ł CO (dŲ░) ─æi qua 14,0 gam hß╗Śn hß╗Żp A nung n├│ng ─æß║┐n khi phß║Żn ß╗®ng ho├Ān to├Ān, thu ─æŲ░ß╗Żc 11,6 gam chß║źt rß║»n. T├Łnh khß╗æi lŲ░ß╗Żng CuO c├│ trong hß╗Śn hß╗Żp rß║»n A.
C├óu 5. (4,0 ─æiß╗ām)
1. NgŲ░ß╗Øi ta ─æß╗æt 5,6 gam Fe trong kh├Ł O2, sau mß╗Öt thß╗Øi gian thu ─æŲ░ß╗Żc m1 gam hß╗Śn hß╗Żp rß║»n A. H├▓a tan ho├Ān to├Ān hß╗Śn hß╗Żp rß║»n A trong 520 ml dung dß╗ŗch HCl 0,5M, thu ─æŲ░ß╗Żc dung dß╗ŗch B (chß╗ē chß╗®a 2 chß║źt tan l├Ā FeCl2 v├Ā FeCl3) v├Ā 0,224 l├Łt kh├Ł H2 (─æktc). Cho 0,2 mol AgNO3 v├Āo dung dß╗ŗch B, phß║Żn ß╗®ng ho├Ān to├Ān thu ─æŲ░ß╗Żc m2 gam kß║┐t tß╗¦a. T├Łnh gi├Ī trß╗ŗ cß╗¦a m1, m2.
2. Trong mß╗Öt b├¼nh k├Łn dung t├Łch kh├┤ng ─æß╗Ģi chß╗®a hß╗Śn hß╗Żp kh├Ł X gß╗ōm SO2 v├Ā O2 (c├│ mß║Ęt V2O5 vß╗øi thß╗ā t├Łch kh├┤ng ─æ├Īng kß╗ā), tß╗ē khß╗æi cß╗¦a hß╗Śn hß╗Żp kh├Ł X so vß╗øi kh├Ł H2 l├Ā 28. Nung n├│ng b├¼nh ─æß╗ā phß║Żn ß╗®ng h├│a hß╗Źc xß║Ży ra, sau ─æ├│ ─æŲ░a vß╗ü nhiß╗ćt ─æß╗Ö ban ─æß║¦u th├¼ thu ─æŲ░ß╗Żc hß╗Śn hß╗Żp kh├Ł Y. T├Łnh tß╗ē khß╗æi cß╗¦a hß╗Śn hß╗Żp kh├Ł Y so vß╗øi kh├Ł H2, biß║┐t hiß╗ću suß║źt phß║Żn ß╗®ng l├Ā 80%.
---(─Éß╗ā xem nß╗Öi dung ─æß║¦y ─æß╗¦, chi tiß║┐t ─æ├Īp ├Īn ─æß╗ü thi sß╗æ 2 vui l├▓ng xem Online hoß║Ęc ─É─āng nhß║Łp v├Āo HOC247 ─æß╗ā tß║Żi vß╗ü m├Īy)---
─Éß╗Ć THI Sß╗É 3
─Éß╗Ć THI HSG M├öN H├ōA Hß╗īC 12 N─éM 2021-2022 Sß╗× GD&─ÉT NAM ─Éß╗ŖNH ─Éß╗Ć Sß╗É 3
C├óu 1: 4 ─æiß╗ām
1. Cho c├Īc nguy├¬n tß╗Ł: 7N;14┬ŁSi; 15P:
a) Viß║┐t cß║źu h├¼nh electron, x├Īc ─æß╗ŗnh vß╗ŗ tr├Ł ( ├┤; chu k├¼; nh├│m); loß║Īi nguy├¬n tß╗æ(kim loß║Īi; phi kim; kh├Ł hiß║┐m)?
b) So s├Īnh t├Łnh kim loß║Īi hoß║Ęc phi kim cß╗¦a c├Īc nguy├¬n tß╗æ tr├¬n (nß║┐u c├│), giß║Żi th├Łch ngß║»n gß╗Źn?
c) Viß║┐t c├┤ng thß╗®c cß║źu tß║Īo hß╗Żp chß║źt vß╗øi hidro cß╗¦a c├Īc nguy├¬n tß╗æ tr├¬n v├Ā sß║»p xß║┐p ─æß╗Ö ph├ón cß╗▒c cß╗¦a li├¬n kß║┐t theo chiß╗üu giß║Żm dß║¦n
2. Cho dung dß╗ŗch HCOOH t├Īc dß╗źng vß╗øi nŲ░ß╗øc brom. L├║c ─æß║¦u nß╗ōng ─æß╗Ö cß╗¦a Br2 l├Ā 0,012 mol/l, sau 50 gi├óy nß╗ōng ─æß╗Ö l├Ā 0,0101 mol/l
a) Viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a phß║Żn ß╗®ng xß║Ży ra?
b) Trong khoß║Żng thß╗Øi gian phß║Żn ß╗®ng tr├¬n, h├Ży t├Łnh
- Tß╗æc ─æß╗Ö trung b├¼nh cß╗¦a phß║Żn ß╗®ng xß║Ży ra theo Br2
- Tß╗æc ─æß╗Ö trung b├¼nh tß║Īo ra sß║Żn phß║®m HBr
3. Cho dung dß╗ŗch FeSO4 v├Āo dung dß╗ŗch chß╗®a hß╗Śn hß╗Żp KHSO4 v├Ā NaNO3. H├Ży x├Īc ─æß╗ŗnh sß║Żn phß║®m v├Ā c├ón bß║▒ng phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a phß║Żn ß╗®ng xß║Ży ratheo phŲ░ŲĪng ph├Īp th─āng bß║▒ng electron ( x├Īc ─æß╗ŗnh sß╗æ oxi h├│a, t├¼m chß║źt oxi h├│a, chß║źt khß╗Ł, viß║┐t v├Ā chß╗ē r├Ą qua tr├¼nh n├Āo l├Ā qu├Ī tr├¼nh oxi h├│a, qu├Ī tr├¼nh khß╗Ł), biß║┐t rß║▒ng c├Īc muß╗æi ß╗¤ sß║Żn phß║®m ─æß╗üu l├Ā c├Īc muß╗æi sunfat v├Ā N+5 chß╗ē bß╗ŗ khß╗Ł vß╗ü N+2
4. A v├Ā B l├Ā hai nguy├¬n tß╗æ phi kim. A c├│ h├│a trß╗ŗ trong oxit cao nhß║źt l├Ā a0, h├│a trß╗ŗ trong hß╗Żp chß║źt vß╗øi hidro l├Ā aH, v├Ā a0 = aH. B c├│ h├│a trß╗Ź trong oxit cao nhß║źt l├Ā b0, h├│a trß╗ŗ trong hß╗Żp chß║źt vß╗øi hdro l├Ā bH v├Ā b0 = 7bH. A li├¬n kß║┐t vß╗øi B tß║Īo ra hß╗Żp chß║źt AxBy. X├Īc ─æß╗ŗnh x, y biß║┐t rß║▒ng A v├Ā B li├¬n kß║┐t vß╗øi nhau ─æß╗ā c├│ ─æŲ░ß╗Żc cß║źu h├¼nh electron bß╗ün vß╗»ng nhŲ░ kh├Ł hiß║┐m.
C├óu 2: 6 ─æiß╗ām
1. N├¬u hiß╗ćn tŲ░ß╗Żng v├Ā viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a phß║Żn ß╗®ng xß║Ży ra ( nß║┐u c├│) trong c├Īc trŲ░ß╗Øng hß╗Żp sau ─æ├óy:
a) Cho natri n├│ng chß║Ży v├Āo b├¼nh ─æß╗▒ng kh├Ł clo.
b) Cho dung dß╗ŗch bß║Īc nitrat v├Āo dung dß╗ŗch natriphotphat.
c) Cho dung dß╗ŗch axit sunfuric lo├Żng v├Āo dung dß╗ŗch natri thiosunfat ( Na2S2O3)
d) Cho tß╗½ tß╗½ ─æß║┐n dŲ░ dung dß╗ŗch amoniac v├Āo dung dß╗ŗch nh├┤m clorua
2. H├Ży viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a c├┤ng ─æoß║Īn hß║źp thß╗ź SO3 khi sß║Żn xuß║źt H2SO4 trong c├┤ng nghiß╗ćp bß║▒ng phŲ░ŲĪng ph├Īp tiß║┐p x├║c
3. A L├Ā mß╗Öt ─æŲĪn chß║źt halogen. Cho mß╗Öt lŲ░ß╗Żng A t├Īc dß╗źng hß║┐t vß╗øi magie thu ─æŲ░ß╗Żc 26,41 gam muß╗æi . C┼®ng lŲ░ß╗Żng A ─æ├│ t├Īc dß╗źng hß║┐t vß╗øi nh├┤m thu ─æŲ░ß╗Żc 25,84 gam muß╗æi. nß║┐u cho 5,6 gam sß║»t t├Īc dß╗źng hß║┐t vß╗øi A thu ─æŲ░ß╗Żc m gam muß╗æi.
a.T├¼m ─æŲĪn chß║źt halogen
b. Viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a c├Īc phß║Żn ß╗®ng xß║Ży ra v├Ā t├Łnh m?
4. Khi h├▓a tan hß║┐t 7,68 gam kim loß║Īi M bß║▒ng dung dß╗ŗch H2SO4 (─æß║Ęc, n├│ng, dŲ░) hoß║Ęc khi h├▓a tan hß║┐t 3,84 gam muß╗æi sunfua cß╗¦a kim loß║Īi n├Āy trong dung dß╗ŗch H2SO4 (─æß║Ęc, n├│ng, dŲ░) ─æß╗üu sinh ra sß╗æ mol kh├Ł SO2 nhŲ░ nhau.
a. Viß║┐t phŲ░ŲĪng tr├¼nh ion thu gß╗Źn cß╗¦a c├Īc phß║Żn ß╗®ng xß║Ży ra
b. x├Īc ─æß╗ŗnh kim loß║Īi M v├Ā c├┤ng thß╗®c ph├ón tß╗Ł muß╗æi sunfua
5. H├▓a tan hß║┐t 19,50 gam hß╗Śn hß╗Żp X gß╗ōm Al, Fe v├Āo 490,00 gam dung dß╗ŗch H2SO4 10,00% ( lo├Żng) thu ─æŲ░ß╗Żc 10,08 l├Łt kh├Ł ─æo ß╗¤ ─æktc v├Ā dung dß╗ŗch Y. cho Cl2 dŲ░ v├Āo dung dß╗ŗch Y, sau khi phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān thu ─æŲ░ß╗Żc dung dß╗ŗch Z. C├┤ cß║Īn dung dß╗ŗch Z thu ─æŲ░ß╗Żc m gam chß║źt rß║»n khan. Viß║┐t phŲ░ŲĪng tr├¼nh ion thu gß╗Źn cß╗¦a c├Īc phß║Żn ß╗®ng xß║Ży ra v├Ā t├Łnh m?
6. Dung dß╗ŗch X c├│ c├Īc ion: 8 mol Na+; 2 mol Ca2+; 1 mol Mg2+; 9 mol Cl-; 2 mol v├Ā x mol . Giß║Ż sß╗Ł gi├Ī mua h├│a chß║źt l├Ā: 6500─æß╗ōng/kg Na2CO3; 12800 ─æß╗ōng/kg Na3PO4. 12 H2O; 1600 ─æß╗ōng/kg NaOH; 2400 ─æß╗ōng/kg Ca(OH)2. ─Éß╗ā loß║Īi bß╗Å hß║┐t ion Mg2+ v├Ā Ca2+ trong X dŲ░ß╗øi dß║Īng kß║┐t tß╗¦a Mg(OH)2 hoß║Ęc Mg3(PO4)2 v├Ā CaCO3 hoß║Ęc Ca3(PO4)2 th├¼ cß║¦n ├Łt nhß║źt bao nhi├¬u tiß╗ün?
C├óu 3: 3,75 ─æiß╗ām
1. N├¬u t├Īc dß╗źng cß╗¦a ancol etylic v├Ā glixerol trong mß╗Öt loß║Īi nŲ░ß╗øc s├Īt khuß║®n ph├▓ng chß╗æng COVID-19
2. ─Éß╗æi vß╗øi c├Īc ph├ón tß╗Ł polisaccarit, h├Ży cho biß║┐t:
a) T├¬n li├¬n kß║┐t giß╗»a c├Īc mß║»t x├Łch.
b) Loß║Īi mß║Īch polime
3. Bß║▒ng phŲ░ŲĪng ph├Īp h├│a hß╗Źc ( n├¬u thuß╗æc thß╗Ł, c├Īch l├Ām, hiß╗ćn tŲ░ß╗Żng, viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc), h├Ży ph├ón biß╗ćt dung dß╗ŗch fructozŲĪ v├Ā dung dß╗ŗch saccarozŲĪ
4. ─Éß╗æt n├│ng sß╗Żi d├óy ─æß╗ōng kim loß║Īi ─æ├Ż cuß╗Ön th├Ānh h├¼nh l├▓ xo tr├¬n ngß╗Źn lß╗Ła ─æ├©n cß╗ōn ─æß║┐n khi ngß╗Źn lß╗Ła kh├┤ng c├▓n m├Āu xanh, dß╗½ng ─æß╗æt, ─æß╗ā nguß╗Öi, rß╗ōi lß║Īi ─æß╗æt n├│ng sß╗Żi d├óy ─æß╗ōng, sau ─æ├│ nh├║ng nhanh v├Āo cß╗æc chß╗®a 10ml cß╗ōn 960.
a) N├¬u sß╗▒ thay ─æß╗Ģi m├Āu cß╗¦a sß╗Żi d├óy ─æß╗ōng v├Ā viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a c├Īc phß║Żn ß╗®ng xß║Ży ra
b) Bß╗Å d├óy ─æß╗ōng ra khß╗Åi cß╗æc sau th├Ł nghiß╗ćm ß╗¤ tr├¬n, lß║źy to├Ān bß╗Ö phß║¦n dung dß╗ŗch cho phß║Żn ß╗®ng hß║┐t vß╗øi lŲ░ß╗Żng dŲ░ dung dß╗ŗch AgNO3/NH3 dŲ░ thu ─æŲ░ß╗Żc 8,64 gam Ag. Viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a phß║Żn ß╗®ng tr├Īng bß║Īc v├Ā t├Łnh hiß╗ću suß║źt cß╗¦a phß║Żn ß╗®ng oxi h├│a ancol etylic th├Ānh andehit axetic. Biß║┐t rß║▒ng ─æß╗Ö cß╗ōn l├Ā phß║¦n tr─ām thß╗ā t├Łch cß╗¦a ancol etylic trong dung dß╗ŗch ancol etylic v├Ā nŲ░ß╗øc, ancol etylic nguy├¬n chß║źt c├│ khß╗æi lŲ░ß╗Żng ri├¬ng l├Ā 0,80 g/ml
C├óu 4: 3 ─æiß╗ām
1. Hß╗Żp chß║źt hß╗»u cŲĪ A c├│ c├┤ng thß╗®c cß║źu tß║Īo nhŲ░ h├¼nh dŲ░ß╗øi ─æ├óy. Viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a phß║Żn ß╗®ng xß║Ży ra khi cho A t├Īc dß╗źng vß╗øi:
.jpg)
a) Na dŲ░
b) dung dß╗ŗch NaHCO3 dŲ░
c) dung dß╗ŗch NaOH theo tß╗ē lß╗ć mol 1: 1
d) dung dß╗ŗch NaOH dŲ░
2. Viß║┐t mß╗Öt phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a phß║Żn ß╗®ng xß║Ży ra trong mß╗Śi trŲ░ß╗Øng hß╗Żp sau
a) Thß╗¦y ph├ón este trong m├┤i trŲ░ß╗Øng axit tß║Īo ra mß╗Öt axit ─æŲĪn chß╗®c v├Ā mß╗Öt ancol ─æŲĪn chß╗®c.
b) Este ─æŲĪn chß╗®c t├Īc dß╗źng vß╗øi dung dß╗ŗch NaOH theo tß╗ē lß╗ć mol tŲ░ŲĪng ß╗®ng 1: 2
c) ─Éß╗æt ch├Īy muß╗æi natri cß╗¦a axit cacboxylic thu ─æŲ░ß╗Żc sß║Żn phß║®m chß╗ē c├│ hai chß║źt l├Ā Na2CO3 v├Ā CO2
d) Este t├Īc dß╗źng vß╗øi dung dß╗ŗch NaOH tß║Īo ra sß║Żn phß║®m chß╗ē c├│ hai chß║źt l├Ā H2O v├Ā CH3COONa
3. Cho dung dß╗ŗch quß╗│ t├Łm lß║¦n lŲ░ß╗Żt v├Āo ß╗æng nghiß╗ćm chß╗®a anilin v├Ā ß╗æng nghiß╗ćm kh├Īc chß╗®a benzylamin, th├¼ chß╗ē c├│ mß╗Öt ß╗æng nghiß╗ćm l├Ām dung dß╗ŗch quß╗│ t├Łm chuyß╗ān sang m├Āu xanh, ─æ├│ l├Ā ß╗æng nghiß╗ćm chß╗®a chß║źt n├Āo?
Viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc theo sŲĪ ─æß╗ō phß║Żn ß╗®ng sau, biß║┐t rß║▒ng tß╗ē lß╗ć sß╗æ mol c├Īc chß║źt tham gia phß║Żn ß╗®ng tr├¬n mß╗Śi phŲ░ŲĪng tr├¼nh h├│a hß╗Źc l├Ā 1: 1 v├Ā mß╗Śi m┼®i t├¬n chß╗ē xß║Ży ra mß╗Öt phß║Żn ß╗®ng
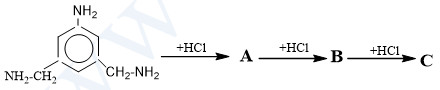
C├óu 5: 3,25 ─æiß╗ām
1. Hß╗Śn hß╗Żp A gß╗ōm c├Īc hidrocacbon l├Ā chß║źt kh├Ł ß╗¤ ─æiß╗üu kiß╗ćn thŲ░ß╗Øng v├Ā ─æß╗üu c├│ c├┤ng thß╗®c ─æŲĪn giß║Żn nhß║źt CnH2n+1. Tß╗ē khß╗æi hŲĪi cß╗¦a A so vß╗øi H2 l├Ā 18,5. Viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a phß║Żn ß╗®ng xß║Ży ra v├Ā t├Łnh thß╗ā t├Łch kh├Ł CO2 (─æŲĪ ß╗¤ ─æktc) thu ─æŲ░ß╗Żc khi ─æß╗æt ch├Īy 14,8 gam A
2. Hß╗Śn hß╗Żp E gß╗ōm ba este mß║Īch hß╗¤, trong ─æ├│ c├│ mß╗Öt este hai chß╗®c v├Ā hai este ─æŲĪn chß╗®c. Cho 31,100 gam E t├Īc dß╗źng ho├Ān to├Ān vß╗øi dung dß╗ŗch NaOH dŲ░, ─æun n├│ng ─æß║┐n phß║Żn ß╗®ng ho├Ān to├Ān, thu ─æŲ░ß╗Żc sß║Żn phß║®m c├│ hai muß╗æi v├Ā hai ancol no, ─æŲĪn chß╗®c, kß║┐ tiß║┐p trong d├Ży ─æß╗ōng ─æß║│ng, khß╗æi lŲ░ß╗Żng hai ancol l├Ā 16,500 gam. Khi ─æß╗æt ch├Īy ho├Ān to├Ān 31,100 gam E th├¼ cß║¦n 1,905 mol O2, thu ─æŲ░ß╗Żc H2O v├Ā 1,540 mol CO2. Biß║┐t rß║▒ng 31,100 gam E t├Īc dß╗źng ─æŲ░ß╗Żc vß╗øi tß╗æi ─æa 0,070 mol Br2 trong dung dß╗ŗch. T├Łnh phß║¦n tr─ām khß╗æi lŲ░ß╗Żng c├Īc este c├│ trong hß╗Śn hß╗Żp E?
---(─Éß╗ā xem nß╗Öi dung ─æß║¦y ─æß╗¦, chi tiß║┐t ─æ├Īp ├Īn ─æß╗ü thi sß╗æ 3 vui l├▓ng xem Online hoß║Ęc ─É─āng nhß║Łp v├Āo HOC247 ─æß╗ā tß║Żi vß╗ü m├Īy)---
─Éß╗Ć THI Sß╗É 4
─Éß╗Ć THI HSG M├öN H├ōA Hß╗īC 12 N─éM 2021-2022 Sß╗× GD&─ÉT NAM ─Éß╗ŖNH ─Éß╗Ć Sß╗É 4
C├óu 1: (4,0 ─æiß╗ām)
1. C├ón bß║▒ng c├Īc phß║Żn ß╗®ng oxi h├│a khß╗Ł sau theo phŲ░ŲĪng ph├Īp th─āng bß║▒ng electron:
a) Al + HNO3 ŌåÆ Al(NO3)3 + N2O + NO + H2O
Cho biß║┐t tß╗ē lß╗ć mol: \({n_{{N_2}O}}\,:\,{n_{NO}}\) = 2020 : 2021
b) FexOy + H2SO4 ŌåÆ Fe2(SO4)3 + SO2 + H2O
2. Viß║┐t c├Īc phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng xß║Ży ra vß╗øi mß╗Śi trŲ░ß╗Øng hß╗Żp sau:
a) Sß╗źc kh├Ł SO2 v├Āo dung dß╗ŗch nŲ░ß╗øc brom.
b) Cho dung dß╗ŗch Na2CO3 t├Īc dß╗źng vß╗øi dung dß╗ŗch AlCl3.
c) Cho dung dß╗ŗch H2SO4 t├Īc dß╗źng vß╗øi dung dß╗ŗch Ba(HCO3)2.
d) Cho dung dß╗ŗch H2SO4 ─æß║Ęc v├Āo saccarozŲĪ.
3. Tß╗Ģng sß╗æ hß║Īt proton, nŲĪtron v├Ā electron trong ion X3+ bß║▒ng 73. Trong X3+ sß╗æ hß║Īt mang ─æiß╗ćn nhiß╗üu hŲĪn sß╗æ hß║Īt kh├┤ng mang ─æiß╗ćn l├Ā 17. Viß║┐t cß║źu h├¼nh electron cß╗¦a X, X2+, X3+.
4. R l├Ā mß╗Öt nguy├¬n tß╗æ h├│a hß╗Źc ß╗¤ nh├│m A trong bß║Żng tuß║¦n ho├Ān. Oxit tŲ░ŲĪng ß╗®ng vß╗øi h├│a trß╗ŗ cao nhß║źt cß╗¦a R c├│ c├┤ng thß╗®c R2O5. Phß║¦n tr─ām vß╗ü khß╗æi lŲ░ß╗Żng cß╗¦a R trong hß╗Żp chß║źt kh├Ł cß╗¦a n├│ vß╗øi hi─æro l├Ā 91,18%.
a) X├Īc ─æß╗ŗnh nguy├¬n tß╗æ R.
b) X l├Ā hß╗Żp chß║źt chß╗®a nguy├¬n tß╗æ R trong quß║Ęng, cho biß║┐t MX = 310 g/mol; Z l├Ā mß╗Öt muß╗æi trung h├▓a chß╗®a R. H├Ży viß║┐t c├Īc phŲ░ŲĪng tr├¼nh h├│a hß╗Źc ─æß╗ā ho├Ān th├Ānh sŲĪ ─æß╗ō chuyß╗ān h├│a sau (mß╗Śi m┼®i t├¬n tŲ░ŲĪng ß╗®ng vß╗øi mß╗Öt phß║Żn ß╗®ng h├│a hß╗Źc):
X ŌåÆ R ŌåÆ RBr3 ŌåÆ Y ŌåÆ Z
C├óu 2: (4,0 ─æiß╗ām)
1.
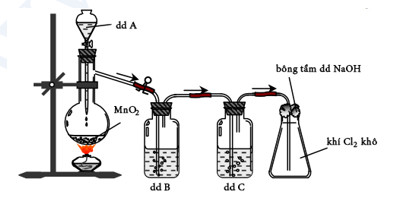
H├¼nh vß║Į ─æiß╗üu chß║┐ v├Ā thu kh├Ł clo trong ph├▓ng th├Ł nghiß╗ćm
a) Cho biß║┐t dung dß╗ŗch A, B, C l├Ā nhß╗»ng dung dß╗ŗch n├Āo? Viß║┐t phŲ░ŲĪng tr├¼nh ─æiß╗üu chß║┐ Cl2 trong th├Ł nghiß╗ćm tr├¬n.
b) N├¬u vai tr├▓ cß╗¦a dung dß╗ŗch B, C v├Ā b├┤ng tß║®m dung dß╗ŗch NaOH trong th├Ł nghiß╗ćm tr├¬n.
2. Chß╗ē d├╣ng quß╗│ t├Łm (c├Īc thiß║┐t bß╗ŗ cß║¦n thiß║┐t c├│ ─æß╗¦), h├Ży tr├¼nh b├Āy phŲ░ŲĪng ph├Īp ho├Ī hß╗Źc ─æß╗ā nhß║Łn biß║┐t c├Īc chß║źt trong c├Īc dung dß╗ŗch ri├¬ng biß╗ćt: Na2SO4, KHCO3, Na2CO3, KHSO4, NaOH, BaCl2. Viß║┐t phŲ░ŲĪng tr├¼nh ho├Ī hß╗Źc cß╗¦a c├Īc phß║Żn ß╗®ng xß║Ży ra.
3. X├Īc ─æß╗ŗnh c├Īc chß║źt A, B, C, D v├Ā viß║┐t phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng (ghi r├Ą ─æiß╗üu kiß╗ćn nß║┐u c├│) thß╗▒c hiß╗ćn sŲĪ ─æß╗ō sau:
CH3COOH ŌåÆ A ŌåÆ CH4ŌåÆ B ŌåÆC ŌåÆ D ŌåÆ Cao su Buna
4. XenlulozŲĪ trinitrat l├Ā chß║źt dß╗ģ ch├Īy v├Ā nß╗Ģ mß║Īnh kh├┤ng sinh ra kh├│i n├¬n ─æŲ░ß╗Żc d├╣ng l├Ām thuß╗æc s├║ng kh├┤ng kh├│i. T├Łnh thß╗ā t├Łch cß╗¦a dung dß╗ŗch axit nitric 63% (D = 1,52 g/ml) cß║¦n vß╗½a ─æß╗¦ ─æß╗ā sß║Żn xuß║źt ─æŲ░ß╗Żc 59,4 kg xenlulozŲĪ trinitrat (hiß╗ću suß║źt 80%).
C├óu 3 (4,5 ─æiß╗ām)
1. H├Ży giß║Żi th├Łch:
a) Dß║¦u mß╗Ī ─æß╗ā l├óu thŲ░ß╗Øng c├│ m├╣i kh├│ chß╗ŗu (h├┤i, kh├®t) m├Ā ta gß╗Źi l├Ā hiß╗ćn tŲ░ß╗Żng mß╗Ī bß╗ŗ ├┤i.
b) Khi khß╗Ł m├╣i tanh cß╗¦a c├Ī ngŲ░ß╗Øi ta thŲ░ß╗Øng d├╣ng c├Īc chß║źt c├│ vß╗ŗ chua.
c) Trong qu├Ī tr├¼nh sß║Żn xuß║źt giß║źm ─ān, ngŲ░ß╗Øi ta thŲ░ß╗Øng d├╣ng nhß╗»ng th├╣ng c├│ miß╗ćng rß╗Öng, ─æ├Īy n├┤ng v├Ā phß║Żi mß╗¤ nß║»p.
d) Khi nhai k─® cŲĪm sß║Į c├│ vß╗ŗ ngß╗Źt.
2. Viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc ─æiß╗üu chß║┐ c├Īc chß║źt sau, ghi r├Ą ─æiß╗üu kiß╗ćn phß║Żn ß╗®ng (nß║┐u c├│):
a) Trong ph├▓ng th├Ł nghiß╗ćm: H3PO4, CO.
b) Trong c├┤ng nghiß╗ćp: ur├¬, supephotphat ─æŲĪn.
3. Dß║½n 0,55 mol hß╗Śn hß╗Żp X (gß╗ōm hŲĪi nŲ░ß╗øc v├Ā kh├Ł CO2) qua cacbon nung ─æß╗Å thu ─æŲ░ß╗Żc 0,95 mol hß╗Śn hß╗Żp Y gß╗ōm CO, H2 v├Ā CO2. Cho Y hß║źp thß╗ź v├Āo dung dß╗ŗch chß╗®a 0,1 mol Ba(OH)2, sau khi phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān thu ─æŲ░ß╗Żc m gam kß║┐t tß╗¦a. T├Łnh gi├Ī trß╗ŗ cß╗¦a m.
4. Hß╗Śn hß╗Żp X gß╗ōm Mg, Al, Al(NO3)3 v├Ā MgCO3 (trong ─æ├│ oxi chiß║┐m 41,618% vß╗ü khß╗æi lŲ░ß╗Żng). H├▓a tan hß║┐t 20,76 gam X trong dung dß╗ŗch chß╗®a 0,48 mol H2SO4 v├Ā x mol HNO3, kß║┐t th├║c phß║Żn ß╗®ng thu ─æŲ░ß╗Żc dung dß╗ŗch Y chß╗ē chß╗®a c├Īc muß╗æi trung h├▓a c├│ khß╗æi lŲ░ß╗Żng 56,28 gam v├Ā 4,48 l├Łt (─æktc) hß╗Śn hß╗Żp kh├Ł Z gß╗ōm CO2, N2, H2. Cho dung dß╗ŗch NaOH dŲ░ v├Āo Y, thu ─æŲ░ß╗Żc 13,34 gam kß║┐t tß╗¦a. T├Łnh gi├Ī trß╗ŗ cß╗¦a x.
C├óu 4 (4,0 ─æiß╗ām)
1. Cho hß╗Śn hß╗Żp X gß╗ōm glyxin v├Ā alanin tham gia phß║Żn ß╗®ng ß╗¤ ─æiß╗üu kiß╗ćn th├Łch hß╗Żp thu ─æŲ░ß╗Żc c├Īc sß║Żn phß║®m ─æipeptit. Viß║┐t c├Īc phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng v├Ā gß╗Źi t├¬n sß║Żn phß║®m tß║Īo th├Ānh.
2. Thß╗¦y ph├ón ho├Ān to├Ān a mol triglixerit X trong dung dß╗ŗch NaOH vß╗½a ─æß╗¦, thu ─æŲ░ß╗Żc glixerol v├Ā m gam hß╗Śn hß╗Żp muß╗æi. ─Éß╗æt ch├Īy ho├Ān to├Ān a mol X thu ─æŲ░ß╗Żc 1,375 mol CO2 v├Ā 1,275 mol H2O. Mß║Ęt kh├Īc, a mol X t├Īc dß╗źng tß╗æi ─æa vß╗øi 0,05 mol Br2 trong dung dß╗ŗch. T├Łnh gi├Ī trß╗ŗ cß╗¦a m.
3. Hß╗Śn hß╗Żp E gß╗ōm bß╗æn este ─æß╗üu c├│ c├┤ng thß╗®c C8H8O2 v├Ā c├│ v├▓ng benzen. Cho 16,32 gam E t├Īc dß╗źng tß╗æi ─æa vß╗øi V ml dung dß╗ŗch NaOH 1M (─æun n├│ng), thu ─æŲ░ß╗Żc 3,88 gam hß╗Śn hß╗Żp ancol v├Ā 18,78 gam hß╗Śn hß╗Żp muß╗æi. T├Łnh gi├Ī trß╗ŗ cß╗¦a V.
4. Chß║źt X (C5H14O2N2) l├Ā muß╗æi amoni cß╗¦a mß╗Öt ╬▒-amino axit; chß║źt Y (C7H16O4N4, mß║Īch hß╗¤) l├Ā muß╗æi amoni cß╗¦a tripeptit. Cho m gam hß╗Śn hß╗Żp E gß╗ōm X v├Ā Y t├Īc dß╗źng hß║┐t vß╗øi lŲ░ß╗Żng dŲ░ NaOH thu ─æŲ░ß╗Żc sß║Żn phß║®m hß╗»u cŲĪ gß╗ōm hai amin no l├Ā ─æß╗ōng ─æß║│ng kß║┐ tiß║┐p c├│ tß╗ē khß╗æi so vß╗øi H2 bß║▒ng 18,125 v├Ā 53,64 gam hß╗Śn hß╗Żp hai muß╗æi. T├Łnh gi├Ī trß╗ŗ cß╗¦a m.
C├óu 5 (3,5 ─æiß╗ām)
1. C├Īc chß║źt hß╗»u cŲĪ A, B, C, D c├│ c├╣ng c├┤ng thß╗®c ph├ón tß╗Ł C4H6O4 ─æß╗üu phß║Żn ß╗®ng vß╗øi dung dß╗ŗch NaOH theo tß╗ē lß╗ć mol 1 : 2. Trong ─æ├│: A, B ─æß╗üu tß║Īo ra mß╗Öt muß╗æi, mß╗Öt ancol; C, D ─æß╗üu tß║Īo ra mß╗Öt muß╗æi, mß╗Öt ancol v├Ā nŲ░ß╗øc. Biß║┐t rß║▒ng khi ─æß╗æt ch├Īy muß╗æi do A, C tß║Īo ra th├¼ trong sß║Żn phß║®m ch├Īy kh├┤ng c├│ nŲ░ß╗øc. X├Īc ─æß╗ŗnh A, B, C, D v├Ā viß║┐t phŲ░ŲĪng tr├¼nh phß║Żn ß╗®ng vß╗øi dung dß╗ŗch NaOH.
2. Chia 14,2 gam hß╗Śn hß╗Żp X gß╗ōm hai an─æehit ─æŲĪn chß╗®c th├Ānh hai phß║¦n bß║▒ng nhau. ─Éß╗æt ch├Īy ho├Ān to├Ān phß║¦n 1 thu ─æŲ░ß╗Żc 15,4 gam CO2 v├Ā 4,5 gam H2O. Cho phß║¦n 2 t├Īc dß╗źng vß╗øi lŲ░ß╗Żng dŲ░ dung dß╗ŗch AgNO3 trong NH3 thu ─æŲ░ß╗Żc 43,2 gam bß║Īc. X├Īc ─æß╗ŗnh c├┤ng thß╗®c cß║źu tß║Īo cß╗¦a hai an─æehit tr├¬n.
3. ─Éß╗æt ch├Īy ho├Ān to├Ān 6,46 gam hß╗Śn hß╗Żp E gß╗ōm ba este no, mß║Īch hß╗¤ X, Y, Z (─æß╗üu tß║Īo bß╗¤i axit cacboxylic v├Ā ancol; MX < MY < MZ) cß║¦n vß╗½a ─æß╗¦ 0,235 mol O2, thu ─æŲ░ß╗Żc 5,376 l├Łt kh├Ł CO2. Cho 6,46 gam E t├Īc dß╗źng hß║┐t vß╗øi dung dß╗ŗch NaOH (lß║źy dŲ░ 20% so vß╗øi lŲ░ß╗Żng phß║Żn ß╗®ng) rß╗ōi chŲ░ng cß║źt dung dß╗ŗch. thu ─æŲ░ß╗Żc hß╗Śn hß╗Żp hai ancol ─æŲĪn chß╗®c l├Ā ─æß╗ōng ─æß║│ng kß║┐ tiß║┐p v├Ā hß╗Śn hß╗Żp chß║źt rß║»n khan T. ─Éß╗æt ch├Īy ho├Ān to├Ān T, thu ─æŲ░ß╗Żc Na2CO3, CO2 v├Ā 0,18 gam H2O. X├Īc ─æß╗ŗnh c├┤ng thß╗®c cß║źu tß║Īo cß╗¦a X, Y, Z.
---(─Éß╗ā xem nß╗Öi dung ─æß║¦y ─æß╗¦, chi tiß║┐t ─æ├Īp ├Īn ─æß╗ü thi sß╗æ 4 vui l├▓ng xem Online hoß║Ęc ─É─āng nhß║Łp v├Āo HOC247 ─æß╗ā tß║Żi vß╗ü m├Īy)---
─Éß╗Ć THI Sß╗É 5
─Éß╗Ć THI HSG M├öN H├ōA Hß╗īC 12 N─éM 2021-2022 Sß╗× GD&─ÉT NAM ─Éß╗ŖNH ─Éß╗Ć Sß╗É 5
C├óu I (3,0 ─æiß╗ām)
1. Giß║Żi th├Łch v├¼ sao ngŲ░ß╗Øi ta c├│ thß╗ā d├╣ng bß║Īc ─æß╗ā ŌĆ£─æ├Īnh gi├│ŌĆØ khi bß╗ŗ tr├║ng gi├│? Sau khi ŌĆ£─æ├Īnh gi├│ŌĆØ bß║Īc thŲ░ß╗Øng chuyß╗ān m├Āu x├Īm ─æen, h├Ży ─æß╗ü xuß║źt mß╗Öt c├Īch ─æŲĪn giß║Żn ─æß╗ā l├Ām bß║Īc s├Īng trß║»ng trß╗¤ lß║Īi.
2. Hß╗Żp chß║źt X ─æŲ░ß╗Żc tß║Īo th├Ānh tß╗½ hai nguy├¬n tß╗æ c├│ c├┤ng thß╗®c l├Ā A2B. Tß╗Ģng sß╗æ hß║Īt proton trong mß╗Öt ph├ón tß╗Ł X l├Ā 18. ß╗× ─æiß╗üu kiß╗ćn th├Łch hß╗Żp, X tham gia v├Āo mß╗Öt sß╗æ phß║Żn ß╗®ng h├│a hß╗Źc theo sŲĪ ─æß╗ō sau:
(1) X + O2 ŌåÆ Y + H2O
(2) X + Y ŌåÆ Z + H2O
(3) X + Cl2 + H2O ŌåÆ T + M
(4) X + FeCl3 ŌåÆ Z + M + Q
X├Īc ─æß╗ŗnh c├Īc chß║źt X, Y, Z, T, M, Q v├Ā viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc xß║Ży ra.
3. Tiß║┐n h├Ānh th├Ł nghiß╗ćm ─æiß╗üu chß║┐ etyl axetat nhŲ░ sau: cho v├Āo ß╗æng nghiß╗ćm 1 ml ancol X, 1 ml axit cacboxylic Y nguy├¬n chß║źt v├Ā 1 giß╗Źt axit Z ─æß║Łm ─æß║Ęc. Lß║»c ─æß╗üu, sau ─æ├│ ─æun nhß║╣ tr├¬n ngß╗Źn lß╗Ła ─æ├©n cß╗ōn (kh├┤ng ─æŲ░ß╗Żc ─æun s├┤i). L├Ām lß║Īnh rß╗ōi r├│t th├¬m v├Āo ß╗æng nghiß╗ćm 2 ml dung dß╗ŗch NaCl b├Żo h├▓a.
a) X├Īc ─æß╗ŗnh c├Īc chß║źt X, Y, Z v├Ā viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a phß║Żn ß╗®ng ─æiß╗üu chß║┐ etyl axetat.
b) Cho biß║┐t vai tr├▓ cß╗¦a axit Z v├Ā dung dß╗ŗch NaCl b├Żo h├▓a.
c) Tß║Īi sao kh├┤ng ─æŲ░ß╗Żc ─æun s├┤i hß╗Śn hß╗Żp trong ß╗æng nghiß╗ćm?
C├óu II (3,5 ─æiß╗ām)
1. Chß╗ē d├╣ng th├¬m phenolphtalein, ─æiß╗üu kiß╗ćn v├Ā dß╗źng cß╗ź th├Ł nghiß╗ćm c├│ ─æß╗¦, tr├¼nh b├Āy c├Īch ph├ón biß╗ćt c├Īc dung dß╗ŗch ri├¬ng biß╗ćt (c├│ c├╣ng nß╗ōng ─æß╗Ö 0,01M): HCl, H2SO4, NaOH, NaCl, BaCl2.
2. X├Īc ─æß╗ŗnh c├Īc chß║źt hß╗»u cŲĪ X, Y, Z, T, M, N, K (c├│ hai chß║źt l├Ā hi─ærocacbon) v├Ā viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc thß╗▒c hiß╗ćn d├Ży chuyß╗ān h├│a sau (ghi r├Ą ─æiß╗üu kiß╗ćn nß║┐u c├│):
3. Cho c├Īc h├│a chß║źt v├Ā dß╗źng cß╗ź sau: bŲĪm chß╗®a kh├Ł CO2, dung dß╗ŗch NaOH lo├Żng, hai cß╗æc thß╗¦y tinh giß╗æng nhau c├│ chia vß║Īch thß╗ā t├Łch, ─æ┼®a thß╗¦y tinh. Tr├¼nh b├Āy c├Īch ─æiß╗üu chß║┐ dung dß╗ŗch Na2CO3 tinh khiß║┐t.
C├óu III (3,0 ─æiß╗ām)
1. Ho├Ān th├Ānh sŲĪ ─æß╗ō phß║Żn ß╗®ng, c├ón bß║▒ng phŲ░ŲĪng tr├¼nh h├│a hß╗Źc bß║▒ng phŲ░ŲĪng ph├Īp th─āng bß║▒ng electron, x├Īc ─æß╗ŗnh chß║źt khß╗Ł v├Ā chß║źt oxi h├│a trong c├Īc trŲ░ß╗Øng hß╗Żp sau:
a) NO2 + NaOH ... ŌåÆ + ... + ...
b) FeS2 + O2 (dŲ░) ŌåÆ ŌĆ” + ŌĆ”
c) K2SO3 + KMnO4 + NaHSO4 ŌåÆ ... + ... + ... + ...
2. Cho X, Y, Z, T l├Ā c├Īc muß╗æi v├┤ cŲĪ chß╗®a natri (X kh├┤ng c├│ t├Łnh lŲ░ß╗Īng t├Łnh). Thß╗▒c hiß╗ćn c├Īc th├Ł nghiß╗ćm sau:
- Cho tß╗½ tß╗½ ─æß║┐n dŲ░ dd chß╗®a chß║źt Y v├Āo dung dß╗ŗch chß╗®a a mol chß║źt X thu ─æŲ░ß╗Żc V1 l├Łt kh├Ł m├╣i trß╗®ng thß╗æi;
- Cho tß╗½ tß╗½ ─æß║┐n dŲ░ dd chß╗®a chß║źt Z v├Āo dung dß╗ŗch chß╗®a a mol chß║źt X thu ─æŲ░ß╗Żc V2 l├Łt kh├Ł m├╣i trß╗®ng thß╗æi;
- Cho tß╗½ tß╗½ ─æß║┐n dŲ░ dung dß╗ŗch chß╗®a chß║źt T v├Āo dung dß╗ŗch chß╗®a a mol chß║źt X thu ─æŲ░ß╗Żc V3 l├Łt kh├Ł kh├┤ng m├Āu, kh├┤ng m├╣i.
Biß║┐t V1 > V2, c├Īc phß║Żn ß╗®ng xß║Ży ra ho├Ān to├Ān, thß╗ā t├Łch kh├Ł ─æŲ░ß╗Żc ─æo ß╗¤ c├╣ng ─æiß╗üu kiß╗ćn. Giß║Ż thiß║┐t c├Īc kh├Ł kh├┤ng tan trong dung dß╗ŗch.
a) X├Īc ─æß╗ŗnh c├Īc chß║źt X, Y, Z, T v├Ā viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc cß╗¦a phß║Żn ß╗®ng xß║Ży ra.
b) So s├Īnh V3 vß╗øi V1 v├Ā V2.
C├óu IV (3,5 ─æiß╗ām)
1. Trong c├┤ng nghiß╗ćp, amoniac ─æŲ░ß╗Żc tß╗Ģng hß╗Żp tß╗½ kh├Ł nitŲĪ v├Ā kh├Ł hi─æro. Viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc (ghi r├Ą ─æiß╗üu kiß╗ćn nß║┐u c├│) v├Ā tr├¼nh b├Āy c├Īch t├Īch amoniac ra khß╗Åi hß╗Śn hß╗Żp sau phß║Żn ß╗®ng.
2. Cho X, Y, Z, T, Q l├Ā k├Ł hiß╗ću cß╗¦a c├Īc chß║źt: C3H8, HCOOH, CH3COOH, C2H5OH v├Ā C2H5NH2 (kh├┤ng theo thß╗® tß╗▒). Nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a c├Īc chß║źt ─æŲ░ß╗Żc ghi trong bß║Żng sau:
|
Chß║źt |
X |
Y |
Z |
T |
Q |
|
Nhiß╗ćt ─æß╗Ö s├┤i (0C) |
+118,0 |
+100,5 |
+78,3 |
+16,5 |
-42,0 |
X├Īc ─æß╗ŗnh c├Īc chß║źt X, Y, Z, T, Q v├Ā giß║Żi th├Łch.
3. Cho hai hi─ærocacbon X v├Ā Y l├Ā ─æß╗ōng ph├ón cß╗¦a nhau. L├Ām bay hŲĪi hß║┐t 2,53 gam hß╗Śn hß╗Żp X v├Ā Y thu ─æŲ░ß╗Żc thß╗ā t├Łch hŲĪi ─æ├║ng bß║▒ng thß╗ā t├Łch cß╗¦a 0,88 gam kh├Ł oxi ─æo ß╗¤ c├╣ng ─æiß╗üu kiß╗ćn.
a) X├Īc ─æß╗ŗnh c├┤ng thß╗®c ph├ón tß╗Ł cß╗¦a X, Y.
b) Chß║źt X kh├┤ng phß║Żn ß╗®ng vß╗øi vß╗øi dung dß╗ŗch KMnO4 ß╗¤ nhiß╗ćt ─æß╗Ö thŲ░ß╗Øng nhŲ░ng l├Ām nhß║Īt m├Āu dung dß╗ŗch n├Āy khi ─æun n├│ng. Nß║┐u cho 11,5 gam chß║źt Y phß║Żn ß╗®ng ho├Ān to├Ān vß╗øi lŲ░ß╗Żng dŲ░ dung dß╗ŗch AgNO3 trong NH3 thu ─æŲ░ß╗Żc 38,25 gam kß║┐t tß╗¦a. Hi─æro h├│a Y thu ─æŲ░ß╗Żc ankan Z, chß║źt Z phß║Żn ß╗®ng vß╗øi kh├Ł Cl2 c├│ chiß║┐u s├Īng tß║Īo th├Ānh 4 dß║½n xuß║źt monoclo. X├Īc ─æß╗ŗnh c├┤ng thß╗®c cß║źu tß║Īo, gß╗Źi t├¬n c├Īc chß║źt X, Y, Z v├Ā viß║┐t phŲ░ŲĪng tr├¼nh h├│a hß╗Źc xß║Ży ra.
C├óu V (3,5 ─æiß╗ām)
1. Cho 5,08 gam hß╗Śn hß╗Żp X gß╗ōm hai muß╗æi M2CO3 v├Ā MHCO3 t├Īc dß╗źng vß╗øi dung dß╗ŗch HCl dŲ░. Hß║źp thß╗ź to├Ān bß╗Ö kh├Ł CO2 sinh ra v├Āo dung dß╗ŗch chß╗®a 0,04 mol Ca(OH)2 v├Ā 0,01 mol NaOH thu ─æŲ░ß╗Żc kß║┐t tß╗¦a v├Ā dung dß╗ŗch chß╗ē chß╗®a 2,46 gam muß╗æi. X├Īc ─æß╗ŗnh c├┤ng thß╗®c v├Ā t├Łnh phß║¦n tr─ām khß╗æi lŲ░ß╗Żng mß╗Śi chß║źt trong X.
2. Hß╗Śn hß╗Żp X gß╗ōm ba este thuß║¦n chß╗®c, mß║Īch hß╗¤ ─æß╗üu ─æŲ░ß╗Żc tß║Īo th├Ānh tß╗½ axit cacboxylic v├Ā ancol, ph├ón tß╗Ł khß╗æi cß╗¦a c├Īc chß║źt trong X ─æß╗üu nhß╗Å hŲĪn 150. ─Éß╗æt ch├Īy ho├Ān to├Ān 0,042 mol X thu ─æŲ░ß╗Żc 0,184 mol CO2. Mß║Ęt kh├Īc, 0,042 mol X t├Īc dß╗źng vß╗½a ─æß╗¦ vß╗øi 360 ml dung dß╗ŗch NaOH 0,2M thu ─æŲ░ß╗Żc hai muß╗æi v├Ā hai ancol. ─Éß╗æt ch├Īy ho├Ān to├Ān 1,138 gam hß╗Śn hß╗Żp hai ancol ß╗¤ tr├¬n thu ─æŲ░ß╗Żc 1,584 gam CO2 v├Ā 1,17 gam H2O. X├Īc ─æß╗ŗnh c├┤ng thß╗®c v├Ā t├Łnh phß║¦n tr─ām khß╗æi lŲ░ß╗Żng mß╗Śi chß║źt trong X.
---(─Éß╗ā xem nß╗Öi dung ─æß║¦y ─æß╗¦, chi tiß║┐t ─æ├Īp ├Īn ─æß╗ü thi sß╗æ 5 vui l├▓ng xem Online hoß║Ęc ─É─āng nhß║Łp v├Āo HOC247 ─æß╗ā tß║Żi vß╗ü m├Īy)---
Tr├¬n ─æ├óy l├Ā tr├Łch ─æoß║Īn nß╗Öi dung t├Āi liß╗ću Bß╗Ö 5 ─æß╗ü thi HSG m├┤n H├│a hß╗Źc 12 n─ām 2021-2022 c├│ ─æ├Īp ├Īn Sß╗¤ GD&─ÉT Nam ─Éß╗ŗnh. ─Éß╗ā xem th├¬m nhiß╗üu t├Āi liß╗ću tham khß║Żo hß╗»u ├Łch kh├Īc c├Īc em chß╗Źn chß╗®c n─āng xem online hoß║Ęc ─æ─āng nhß║Łp v├Āo trang hoc247.net ─æß╗ā tß║Żi t├Āi liß╗ću vß╗ü m├Īy t├Łnh.
Mß╗Øi c├Īc em theo d├Ąi t├Āi liß╗ću c├│ li├¬n quan:
Hy vß╗Źng t├Āi liß╗ću n├Āy sß║Į gi├║p c├Īc em hß╗Źc sinh ├┤n tß║Łp tß╗æt v├Ā ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp.
T├Āi liß╗ću li├¬n quan
TŲ░ liß╗ću nß╗Ģi bß║Łt tuß║¦n
- Xem thêm













