HŲ░ß╗øng dß║½n Giß║Żi b├Āi tß║Łp Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo Chß╗¦ ─æß╗ü 2 B├Āi 6 Giß╗øi thiß╗ću vß╗ü li├¬n kß║┐t h├│a hß╗Źc sß║Į gi├║p c├Īc em hß╗Źc sinh nß║»m vß╗»ng phŲ░ŲĪng ph├Īp giß║Żi b├Āi tß║Łp v├Ā ├┤n luyß╗ćn tß╗æt kiß║┐n thß╗®c.
-
Mß╗¤ ─æß║¦u trang 37 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
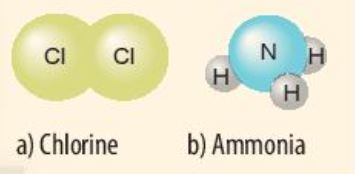
ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng, c├Īc nguy├¬n tß╗Ł kh├Ł hiß║┐m thŲ░ß╗Øng trŲĪ, bß╗ün v├Ā chß╗ē tß╗ōn tß║Īi ─æß╗Öc lß║Łp, trong khi c├Īc nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ kh├Īc lß║Īi c├│ xu hŲ░ß╗øng kß║┐t hß╗Żp vß╗øi nhau. C├Īc nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ kß║┐t hß╗Żp vß╗øi nhau theo quy tß║»c n├Āo?
-
Thß║Żo luß║Łn 1 trang 37 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
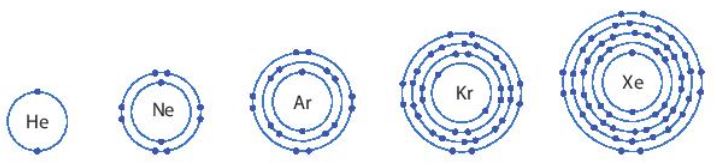
Trß╗½ helium, vß╗Å nguy├¬n tß╗Ł cß╗¦a c├Īc nguy├¬n tß╗æ c├▓n lß║Īi ß╗¤ H├¼nh 6.1 c├│ nhß╗»ng ─æiß╗ām giß╗æng v├Ā kh├Īc nhau g├¼?
H├¼nh 6.1. H├¼nh m├┤ phß╗Ång vß╗Å nguy├¬n tß╗Ł cß╗¦a mß╗Öt sß╗æ nguy├¬n tß╗æ kh├Ł hiß║┐m
-
Thß║Żo luß║Łn 2 trang 38 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
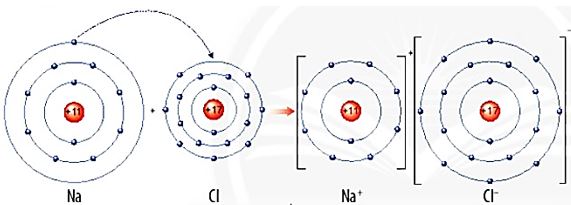
Quan s├Īt H├¼nh 6.2, em h├Ży m├┤ tß║Ż sß╗▒ tß║Īo th├Ānh ion sodium, ion magnesium. Nhß║Łn x├®t vß╗ü sß╗æ electron lß╗øp ngo├Āi c├╣ng cß╗¦a c├Īc ion n├Āy v├Ā cho biß║┐t sß╗▒ ph├ón bß╗æ electron cß╗¦a 2 ion n├Āy giß╗æng sß╗▒ ph├ón bß╗æ electron cß╗¦a nguy├¬n tß╗Ł kh├Ł hiß║┐m n├Āo?
H├¼nh 6.2. SŲĪ ─æß╗ō tß║Īo th├Ānh ion dŲ░ŲĪng cß╗¦a sodium (a) v├Ā magnesium (b)
-
Thß║Żo luß║Łn 3 trang 38 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
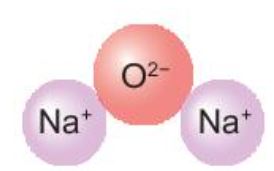
Quan s├Īt H├¼nh 6.3, em h├Ży m├┤ tß║Ż sß╗▒ tß║Īo th├Ānh ion chloride, ion oxide. Nhß║Łn x├®t vß╗ü sß╗æ electron lß╗øp ngo├Āi c├╣ng cß╗¦a c├Īc ion n├Āy v├Ā cho biß║┐t sß╗▒ ph├ón bß╗æ electron cß╗¦a 2 ion n├Āy giß╗æng sß╗▒ ph├ón bß╗æ electron cß╗¦a nguy├¬n tß╗Ł kh├Ł hiß║┐m n├Āo?
H├¼nh 6.3. SŲĪ ─æß╗ō tß║Īo th├Ānh ion ├óm cß╗¦a chlorine (a) v├Ā oxygen (b)
-
Thß║Żo luß║Łn 4 trang 39 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Quan s├Īt H├¼nh 6.4a, em h├Ży m├┤ tß║Ż qu├Ī tr├¼nh tß║Īo th├Ānh li├¬n kß║┐t ion trong ph├ón tß╗Ł sodium chloride. N├¬u mß╗Öt sß╗æ ß╗®ng dß╗źng cß╗¦a sodium chloride trong ─æß╗Øi sß╗æng.
H├¼nh 6.4. a) SŲĪ ─æß╗ō tß║Īo th├Ānh li├¬n kß║┐t ion trong ph├ón tß╗Ł sodium chloride.
-
Thß║Żo luß║Łn 5 trang 40 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Dß╗▒a v├Āo bß║Żng tuß║¦n ho├Ān, h├Ży chß╗ē ra nguy├¬n tß╗æ kh├Ł hiß║┐m gß║¦n nhß║źt cß╗¦a hydrogen v├Ā oxygen. ─Éß╗ā c├│ lß╗øp electron ngo├Āi c├╣ng giß╗æng nguy├¬n tß╗æ kh├Ł hiß║┐m gß║¦n nhß║źt, nguy├¬n tß╗Ł hydrogen v├Ā oxygen c├│ xu hŲ░ß╗øng g├¼?
-
Thß║Żo luß║Łn 6 trang 40 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
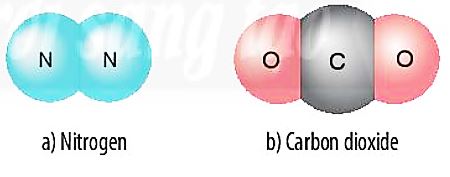
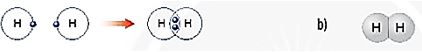
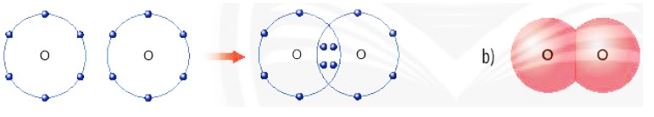
Dß╗▒a v├Āo c├Īc H├¼nh 6.5, 6.6 v├Ā 6.7, em h├Ży cho biß║┐t sß╗æ electron lß╗øp ngo├Āi c├╣ng cß╗¦a mß╗Śi nguy├¬n tß╗Ł trong ph├ón tß╗Ł hydrogen v├Ā oxygen l├Ā bao nhi├¬u? Khi ─æ├│, lß╗øp electron ngo├Āi c├╣ng cß╗¦a nguy├¬n tß╗Ł hydrogen v├Ā nguy├¬n tß╗Ł oxygen sß║Į giß╗æng vß╗øi kh├Ł hiß║┐m n├Āo?
H├¼nh 6.5. Lß╗øp electron ngo├Āi c├╣ng cß╗¦a nguy├¬n tß╗Ł hydrogen (a), helium (b), oxygen (c), neon (d)
H├¼nh 6.6. a) SŲĪ ─æß╗ō tß║Īo th├Ānh li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ trong ph├ón tß╗Ł hydrogen
b) H├¼nh m├┤ phß╗Ång ph├ón tß╗Ł hydrogen
H├¼nh 6.7. a) SŲĪ ─æß╗ō tß║Īo th├Ānh li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ trong ph├ón tß╗Ł oxygen
b) H├¼nh m├┤ phß╗Ång ph├ón tß╗Ł oxygen
-
Thß║Żo luß║Łn 7 trang 40 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Em h├Ży m├┤ tß║Ż qu├Ī tr├¼nh tß║Īo th├Ānh li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ trong ph├ón tß╗Ł hydrogen v├Ā oxygen
-
Thß║Żo luß║Łn 8 trang 41 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
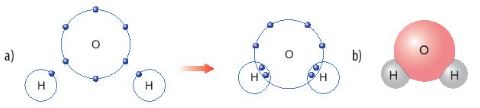
Quan s├Īt H├¼nh 6.8, em h├Ży cho biß║┐t sß╗æ electron d├╣ng chung cß╗¦a nguy├¬n tß╗Ł H v├Ā nguy├¬n tß╗Ł O. Trong ph├ón tß╗Ł nŲ░ß╗øc, sß╗æ electron ß╗¤ lß╗øp ngo├Āi c├╣ng cß╗¦a O v├Ā H l├Ā bao nhi├¬u v├Ā giß╗æng vß╗øi kh├Ł hiß║┐m n├Āo?
H├¼nh 6.8. a) SŲĪ ─æß╗ō tß║Īo th├Ānh li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ trong ph├ón tß╗Ł nŲ░ß╗øc
b) H├¼nh m├┤ phß╗Ång ph├ón tß╗Ł nŲ░ß╗øc
-
Thß║Żo luß║Łn 9 trang 41 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Em h├Ży m├┤ tß║Ż qu├Ī tr├¼nh tß║Īo th├Ānh li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ trong ph├ón tß╗Ł nŲ░ß╗øc.
-
Thß║Żo luß║Łn 10 trang 41 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Cho biß║┐t mß╗Śi ph├ón tß╗Ł cß╗¦a chß║źt trong H├¼nh 6.9 ─æŲ░ß╗Żc tß║Īo bß╗¤i c├Īc ion n├Āo? ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng, c├Īc chß║źt n├Āy ß╗¤ thß╗ā g├¼?
H├¼nh 6.9. Mß╗Öt sß╗æ hß╗Żp chß║źt ion
-
Thß║Żo luß║Łn 11 trang 42 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Quan s├Īt v├Ā cho biß║┐t thß╗ā cß╗¦a c├Īc chß║źt c├│ trong H├¼nh 6.10.
-
Thß║Żo luß║Łn 12 trang 42 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
N├¬u mß╗Öt sß╗æ v├Ł dß╗ź vß╗ü chß║źt cß╗Öng h├│a trß╗ŗ v├Ā cho biß║┐t thß╗ā cß╗¦a ch├║ng ß╗¤ ─æiß╗üu kiß╗ćn thŲ░ß╗Øng.
-
Thß║Żo luß║Łn 13 trang 42 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
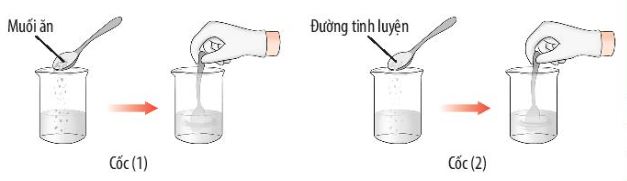
Quan s├Īt th├Ł nghiß╗ćm 1 (H├¼nh 6.11, 6.12) v├Ā ─æ├Īnh dß║źu Ō£ö ─æß╗ā ho├Ān th├Ānh bß║Żng sau:
T├Łnh chß║źt
Muối
─ÉŲ░ß╗Øng
Tan trong nŲ░ß╗øc
?
?
Dß║½n ─æiß╗ćn ─æŲ░ß╗Żc
?
?
H├¼nh 6.11. Th├Ł nghiß╗ćm h├▓a tan muß╗æi ─ān v├Ā ─æŲ░ß╗Øng v├Āo nŲ░ß╗øc
H├¼nh 6.12. Th├Ł nghiß╗ćm vß╗ü t├Łnh dß║½n ─æiß╗ćn cß╗¦a dung dß╗ŗch muß╗æi v├Ā dung dß╗ŗch ─æŲ░ß╗Øng
-
Thß║Żo luß║Łn 14 trang 43 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
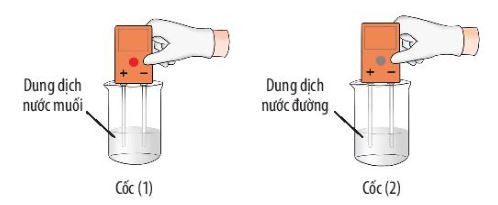
Quan s├Īt th├Ł nghiß╗ćm 2 (H├¼nh 6.13), cho biß║┐t muß╗æi hay ─æŲ░ß╗Øng bß╗ün nhiß╗ćt hŲĪn. ß╗× ß╗æng nghiß╗ćm n├Āo c├│ sß╗▒ tß║Īo th├Ānh chß║źt mß╗øi?
H├¼nh 6.13. Th├Ł nghiß╗ćm so s├Īnh khß║Ż n─āng bß╗ün nhiß╗ćt cß╗¦a muß╗æi v├Ā ─æŲ░ß╗Øng
-
Luyß╗ćn tß║Łp trang 38 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
H├Ży x├Īc ─æß╗ŗnh vß╗ŗ tr├Ł cß╗¦a aluminium trong bß║Żng tuß║¦n ho├Ān v├Ā vß║Į sŲĪ ─æß╗ō tß║Īo th├Ānh ion aluminium tß╗½ nguy├¬n tß╗Ł aluminium.
-
Luyß╗ćn tß║Łp trang 39 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
X├Īc ─æß╗ŗnh vß╗ŗ tr├Ł cß╗¦a sulfur trong bß║Żng tuß║¦n ho├Ān v├Ā vß║Į sŲĪ ─æß╗ō tß║Īo th├Ānh ion sulfide (S2-) tß╗½ nguy├¬n tß╗Ł sulfur.
-
Luyß╗ćn tß║Łp trang 39 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
H├Ży vß║Į sŲĪ ─æß╗ō v├Ā m├┤ tß║Ż qu├Ī tr├¼nh tß║Īo th├Ānh li├¬n kß║┐t ion trong ph├ón tß╗Ł hß╗Żp chß║źt magnesium oxide.
-
Luyß╗ćn tß║Łp trang 41 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Vß║Į sŲĪ ─æß╗ō h├¼nh th├Ānh li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ trong c├Īc ph├ón tß╗Ł sau.
-
Luyß╗ćn tß║Łp trang 42 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Kh├│i cß╗¦a n├║i lß╗Ła ngß║¦m phun tr├Āo tß╗½ dŲ░ß╗øi biß╗ān c├│ chß╗®a mß╗Öt sß╗æ chß║źt nhŲ░: hŲĪi nŲ░ß╗øc, sodium chloride, potassium chloride, carbon dioxide, sulfur dioxide.
a) H├Ży cho biß║┐t chß║źt n├Āo l├Ā hß╗Żp chß║źt ion, chß║źt n├Āo l├Ā hß╗Żp chß║źt cß╗Öng h├│a trß╗ŗ
b) Nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ n├Āo trong c├Īc chß║źt tr├¬n c├│ sß╗æ electron ß╗¤ lß╗øp ngo├Āi c├╣ng nhiß╗üu nhß║źt
-
Luyß╗ćn tß║Łp trang 44 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Kß║┐t quß║Ż thß╗Ł nghiß╗ćm t├Łnh chß║źt cß╗¦a 2 chß║źt A v├Ā B ─æŲ░ß╗Żc tr├¼nh b├Āy ß╗¤ bß║Żng b├¬n. Em h├Ży cho biß║┐t chß║źt n├Āo l├Ā chß║źt cß╗Öng h├│a trß╗ŗ, chß║źt n├Āo l├Ā chß║źt ion?
T├Łnh chß║źt
Chß║źt A
Chß║źt B
Thß╗ā (25oC)
Rắn
Lỏng
Nhiß╗ćt ─æß╗Ö s├┤i (oC)
1500
64,7
Nhiß╗ćt ─æß╗Ö n├│ng chß║Ży (oC)
770
-97,6
Khß║Ż n─āng dß║½n ─æiß╗ćn cß╗¦a dung dß╗ŗch
C├│
Kh├┤ng
-
Vß║Łn dß╗źng trang 39 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Calcium chloride c├│ nhiß╗üu ß╗®ng dß╗źng trong ─æß╗Øi sß╗æng. T├¼m hiß╗āu qua s├Īch b├Īo v├Ā internet, em h├Ży cho biß║┐t mß╗Öt sß╗æ ß╗®ng dß╗źng cß╗¦a chß║źt n├Āy. Vß║Į sŲĪ ─æß╗ō tß║Īo th├Ānh li├¬n kß║┐t trong ph├ón tß╗Ł calcium chloride.
-
Vß║Łn dß╗źng trang 41 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Kh├Ł methane l├Ā th├Ānh phß║¦n ch├Łnh cß╗¦a kh├Ł thi├¬n nhi├¬n v├Ā kh├Ł mß╗Å dß║¦u. Kh├Ł n├Āy c├▓n ─æŲ░ß╗Żc tß║Īo ra tß╗½ hß║¦m biogas. Methane l├Ā nguß╗ōn nhi├¬n liß╗ću quan trß╗Źng trong ─æß╗Øi sß╗æng v├Ā c├│ nhiß╗üu ß╗®ng dß╗źng trong c├┤ng nghiß╗ćp. Em h├Ży vß║Į sŲĪ ─æß╗ō h├¼nh th├Ānh li├¬n kß║┐t trong ph├ón tß╗Ł methane v├Ā liß╗ćt k├¬ mß╗Öt sß╗æ ß╗®ng dß╗źng cß╗¦a n├│ th├┤ng qua t├¼m hiß╗āu tr├¬n s├Īch b├Īo, internetŌĆ”
-
Vß║Łn dß╗źng trang 44 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Khi cŲĪ thß╗ā bß╗ŗ mß║źt nŲ░ß╗øc do ti├¬u chß║Ży, n├┤n mß╗Ła,ŌĆ” ngŲ░ß╗Øi ta thŲ░ß╗Øng cho bß╗ćnh nh├ón uß╗æng dung dß╗ŗch oresol. T├¼m hiß╗āu qua s├Īch b├Īo v├Ā internet, h├Ży cho biß║┐t th├Ānh phß║¦n cß╗¦a oresol c├│ c├Īc loß║Īi chß║źt n├Āo (chß║źt ion, chß║źt cß╗Öng h├│a trß╗ŗ)? Trong trŲ░ß╗Øng hß╗Żp kh├┤ng c├│ oresol th├¼ c├│ thß╗ā thay thß║┐ bß║▒ng c├Īch n├Āo kh├Īc kh├┤ng? Giß║Żi th├Łch?
-
Giß║Żi b├Āi 1 trang 44 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
H├Ży vß║Į sŲĪ ─æß╗ō v├Ā m├┤ tß║Ż qu├Ī tr├¼nh tß║Īo th├Ānh li├¬n kß║┐t trong ph├ón tß╗Ł sodium oxide (h├¼nh b├¬n)
-
Giß║Żi b├Āi 2 trang 44 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Cho biß║┐t vß╗ŗ tr├Ł trong bß║Żng tuß║¦n ho├Ān, sß╗æ electron lß╗øp ngo├Āi c├╣ng cß╗¦a nguy├¬n tß╗Ł mß╗Śi nguy├¬n tß╗æ N, C, O v├Ā vß║Į sŲĪ ─æß╗ō h├¼nh th├Ānh li├¬n kß║┐t trong c├Īc ph├ón tß╗Ł ß╗¤ h├¼nh sau:
-
Giß║Żi b├Āi 3 trang 44 SGK Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Potassium chloride l├Ā hß╗Żp chß║źt c├│ nhiß╗üu ß╗®ng dß╗źng trong ─æß╗Øi sß╗æng. Trong n├┤ng nghiß╗ćp, n├│ ─æŲ░ß╗Żc d├╣ng l├Ām ph├ón b├│n. Trong c├┤ng nghiß╗ćp, potassium chloride ─æŲ░ß╗Żc d├╣ng l├Ām nguy├¬n liß╗ću ─æß╗ā sß║Żn xuß║źt potassium hydroxide v├Ā kim loß║Īi potassium. Trong y hß╗Źc, potassium chloride ─æŲ░ß╗Żc d├╣ng ─æß╗ā b├Āo chß║┐ thuß╗æc ─æiß╗üu trß╗ŗ bß╗ćnh thiß║┐u kali trong m├Īu. Potassium chloride rß║źt cß║¦n thiß║┐t cho cŲĪ thß╗ā, trong c├Īc chß╗®c n─āng hoß║Īt ─æß╗Öng cß╗¦a hß╗ć ti├¬u h├│a, tim, th├ón, cŲĪ v├Ā cß║Ż hß╗ć thß║¦n kinh
Hß╗Żp chß║źt potassium chloride c├│ loß║Īi li├¬n kß║┐t g├¼ trong ph├ón tß╗Ł? Vß║Į sŲĪ ─æß╗ō h├¼nh th├Ānh li├¬n kß║┐t c├│ trong ph├ón tß╗Ł n├Āy.
-
Giß║Żi b├Āi 6.1 trang 18 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Ph├Īt biß╗āu n├Āo sau ─æ├óy ─æ├║ng?
A. Tß║źt cß║Ż c├Īc nguy├¬n tß╗æ kh├Ł hiß║┐m ─æß╗üu c├│ 8 electron ß╗¤ lß╗øp electron ngo├Āi c├╣ng.
B. Vß╗Å nguy├¬n tß╗Ł cß╗¦a c├Īc nguy├¬n tß╗æ kh├Ł hiß║┐m ─æß╗üu c├│ c├╣ng sß╗æ lß╗øp electron.
C. C├Īc nguy├¬n tß╗æ kh├Ł hiß║┐m ─æß╗üu rß║źt kh├│ hoß║Ęc kh├┤ng kß║┐t hß╗Żp vß╗øi nguy├¬n tß╗æ kh├Īc th├Ānh hß╗Żp chß║źt.
D. Hß╗Żp chß║źt tß║Īo bß╗¤i c├Īc nguy├¬n tß╗æ kh├Ł hiß║┐m ─æß╗üu ß╗¤ thß╗ā kh├Ł.
-
Giß║Żi b├Āi 6.2 trang 18 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
H├Ży chß╗Źn ph├Īt biß╗āu ─æ├║ng ─æß╗ā ho├Ān th├Ānh c├óu sau: ─Éß╗ā c├│ sß╗æ electron ß╗¤ lß╗øp ngo├Āi c├╣ng giß╗æng nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ kh├Ł hiß║┐m, c├Īc nguy├¬n tß╗Ł cß╗¦a c├Īc nguy├¬n tß╗æ c├│ khuynh hŲ░ß╗øng
A. nhŲ░ß╗Øng c├Īc electron ß╗¤ lß╗øp ngo├Āi c├╣ng.
B.nhß║Łn th├¬m electron v├Āo lß╗øp electron ngo├Āi c├╣ng.
C. nhŲ░ß╗Øg electron hoß║Ęc nhß║Łn electron ─æß╗ā lß╗øp electron ngo├Āi c├╣ng ─æß║Īt trß║Īng th├Īi bß╗ün (c├│ 8 electron).
D. nhŲ░ß╗Øng electron hoß║Ęc nhß║Łn electron hoß║Ęc g├│p chung electron.
-
Giß║Żi b├Āi 6.3 trang 18 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Ph├Īt biß╗āu n├Āo sau ─æ├óy ─æ├║ng?
A. ─Éß╗ā tß║Īo ion dŲ░ŲĪng th├¼ nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ phi kim sß║Į nhŲ░ß╗Øng c├Īc electron ß╗¤ lß╗øp ngo├Āi c├╣ng.
B. ─Éß╗ā tß║Īo ion dŲ░ŲĪng th├¼ nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ phi kim sß║Į nhß║Łn th├¬m electron ─æß╗ā c├│ ─æß╗¦ 8 electron ß╗¤ lß╗øp electron ngo├Āi c├╣ng.
C. ─Éß╗ā tß║Īo ion dŲ░ŲĪng th├¼ nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ kim loß║Īi sß║Į nhß║Łn th├¬m electron ─æß╗ā c├│ ─æß╗¦ 8 electron ß╗¤ lß╗øp electron ngo├Āi c├╣ng.
D. ─Éß╗ā tß║Īo ion dŲ░ŲĪng th├¼ nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ ho├Ī hß╗Źc sß║Į nhŲ░ß╗Øng c├Īc electron ß╗¤ lß╗øp ngo├Āi c├╣ng.
-
Giß║Żi b├Āi 6.4 trang 18 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Ph├Īt biß╗āu n├Āo sau ─æ├óy ─æ├║ng?
A. Nguy├¬n tß╗æ tß║Īo ion ├óm ─æß╗üu l├Ā nguy├¬n tß╗æ phi kim.
B. Nguy├¬n tß╗æ tß║Īo ion dŲ░ŲĪng c├│ thß╗ā l├Ā nguy├¬n tß╗æ kim loß║Īi hoß║Ęc nguy├¬n tß╗æ phi kim.
C. ─Éß╗ā tß║Īo ion dŲ░ŲĪng th├¼ nguy├¬n tß╗æ phi kim sß║Į nhŲ░ß╗Øng electron.
D. ─Éß╗ā tß║Īo ion ├óm th├¼ nguy├¬n tß╗æ kim loß║Īi sß║Į nhß║Łn electron.
-
Giß║Żi b├Āi 6.5 trang 18 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Ph├Īt biß╗āu n├Āo sau ─æ├óy ─æ├║ng?
A. ─Éß╗ā tß║Īo ion ├óm th├¼ nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ phi kim sß║Į nhŲ░ß╗Øng c├Īc electron ß╗¤ lß╗øp ngo├Āi c├╣ng.
B. ─Éß╗ā tß║Īo ion ├óm th├¼ nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ phi kim sß║Į nhß║Łn th├¬m electron ─æß╗ā c├│ ─æß╗¦ 8 electron ß╗¤ lß╗øp electron ngo├Āi c├╣ng.
C. ─Éß╗ā tß║Īo ion ├óm th├¼ nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ kim loß║Īi sß║Į nhß║Łn th├¬m electron ─æß╗ā c├│ ─æß╗¦ 8 electron ß╗¤ lß╗øp electron ngo├Āi c├╣ng.
D. ─Éß╗ā tß║Īo ion ├óm th├¼ nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ ho├Ī hß╗Źc sß║Į nhŲ░ß╗Øng c├Īc electron ß╗¤ lß╗øp ngo├Āi c├╣ng.
-
Giß║Żi b├Āi 6.6 trang 19 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Ph├Īt biß╗āu n├Āo sau ─æ├óy kh├┤ng ─æ├║ng?
A. Li├¬n kß║┐t trong c├Īc ph├ón tß╗Ł ─æŲĪn chß║źt thŲ░ß╗Øng l├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ.
B. Sau khi c├Īc nguy├¬n tß╗Ł li├¬n kß║┐t vß╗øi nhau, sß╗æ electron ß╗¤ lß╗øp ngo├Āi c├╣ng sß║Į giß╗æng nguy├¬n tß╗æ kh├Ł hiß║┐m.
C. Li├¬n kß║┐t giß╗»a c├Īc nguy├¬n tß╗æ phi kim thŲ░ß╗Øng l├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ.
D. Li├¬n kß║┐t giß╗»a nguy├¬n tß╗æ kim loß║Īi vß╗øi nguy├¬n tß╗æ phi kim ─æß╗üu l├Ā li├¬n kß║┐t ion.
-
Giß║Żi b├Āi 6.7 trang 19 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng, ph├Īt biß╗āu n├Āo sau ─æ├óy ─æ├║ng?
A. Tß║źt cß║Ż c├Īc hß╗Żp chß║źt ß╗¤ thß╗ā rß║»n ─æß╗üu l├Ā chß║źt ion.
B. Chß║źt cß╗Öng ho├Ī trß╗ŗ lu├┤n ß╗¤ thß╗ā rß║»n.
C. Chß║źt chß╗ē c├│ li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ l├Ā chß║źt cß╗Öng ho├Ī trß╗ŗ v├Ā lu├┤n ß╗¤ thß╗ā kh├Ł.
D. Hß╗Żp chß║źt c├│ chß╗®a kim loß║Īi thŲ░ß╗Øng l├Ā chß║źt ion.
-
Giß║Żi b├Āi 6.8 trang 19 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Ph├Īt biß╗āu n├Āo sau ─æ├óy kh├┤ng ─æ├║ng?
A. Hß╗Żp chß║źt chß╗ē c├│ li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ l├Ā chß║źt cß╗Öng ho├Ī trß╗ŗ.
B. Hß╗Żp chß║źt chß╗ē c├│ li├¬n kß║┐t ion l├Ā chß║źt ion.
C. Mß╗Öt sß╗æ hß╗Żp chß║źt c├│ cß║Ż li├¬n kß║┐t ion v├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ.
D. ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng, hß╗Żp chß║źt ß╗¤ thß╗ā rß║»n l├Ā chß║źt ion.
-
Giß║Żi b├Āi 6.9 trang 19 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Ph├Īt biß╗āu n├Āo sau ─æ├óy ─æ├║ng?
A. Hß╗Żp chß║źt ion v├Ā chß║źt cß╗Öng ho├Ī trß╗ŗ ─æß╗üu bß╗ün vß╗øi nhiß╗ćt.
B. Hß╗Żp chß║źt ion v├Ā chß║źt cß╗Öng ho├Ī trß╗ŗ ─æß╗üu tan tß╗æt trong nŲ░ß╗øc.
C. Khi c├Īc chß║źt ion v├Ā chß║źt cß╗Öng ho├Ī trß╗ŗ tan trong nŲ░ß╗øc ─æß╗üu tß║Īo dung dß╗ŗch c├│ khß║Ż n─āng dß║½n ─æiß╗ćn ─æŲ░ß╗Żc.
D. C├Īc chß║źt ion lu├┤n ß╗¤ thß╗ā rß║»n.
-
Giß║Żi b├Āi 6.10 trang 19 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
C├│ c├Īc ph├Īt biß╗āu sau:
(a) Tß║źt cß║Ż c├Īc chß║źt ion ─æß╗üu ß╗¤ thß╗ā rß║»n.
(b) Tß║źt cß║Ż c├Īc chß║źt ion ─æß╗üu tan trong nŲ░ß╗øc tß║Īo th├Ānh dung dß╗ŗch c├│ khß║Ż n─āng dß║½n ─æiß╗ćn.
(c) Khi ─æun sodium chloride rß║»n ß╗¤ nhiß╗ćt ─æß╗Ö cao sß║Į ─æŲ░ß╗Żc sodium chloride lß╗Ång dß║½n ─æiß╗ćn.
(d) ─ÉŲ░ß╗Øng tinh luyß╗ćn v├Ā muß╗æi ─ān ─æß╗üu l├Ā chß║źt rß║»n tan ─æŲ░ß╗Żc trong nŲ░ß╗øc tß║Īo dung dß╗ŗch dß║½n ─æiß╗ćn.
Sß╗æ ph├Īt biß╗āu ─æ├║ng l├Ā
A. 1.
B.2.
C. 3.
D.4.
-
Giß║Żi b├Āi 6.11 trang 20 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
C├│ c├Īc ph├Īt biß╗āu sau:
(a) ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng, c├Īc chß║źt ion ─æß╗üu ß╗¤ thß╗ā rß║»n.
(b) ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng, c├Īc hß╗Żp chß║źt ß╗¤ thß╗ā lß╗Ång ─æß╗üu l├Ā chß║źt cß╗Öng ho├Ī trß╗ŗ.
(c) Hß╗Żp chß║źt cß╗¦a kim loß║Īi kh├│ bay hŲĪi, kh├│ n├│ng chß║Ży, dß╗ģ tan trong nŲ░ß╗øc tß║Īo dung dß╗ŗch dß║½n ─æŲ░ß╗Żc ─æiß╗ćn.
(d) Hß╗Żp chß║źt chß╗ē gß╗ōm c├Īc nguy├¬n tß╗æ phi kim thŲ░ß╗Øng dß╗ģ bay hŲĪi, k├®m bß╗ün vß╗øi nhiß╗ćt.
(e) Hß╗Żp chß║źt tan ─æŲ░ß╗Żc trong nŲ░ß╗øc th├Ānh dung dß╗ŗch kh├┤ng dß║½n ─æiß╗ćn thŲ░ß╗Øng l├Ā chß║źt cß╗Öng ho├Ī trß╗ŗ.
Sß╗æ ph├Īt biß╗āu ─æ├║ng l├Ā
A. 5.
B.4.
C. 3.
D. 2.
-
Giß║Żi b├Āi 6.12 trang 20 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
C├│ c├Īc ph├Īt biß╗āu sau:
(a) Trong hß╗Żp chß║źt, kim loß║Īi lu├┤n nhŲ░ß╗Øng electron, phi kim lu├┤n nhß║Łn electron.
(b) ─Éß╗ā c├│ 8 electron ß╗¤ lß╗øp vß╗Å ngo├Āi c├╣ng th├¼ nguy├¬n tß╗Ł aluminium hoß║Ęc nhŲ░ß╗Øng 3 electron hoß║Ęc nhß║Łn 5 electron.
(c) Li├¬n kß║┐t trong hß╗Żp chß║źt tß║Īo bß╗¤i magnesium v├Ā chlorine l├Ā li├¬n kß║┐t ion.
(d) Trong ph├ón tß╗Ł, hß╗Żp chß║źt gß╗ōm c├Īc nguy├¬n tß╗æ C,H, O chß╗ē c├│ li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ.
(e) Khi tß║Īo li├¬n kß║┐t ho├Ī hß╗Źc, nguy├¬n tß╗Ł chlorine chß╗ē tß║Īo ion ├óm bß║▒ng c├Īch nhß║Łn th├¬m 1 electron.
Sß╗æ ph├Īt biß╗āu ─æ├║ng l├Ā
A. 1.
B. 2.
C. 3.
D. 4.
-
Giß║Żi b├Āi 6.13 trang 20 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
─Éiß╗ün ─æß║¦y ─æß╗¦ c├Īc tß╗½ hoß║Ęc cß╗źm tß╗½ th├Łch hß╗Żp v├Āo c├Īc c├óu dŲ░ß╗øi ─æ├óy:
a) ─Éß╗ā tß║Īo ion dŲ░ŲĪng th├¼ (1)... sß║Į (2).... Sß╗æ electron (3)... bß║▒ng (4)...
b) ─Éß╗ā tß║Īo ion ├óm th├¼ (5)... sß║Į (6).... Sß╗æ electron (7)... bß║▒ng (8)...
-
Giß║Żi b├Āi 6.14 trang 20 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
─Éiß╗ün ─æß║¦y ─æß╗¦ c├Īc tß╗½ hoß║Ęc cß╗źm tß╗½ th├Łch hß╗Żp v├Āo c├Īc c├óu dŲ░ß╗øi ─æ├óy:
a) Chß║źt ion lu├┤n chß╗®a nguy├¬n tß╗æ (1)..., ß╗¤ ─æiß╗üu kiß╗ćn thŲ░ß╗Øng lu├┤n ß╗¤ (2)...
b) ß╗× ─æiß╗üu kiß╗ćn thŲ░ß╗Øng, chß║źt ß╗¤ thß╗ā kh├Ł lu├┤n l├Ā (3).... Chß║źt n├Āy c├│ thß╗ā (4)..., tß║Īo dung dß╗ŗch c├│ khß║Ż n─āng (5)...
-
Giß║Żi b├Āi 6.15 trang 20 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Magnesium oxide (gß╗ōm 1 nguy├¬n tß╗Ł magnesium v├Ā 1 nguy├¬n tß╗Ł oxygen) c├│ nhiß╗üu ß╗®ng dß╗źng trong ─æß╗Øi sß╗æng. N├│ l├Ā th├Ānh phß║¦n ch├Łnh trong c├Īc l├▓ sß║Żn xuß║źt sß║»t, th├®p, c├Īc kim loß║Īi m├Āu, thuß╗Ę tß╗ēnh hay xi m─āng, .. Em h├Ży cho biß║┐t th├¬m c├Īc ß╗®ng dß╗źng kh├Īc cß╗¦a magnesium oxide. Vß║Į sŲĪ ─æß╗ō h├¼nh th├Ānh li├¬n kß║┐t tß║Īo ra ph├ón tß╗Ł magnesium oxide v├Ā t├Łnh khß╗æi lŲ░ß╗Żng ph├ón tß╗Ł cß╗¦a n├│.

-
Giß║Żi b├Āi 6.16 trang 21 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
H├Ży liß╗ćt k├¬ 2 chß║źt kh├│ bay hŲĪi, kh├│ n├│ng chß║Ży, dß╗ģ tan trong nŲ░ß╗øc tß║Īo dung dß╗ŗch dß║½n ─æŲ░ß╗Żc ─æiß╗ćn.
-
Giß║Żi b├Āi 6.17 trang 21 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Trong giß║źm gß║Īo c├│ chß╗®a tß╗½ 7% ─æß║┐n 20% acetic acid (ph├ón tß╗Ł gß╗ōm 2 nguy├¬n tß╗Ł carbon, 4 nguy├¬n tß╗Ł hydrogen v├Ā 2 nguy├¬n tß╗Ł oxygen). Theo em, acetic acid l├Ā chß║źt ion hay chß║źt cß╗Öng ho├Ī trß╗ŗ? T├Łnh khß╗æi lŲ░ß╗Żng ph├ón tß╗Ł cß╗¦a hß╗Żp chß║źt n├Āy.

-
Giß║Żi b├Āi 6.18 trang 21 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Ph├ón tß╗Ł (A) c├│ khß╗æi lŲ░ß╗Żng ph├ón tß╗Ł > 30 amu, thß╗ā kh├Ł, l├Ā nguy├¬n nh├ón g├óy ra hiß╗ću ß╗®ng nh├Ā k├Łnh. Trong ph├ón tß╗Ł X c├│ loß║Īi li├¬n kß║┐t g├¼? Vß║Į sŲĪ ─æß╗ō h├¼nh th├Ānh li├¬n kß║┐t trong ph├ón tß╗Ł (A).
-
Giß║Żi b├Āi 6.19 trang 21 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
H├Ży liß╗ćt k├¬ 3 ph├ón tß╗Ł ─æß╗üu tß║Īo tß╗½ mß╗Öt nguy├¬n tß╗æ T v├Ā ─æß╗üu c├│ khß╗æi lŲ░ß╗Żng ph├ón tß╗Ł nhß╗Å hŲĪn 50 amu. Trong ─æ├│ gß╗ōm: 1 ph├ón tß╗Ł ─æŲĪn chß║źt, 1 ph├ón tß╗Ł hß╗Żp chß║źt c├│ li├¬n kß║┐t ion v├Ā 1 ph├ón tß╗Ł hß╗Żp chß║źt c├│ li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ. T├Łnh khß╗æi lŲ░ß╗Żng c├Īc ph├ón tß╗Ł tr├¬n.
-
Giß║Żi b├Āi 6.20 trang 21 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Trong quß║Ż nho ch├Łn c├│ chß╗®a nhiß╗üu glucose. Ph├ón tß╗Ł glucose gß╗ōm c├│ 6 nguy├¬n tß╗Ł carbon, 12 nguy├¬n tß╗Ł hydrogen v├Ā 6 nguy├¬n tß╗Ł oxygen. Theo em, trong ph├ón tß╗Ł glucose c├│ li├¬n kß║┐t ion hay li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ? Giß║Żi th├Łch v├Ā t├Łnh khß╗æi lŲ░ß╗Żng ph├ón tß╗Ł glucose.
-
Giß║Żi b├Āi 6.21 trang 21 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
Hß╗Żp chß║źt (B) c├│ trong ŌĆ£muß╗æi i-ß╗ætŌĆØ ─æŲ░ß╗Żc sß╗Ł dß╗źng trong thuß╗æc ─æiß╗üu trß╗ŗ bß╗ćnh cŲ░ß╗Øng gi├Īp, nß║źm da v├Ā d├╣ng l├Ām thß╗▒c phß║®m chß╗®c n─āng, ... Vß║Ły, (B) l├Ā chß║źt ion hay chß║źt cß╗Öng ho├Ī trß╗ŗ? Cho biß║┐t khß╗æi lŲ░ß╗Żng ph├ón tß╗Ł cß╗¦a (B).
-
Giß║Żi b├Āi 6.22 trang 21 SBT Khoa hß╗Źc tß╗▒ nhi├¬n 7 Ch├ón trß╗Øi s├Īng tß║Īo - CTST
─Éß╗ā ph├Īo hoa c├│ nhiß╗üu m├Āu sß║»c kh├Īc nhau, ngŲ░ß╗Øi ta sß║Į cho v├Āo thuß╗æc ph├Īo c├Īc chß║źt phß╗ź gia tß║Īo m├Āu. C├Īc chß║źt phß╗ź gia n├Āy thŲ░ß╗Øng l├Ā c├Īc muß╗æi cß╗¦a mß╗Öt sß╗æ kim loß║Īi, trong ─æ├│ c├│ muß╗æi (D) gß╗ōm 1 nguy├¬n tß╗Ł kim loß║Īi M v├Ā 2 nguy├¬n tß╗Ł Cß╗Ŗ; biß║┐t (D) c├│ khß╗æi lŲ░ß╗Żng ph├ón tß╗Ł l├Ā 135 amu. Tra bß║Żng tuß║¦n ho├Ān, h├Ży x├Īc ─æß╗ŗnh kim loß║Īi M. Trong ph├ón tß╗Ł muß╗æi (D) c├│ loß║Īi li├¬n kß║┐t g├¼? Giß║Żi th├Łch.




.JPG)

.JPG)

.JPG)