Hôm nay các em sẽ được học về liên kết hóa học và các loại liên kết thường gặp. Đây cũng là một trong những lý thuyết quan trọng trong bộ môn Khoa học tự nhiên lớp 7. Trong bài viết sau, HOC247 sẽ cung cấp cho các em một số kiến thức trọng tâm về các loại liên kết hóa học, các em hãy cùng tìm hiểu thông qua Bài 6: Giới thiệu về liên kết hóa học chương trình SGK Chân trời sáng tạo nhé!
Tóm tắt lý thuyết
1.1. Vỏ nguyên tử khí hiếm
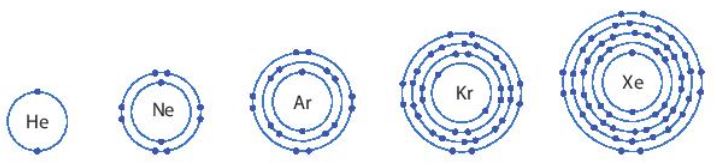
- Nhóm khí hiếm là nhóm các nguyên tố hoạt động hoá học kém, gồm: helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe), ...
Hình 6.1. Hình mô phỏng vỏ nguyên tử của một số nguyên tố khí hiếm
- Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng chỉ có 2 electron.
1.2. Liên kết ion
a. Sự tạo thành ion dương
- Các nguyên tử của nguyên tố kim loại thường có xu hướng nhường electron ở lớp ngoài cùng để có lớp electron ngoài cùng giống nguyên tử của nguyên tố khí hiếm gần nhất trong bảng tuần hoàn.
- Nguyên tử kim loại khi nhường electron sẽ tạo thành ion dương (Hình 6.2).
Hình 6.2. Sơ đồ tạo thành ion dương của sodium (a) và magnesium (b)
b. Sự tạo thành ion âm
- Các nguyên tử của nguyên tố phi kim (Cl, O, N, ...) có số electron lớp ngoài cùng là 7, 6, 5,...
- Khi kết hợp với các nguyên tử kim loại, nguyên tử phi kim có xu hướng nhận electron từ nguyên tử kim loại để có lớp ngoài cũng giống nguyên tử của nguyên tố khí hiếm gần nhất trong bảng tuần hoàn.
- Nguyên tử phi kim khi nhận electron sẽ tạo thành ion âm tương ứng (Hình 6.3).
Hình 6.3. Sơ đồ tạo thành ion âm của chlorine (a) và oxygen (b)
c. Sự tạo thành liên kết ion
- Khi nguyên tử kim loại kết hợp với nguyên tử phi kim, nguyên tử kim loại nhường electron tạo thành ion dương, đồng thời nguyên tử phi kim nhận electron tạo thành ion âm.
- lon dương và ion âm mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion.
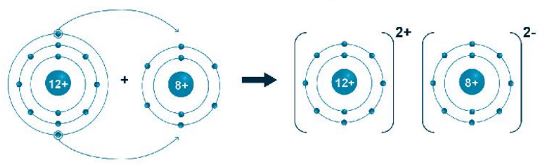
Hình 6.4. a) Sơ đồ tạo thành liên kết ion trong phân tử sodium chloride.
b) Hình mô phỏng phân tử sodium chloride
1.3. Liên kết cộng hóa trị
Hình 6.5. Lớp electron ngoài cùng của nguyên tử hydrogen (a),
helium (b), oxygen (c), neon (d)
- Để có lớp electron ngoài cùng giống nguyên tử của nguyên tố khí hiếm gần nhất, các nguyên tử của nguyên tố phi kim có xu hướng góp chung electron.
- Sau khi hình thành liên kết, số electron của mỗi nguyên tử được xác định bằng tổng số electron dùng chung giữa các nguyên tử và số electron còn lại của mỗi nguyên tử.
- Liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử được gọi là liên kết cộng hoá trị.
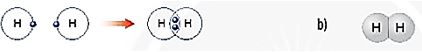
Hình 6.6. a) Sơ đồ tạo thành liên kết cộng hoá trị trong phân tử hydrogen
b) Hình mô phỏng phân tử hydrogen
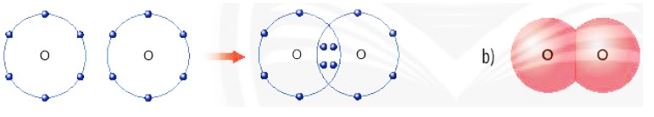
Hình 6.7. a) Sơ đồ tạo thành liên kết cộng hoá trị trong phân tử oxygen
b) Hình mô phỏng phân tử oxygen
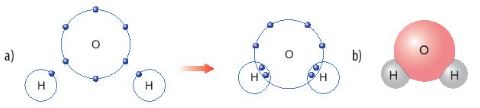
Hình 6.8. a) Sơ đồ tạo thành liên kết cộng hoá trị trong phân tử nước
b) Hình mô phỏng phân tử nước
- Liên kết cộng hoá trị thường là liên kết giữa hai nguyên tử của nguyên tố phi kim.
Ví dụ: Phân tử khí hydrogen có liên kết cộng hoá trị giữa 2 nguyên tử H; phân tử khí oxygen có liên kết cộng hoá trị giữa 2 nguyên tử O; ...Phân tử nước có liên kết cộng hoá trị giữa nguyên tử hydrogen và oxygen; phân tử carbon dioxide có liên kết cộng hoá trị giữa nguyên tử carbon và oxygen; phân tử ammonia có liên kết công hoá trị giữa nguyên tử nitrogen và hydrogen; ...
1.4. Chất ion, chất cộng hóa trị
- Chất được tạo bởi các ion dương và ion âm được gọi là chất ion.
Ví dụ: Các phân tử như sodium chloride, calcium chloride, magnesium oxide,...được hình thành bằng liên kết ion.
Hình 6.9. Một số hợp chất ion
- Chất được tạo thành nhờ liên kết cộng hoá trị được gọi là chất cộng hoá trị.
Ví dụ: Những chất như khí hydrogen, khí ammonia, nước, đường tinh luyện (saccharose), ethanol, khí carbon dioxide được hình thành bằng liên kết cộng hóa trị.
Hình 6.10. Một số hợp chất cộng hóa trị
1.5. Một số tính chất của chất ion và chất cộng hóa trị
- Chất ion khó bay hơi, khó nóng chảy, khi tan trong nước tạo dung dịch dẫn được điện.
- Chất cộng hoá trị thường dễ bay hơi, kém bền với nhiệt; một số chất tan được trong nước thành dung dịch. Tuỳ thuộc vào chất cộng hoá trị khi tan trong nước mà dung dịch thu được có thể dẫn điện hoặc không dẫn điện.
|
1. Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng chỉ có 2 electron. 2. Liên kết ion là liên kết giữa ion dương và ion âm. Các ion dương và ion âm đơn nguyên tử có lớp electron ngoài cùng giống với nguyên tử của nguyên tố khí hiểm. 3. Liên kết cộng hoá trị là liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử. Liên kết cộng hoá trị thường là liên kết giữa hai nguyên tử của nguyên tố phi kim 4. Chất ion là chất được tạo bởi các ion dương và ion âm. Ở điều kiện thường, chất ion thường ở thể rắn. Chất ion khó bay hơi, khó nóng chảy, khi tan trong nước tạo dung dịch dẫn được điện. 5. Chất cộng hóa trị là chất được tạo thành nhờ liên kết cộng hoá trị. Ở điều kiện thường, chất cộng hóa trị có thể ở thể rắn, lỏng hoặc khí. Chất cộng hoá trị thường dễ bay hơi, kém bền với nhiệt; một số chất tan được trong nước thành dung dịch. Tuỳ thuộc vào chất cộng hoá trị khi tan trong nước mà dung dịch thu được có thể dẫn điện hoặc không dẫn điện. |
Bài tập minh họa
Bài 1: Magnesium oxide (gồm 1 nguyên tử magnesium và 1 nguyên tử oxygen) có nhiều ứng dụng trong đời sống. Nó là thành phần chính trong các lò sản xuất sắt, thép, các kim loại màu, thủy tinh hay xi măng,… Em hãy cho biết thêm các ứng dụng khác của magnesium oxide. Vẽ sơ đồ hình thành phân tử magnesium oxide và tính khối lượng phân tử của nó.
Hướng dẫn giải:
- Các ứng dụng khác của magnesium oxide:
+ Xử lý nước thải, nước sinh hoạt, xử lý đất, xử lý nước ngầm,… để ổn định pH.
+ Giúp cơ thể cải thiện chứng khó tiêu, ổn định acid trong dạ dạy,…
+ Dùng làm lõi cửa chống cháy,…
- Sự hình thành phân tử magnesium oxide:
+ Nguyên tử của nguyên tố magnesium nhường 2 electron lớp ngoài cùng để tạo thành ion dương có 8 electron lớp ngoài cùng bền vững.
+ Nguyên tử của nguyên tố oxygen nhận 2 electron để tạo ion âm có 8 electron lớp ngoài cùng bền vững.
+ Hai ion trái dấu hút nhau bằng lực hút tĩnh điện và tạo thành liên kết ion
- Phân tử magnesium oxide được tạo bởi một nguyên tử của nguyên tố Mg và một nguyên tử của nguyên tố O
=> Khối lượng phân tử magnesium oxide là: 24.1+ 16.1 = 40 (amu)
Bài 2: Trong quả nho chín có chứa nhiều glucose. Phân tử glucose gồm có 6 nguyên tử carbon, 12 nguyên tử hydrogen và 6 nguyên tử oxygen. Theo em, trong phân tử glucose có liên kết ion hay liên kết cộng hóa trị? Giải thích và tính khối lượng phân tử glucose.
.jpeg)
Hướng dẫn giải
- Phân tử glucose được tạo bởi nguyên tử của các nguyên tố C, H, O, là những nguyên tử của nguyên tố phi kim nên liên kết trong phân tử này là liên kết cộng hóa trị.
=> Glucose là chất cộng hóa trị
- Phân tử glucose gồm 6 nguyên tử carbon, 12 nguyên tử hydrogen và 6 nguyên tử oxygen
=> Khối lượng phân tử glucose là: 6.12 + 12.1 + 6.16 = 180 (amu).
Luyện tập Bài 6 Khoa học tự nhiên 7 CTST
Học xong bài học này, em có thể:
- Nêu được mô hình sắp xếp các electron trong vỏ nguyên tử của một số nguyên tố khí hiếm.
- Nêu được sự hình thành liên kết cộng hoá trị theo nguyên tắc dùng chung electron để tạo ra lớp electron ngoài cũng giống nguyên tử nguyên tố khí hiếm.
- Nêu được sự hình thành liên kết ion theo nguyên tắc cho và nhận electron để tạo ra ion có lớp electron ngoài cùng giống nguyên tử nguyên tố khí hiếm.
- Chỉ ra được sự khác nhau về một số tính chất của hợp chất ion và hợp chất cộng hoá trị.
3.1. Trắc nghiệm Bài 6 Khoa học tự nhiên 7 CTST
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Khoa học tự nhiên 7 Chân trời sáng tạo Chủ đề 2 Bài 6 cực hay có đáp án và lời giải chi tiết.
-
Câu 1:
Phát biểu nào sau đây đúng?
- A. Tất cả các nguyên tố khí hiếm đều có 8 electron ở lớp electron ngoài cùng.
- B. Vỏ nguyên tử của các nguyên tố khí hiếm đều có cùng số lớp electron.
- C. Các nguyên tố khí hiếm đều rất khó hoặc không kết hợp với nguyên tố khác hợp thành hợp chất.
- D. Hợp chất tạo bởi các nguyên tố khí hiếm đều ở thể khí.
-
- A. nhường các electron ở lớp ngoài cùng.
- B. nhận thêm electron vào lớp electron ngoài cùng.
- C. nhườg electron hoặc nhận electron để lớp electron ngoài cùng đạt trạng thái bền (có 8 electron).
- D. nhường electron hoặc nhận electron hoặc góp chung electron.
-
Câu 3:
Phát biểu nào sau đây đúng?
-
A.
Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhường các electron ở lớp ngoài cùng.
-
B.
Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
-
C.
Để tạo ion dương thì nguyên tử của nguyên tố kim loại sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
-
D.
Để tạo ion dương thì nguyên tử của nguyên tố hoá học sẽ nhường các electron ở lớp ngoài cùng.
-
A.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 6 Khoa học tự nhiên 7 CTST
Các em có thể xem thêm phần hướng dẫn Giải bài tập Khoa học tự nhiên 7 Chân trời sáng tạo Chủ đề 2 Bài 6 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Mở đầu trang 37 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 1 trang 37 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 2 trang 38 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 3 trang 38 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 4 trang 39 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 5 trang 40 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 6 trang 40 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 7 trang 40 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 8 trang 41 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 9 trang 41 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 10 trang 41 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 11 trang 42 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 12 trang 42 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 13 trang 42 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Thảo luận 14 trang 43 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Luyện tập trang 38 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Luyện tập trang 39 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Luyện tập trang 39 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Luyện tập trang 41 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Luyện tập trang 42 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Luyện tập trang 44 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Vận dụng trang 39 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Vận dụng trang 41 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Vận dụng trang 44 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 1 trang 44 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 2 trang 44 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 3 trang 44 SGK Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.1 trang 18 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.2 trang 18 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.3 trang 18 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.4 trang 18 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.5 trang 18 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.6 trang 19 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.7 trang 19 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.8 trang 19 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.9 trang 19 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.10 trang 19 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.11 trang 20 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.12 trang 20 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.13 trang 20 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.14 trang 20 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.15 trang 20 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.16 trang 21 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.17 trang 21 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.18 trang 21 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.19 trang 21 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.20 trang 21 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.21 trang 21 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Giải bài 6.22 trang 21 SBT Khoa học tự nhiên 7 Chân trời sáng tạo - CTST
Hỏi đáp Bài 6 Khoa học tự nhiên 7 CTST
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Khoa học tự nhiên HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!


.JPG)

.JPG)
.JPG)