Các em đã được tìm hiểu tất cả các loại hợp chất vô cơ, củng như mối quan hệ của chúng. Để củng cố lại các kiến thức đã học về các loại hợp chất vô cơ - Vận dụng nó để giải một số bài tập nên hôm nay chúng ta sẽ vào tiết luyện tập.
Tóm tắt lý thuyết
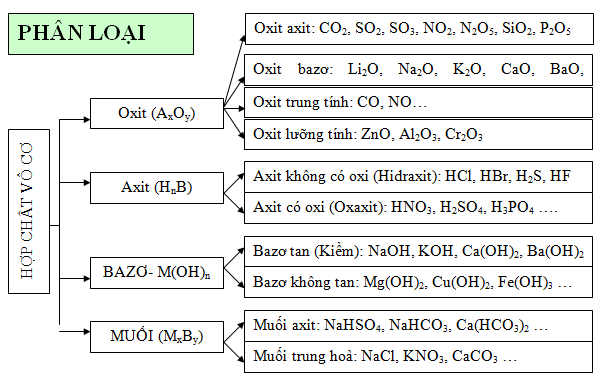
1.1. Phân loại các hợp chất vô cơ
Hình 1: Phân loại các hợp chất vô cơ
1.2. Tính chất hóa học của các loại hợp chất vô cơ
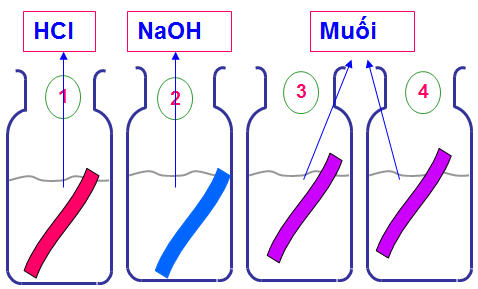
Hình 2: Mối quan hệ giữa các hợp chất vô cơ
Muối + Muối → 2Muối
Muối + Kim loại → Muối mới + Kim loại mới
Muối (t0) → Chất mới
Bài tập minh họa
Bài 1:
Để một mẫu natri hiđrôxit trên tấm kính trong không khí, sau vài ngày thấy có chất rắn màu trắng phủ ngoài. Nếu nhỏ vài giọt dd HCl vào chất rắn trắng thấy có chất khí thoát ra, khí này làm đục nước vôi trong. Chất rắn màu trắng là sản phẩm phản ứng natri hiđrôxit với
Hãy chọn câu đúng. Giải thích và viết PTHH minh họa ?
Hướng dẫn:
Câu đúng là câu e. Cacbon đioxit trong không khí
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Bài 2:
Bằng phương pháp hóa học nhận biết 4 dung dịch : HCl ,MgSO4, MgCl2, NaOH chứa trong 4 lọ mất nhãn.
Hướng dẫn:
- Đánh dấu mỗi lọ và lấy ra một ít hóa chất để thử.
- Cho giấy quỳ tím lần lượt vào 4 lọ
- Dung dịch trong lọ nào làm cho giấy quỳ tím:
+ Dung dịch trong lọ nào làm không làm đổi màu giấy quỳ tím thì lọ đó chứa dung dịch MgSO4, MgCl2
+ Nhỏ vài giọt BaCl2 vào hai lọ chứa dung dịch muối. Dung dịch trong lọ nào có hiện tượng kết tủa trắng là MgSO4
BaCl2 + MgSO4 → MgCl2 + BaSO4
- Còn lại MgCl2
Bài 3:
Trộn một dd có hòa tan 0,2 mol CuCl2 với một dd có hòa tan 20 g NaOH. Lọc hỗn hợp các chất sau phản ứng, được kết tủa và nước lọc . Nung kết tủa đến khi khối lượng không đổi.
a) Viết các PTHH xảy ra ?
b)Tính khối lượng chất rắn thu được sau phản ứng?
c) Tính khối lương các chất tan có trong nước lọc?
Hướng dẫn:
a. CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl (1)
0,2mol 0,4mol 0,2mol 0,4mol
Cu(OH)2 → CuO + H2O (2)
0,2mol 0,2mol
b.Ta có:
\(\begin{array}{l} {n_{CuC{l_2}}} = 0,2mol\\ {m_{NaOH}} = 20gam \Rightarrow {n_{NaCl}} = \frac{{20}}{{40}} = 0,5(mol) \end{array}\)
So sánh: \(\frac{{0,2}}{1} < \frac{{0,5}}{2}\) ⇒ Khối lượng NaOH dư
Từ pt (1) và (2) ta có nCuO = 0,2 mol
Vậy khối lượng chất rắn tạo thành sau khi nung là: mCuO = 0,2 x 80 = 16 gam
c. Các chất tan có trong nước lọc gồm: NaOH dư , NaCl tạo thành
Từ (1) ta có : nNaOH dư = 0,5 – 0,4 = 0,1 mol
nNaCl = 0,4 mol
Vậy : mNaOH dư = 0,1 x 40 = 4 gam
mNaCl = 0,4 x 58,5 = 23,4 gam
3. Luyện tập Bài 13 Hóa học 9
Sau bài học cần nắm: các loại hợp chất vô cơ, cũng như mối quan hệ của chúng.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 13 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. 0,02mol HCl.
- B. 0,1mol HCl.
- C. 0,05mol HCl.
- D. 0,01mol HCl.
-
- A. NaOH ; Cu(OH)2 ; Ba(OH)2 ; Fe(OH)3
- B. NaOH ; Cu(OH)2 ; Ba(OH)2 ; Fe(OH)2
- C. NaOH ; CuOH ; Ba(OH)2 ; Fe(OH)3
- D. NaOH ; CuOH ; Ba(OH)2 ; Fe(OH)2
-
- A. Quỳ tím.
- B. Quỳ tím ẩm.
- C. Dung dịch NaOH.
- D. Khí CO2.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 13.
Bài tập 1 trang 43 SGK Hóa học 9
Bài tập 2 trang 43 SGK Hóa học 9
Bài tập 3 trang 43 SGK Hóa học 9
4. Hỏi đáp về Bài 13 chương 1 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.


.PNG)