Dưới đây là nội dung Chuyên đề về liên kết hóa học lớp 10 năm 2021 được hoc247 biên soạn và tổng hợp, với nội dung đầy đủ, chi tiết có đáp án đi kèm sẽ giúp các em học sinh ôn tập củng cố kiến thức, nâng cao kỹ năng làm bài. Mời các em cùng tham khảo!
1. LÍ THUYẾT
1.1. Khái niệm về liên kết hóa học
a. Khái niệm về liên kết
- Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
- Khi có sự chuyển các nguyên tử riêng rẽ thành phân tử hay tinh thể tức là có liên kết hóa học thì nguyên tử có xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
b.Quy tắc bát tử (8 electron)
- Ta đã biết, các khí hiếm hoạt động hóa học rất kếm, chúng tồn tại trong tự nhiên dưới dạng nguyên tử tự do riêng rẽ, nguyên tử của chúng không liên kết với nhau mà tạo thành phân tử.
- Trong các nguyên tử khí hiếm, nguyên tử heli chỉ có 2 electron nên có 2 electron ở lớp thứ nhất cũng là lớp ngoài cùng, còn các nguyên tử khí hiếm khác để có 8 electron ở lớp ngoài cùng. Như vậy, cấu hình với 8 electron ở lớp ngoài cùng (hoặc 2 electron đối với heli) là cấu hình electron vững bền.
Theo quy tắc bát tử (8 electron) thì nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình electron vững bền của các khí hiếm với 8 electron (hoặc 2 đối với heli) ở lớp ngoài cùng.
- Với quy tắc bát tử, người ta có thể giải thích một cách định tính sự hình thành các loại liên kết trong phân tử, đặc biệt là cách viết công thức cấu tạo trong các hợp chất thông thường.
- Vì phân tử là một hệ phức tạp nên trong nhiều trường hợp quy tắc bát tử tỏ ra không đầy đủ.
1.2. Liên kết ion và liên kết cộng hóa trị
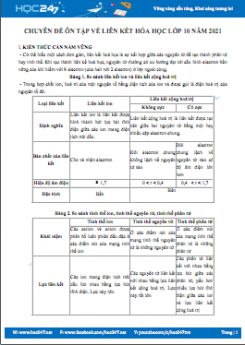
a. So sánh liên kết ion và liên kết cộng hóa trị
|
Loại liên kết |
Li ên kết i on |
Li ên kết cộng hó a trị |
|
Nguyên nhân hình thành liên kết |
Các nguyên tử liên kết với nhau để có cấu hình electron bền vững của khí hiếm. |
|
|
Bản chất của liên kết |
Lực hút tĩnh điện giữa các ion mang điện tích trái dấu (cho và nhận electron) |
Là sự dùng chung các electron (sự dùng chung theo kiểu xen phủ các AO) |
|
Điều kiện của liên kết |
Xảy ra giữa các nguyên tố khác hẳn nhau về bản chất hóa học (thường xảy ra giữa kim lọai điển hình và phi kim điển hình). |
Xảy ra giữa 2 nguyên tố giống nhau về bản chất hóa học (thường xảy ra với các nhóm IV,V,VI, VII) |
|
Đặc tính |
Rất bền |
Bền |
b. Hiệu đ ộ âm điện và liên kết hóa học
|
Hiệu độ âm điện Δχ |
0< Δχ < 0,4 |
0,4 ≤ Δχ < 1,7 |
Δχ ≥ 1,7 |
|
Loại liên kết |
Cộng hóa trị khô ng cực |
Cộng hóa trị phân cực |
Ion |
2. LUYỆN TẬP
Câu 1. Hợp chất trong phân tử có liên kết ion là
A. NH4Cl.
B. HCl.
C. H2O.
D. NH3.
Câu 2. Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A. kim loại.
B. cộng hoá trị.
C. ion.
D. cho nhận.
Câu 3. Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là:
A. HCl, O3, H2S.
B. O2, H2O, NH3.
C. HF, Cl2, H2O.
D. H2O, HF, H2S.
Câu 4. Các chất mà phân tử không phân cực là:
A. NH3, Br2, C2H4.
B. Cl2, CO2, C2H2.
C. HBr, CO2, CH4.
D. HCl, C2H2, Br2.
Câu 5. Liên kết hoá học giữa các nguyên tử trong phân tử H2O là liên kết
A. cộng hoá trị không phân cực.
B. hiđro.
C. cộng hoá trị phân cực.
D. ion.
Câu 6. Mức độ phân cực của liên kết hóa học trong các phân tử được sắp xếp theo thứ tự giảm dần từ trái sang phải là:
A. HI, HCl, HBr.
B. HCl, HBr, HI.
C. HI, HBr, HCl.
D. HBr, HI, HCl
Câu 7. Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị không cực là
A. 3.
B. 4.
C. 5.
D. 2.
Câu 8. Liên kết hóa học giữa các nguyên tử trong phân tử HCl thuộc loại liên kết
A. cộng hóa trị có cực.
B. hiđro.
C. cộng hóa trị không cực.
D. ion.
Câu 9. Cho giá trị độ âm điện của các nguyên tố: F = 3,98; O= 3,44; C= 2,55; H= 2,20; Na = 0,93). Hợp chất nào sau đây là hợp chất ion?
A. NaF.
B. CO2.
C. CH4.
D. H2O.
Câu 10. Liên kết hóa học trong phân tử Br2 thuộc loại liên kết
A. hiđro.
B. cộng hóa trị có cực.
C. ion.
D. cộng hóa trị không cực.
Trên đây là một phần trích dẫn nội dung Chuyên đề về liên kết hóa học lớp 10 năm 2021. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Chúc các em học tốt!