-
Câu hỏi:
Cho 38,55 gam hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 96,55 gam muối sunfat trung hòa và 3,92 lít (đktc) khí Z gồm hai khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol của Mg trong hỗn hợp X gần nhất với giá trị nào sau đây?
- A. 25.
- B. 15.
- C. 40.
- D. 30.
Đáp án đúng: D
Do Y chỉ chứa muối sunfat ⇒ NO3 chuyển hết sang khí NO (khí hóa nâu trong không khí)
Mặt khác sau phản ứng thu được hỗn hợp khí ⇒ có H2
Áp dụng qui tắc đường chéo:
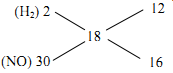
\(\\\Rightarrow n_{H_2} : n_{NO} = 3 : 4\\ \Rightarrow n_{H_2} = 0,075\ mol ;\ n_{NO} = 0,1\ mol\)
Ta có \(n_{H^+} = 2n_{H_2} + 4n_{NO} + 10n_{{NH_4}^+}\) (nếu có) \(+\ 2n_O\)
\(\Rightarrow 10n_{{NH_4}^+} + 2n_O = 0,9\ mol\ (*)\)
⇒ Bảo toàn N: \(n_{NO_3^{-}} = n_{NO} + n_{{NH_4}^+} = 0,1 + n_{{NH_4}^+}\)
Có \(m_{muoi\ sunfat} = m_{ion\ KL} + m_{SO_4^{2-}}+ m_{{NH_4}^+}\)
\(\\ \Rightarrow m_{ion\ KL} = 96,55 - 0,725\times 96 - 18n_{{NH_4}^+} = 26,95 - 18n_{{NH_4}^+}\\ \Rightarrow m_X - m_{ion\ KL} = m_O + m_{NO_3^{-}}\\ \Rightarrow 38,55 - ( 26,95 - 18n_{{NH_4}^+}) = 16nO + 62(n_{{NH_4}^+} + 0,1)\\ \Rightarrow 44n_{{NH_4}^+} + 16n_O = 5,4\ (**)\)
Từ (*) và (**) \(\Rightarrow n_{{NH_4}^+} = 0,05;\ n_O = 0,2 = n_{ZnO}\)
⇒ Bảo toàn N: \(n_{NO_3} = 0,15\ mol \Rightarrow n_{Fe(NO_3)_2} = 0,075\ mol\)
⇒ Bảo toàn e: \(2n_{Mg} + 3n_{Al} = 3n_{NO} + 2n_{H_2} + 8n_{{NH_{4}}^+}\)
⇒ 2nMg + 3nAl = 0,775 (1)
(Do Mg và Al tính khử mạnh hơn nên sẽ phản ứng với NO3- trước Fe2+; tuy nhiên do tạo khí H2 chứng tỏ khi hết NO3 nhưng kim loại vẫn dư ⇒ Fe2+ không bị oxi hóa)
⇒ mMg + mAl = 24nMg + 27nAl = 8,85g (2)
Từ (1) và (2) ⇒ nMg = 0,2 mol; nAl = 0,15 mol
⇒ %nMg (X) = 32% gần nhất với giá trị 30%YOMEDIA
Hướng dẫn Trắc nghiệm Online và Tích lũy điểm thưởng
CÂU HỎI KHÁC VỀ PHẢN ỨNG VỚI DD HNO3 , H2SO4 ĐẶC NÓNG
- Cho 4,32 gam Mg vào dung dịch hỗn hợp NaNO3 và H2SO4, đun nhẹ đến khi phản ứng xảy ra hoàn toàn thu được dung dịch X;
- Cho 3,48 gam bột Mg tan hết trong dung dịch hỗn hợp gồm HCl (dư) và KNO3, thu được dung dịch X chứa m gam muối và 0,56 L (đktc) hỗn hợp khí Y gồm N2 và H2
- Cho 3,76 gam hỗn hợp các kim loại Mg, Fe, Cu hòa tan hết vào dung dịch HNO3 loãng, dư, sau khi các phản ứng xảy ra hoàn toàn thu được 0,06 mol NO
- Hòa tan hoàn toàn 0,02 mol Fe và 0,01 mol Cu vào 200 ml dung dịch gồm HNO3 0,1M và HCl 0,4M
- Cho hỗn hợp gồm 1 mol chất X và 1 mol chất Y tác dụng hết với dung dịch H2SO4 đặc, nóng
- Có ba dung dịch riêng biệt: H2SO4 1M; KNO3 1M; HNO3 1M được đánh số ngẫu nhiên là (1), (2), (3)
- Có 1 loại oleum X trong đó SO3 chiếm 70% theo khối lượng. Tính khối lượng nước cần thêm vào 100 gam oleum trên để thu được dung dịch mới trong đó H2SO4 chiếm 80% theo khối lượng:
- Hòa tan hết m gam kim loại X trong dung dịch HNO3 được sản phẩm khử duy nhất là 0,1 mol NO
- Hòa tan hoàn toàn 2 gam hỗn hợp kim loại A và B có hóa trị không đổi trong hợp chất bằng dung dịch hỗn hợp HNO3 và H2SO4 đặc
- Hòa tan hết 1 lượng S và 0,01 mol Cu2S trong HNO3 đặc nóng sau phản ứng thu được dung dịch chứa 1 chất tan duy nhất và sản phẩm khử là NO2 duy nhất






