Mß╗Øi qu├Į thß║¦y c├┤ v├Ā c├Īc em hß╗Źc sinh tham khß║Żo ─Éß╗ü cŲ░ŲĪng ├┤n tß║Łp HK1 m├┤n H├│a hß╗Źc 10 CTST n─ām 2022-2023 ─æŲ░ß╗Żc HOC247 bi├¬n soß║Īn dŲ░ß╗øi ─æ├óy. Th├┤ng qua t├Āi liß╗ću n├Āy, c├Īc em c├│ thß╗ā kh├Īi qu├Īt hß╗ć thß╗æng kiß║┐n thß╗®c v├Ā r├©n luyß╗ćn k─® n─āng giß║Żi b├Āi tß║Łp ─æß╗ā l├Ām b├Āi thi thß║Łt tß╗æt. Ch├║c c├Īc em hß╗Źc sinh ─æß║Īt kß║┐t quß║Ż cao trong k├¼ thi HK1 sß║»p tß╗øi!
1. T├ōM Tß║«T L├Ø THUYß║ŠT
1.1. Cß║żU Tß║ĀO NGUY├ŖN Tß╗¼
A. TH├ĆNH PHß║”N Cß╗”A NGUY├ŖN Tß╗¼
Th├Ānh phß║¦n cß║źu tß║Īo nguy├¬n tß╗Ł
Nguy├¬n tß╗Ł gß╗ōm:
- Hß║Īt nh├ón chß╗®a proton, neutron
- Vß╗Å nguy├¬n tß╗Ł chß╗®a electron.
Sự tìm ra electron
- Trong nguy├¬n tß╗Ł tß╗ōn tß║Īi mß╗Öt loß║Īi hß║Īt electron (k├Ł hiß╗ću l├Ā e) c├│ khß╗æi lŲ░ß╗Żng v├Ā mang diß╗ćn t├Łch ├óm
+ ─Éiß╗ćn t├Łch: qe = -1,602.10-19 C (coulomb).
=> D├╣ng l├Ām ─æiß╗ćn t├Łch ─æŲĪn vß╗ŗ, ─æiß╗ćn t├Łch cß╗¦a electron ─æŲ░ß╗Żc quy Ų░ß╗øc l├Ā -1.
+ Khß╗æi lŲ░ß╗Żng m = 9,11.10-28g.
Sß╗▒ kh├Īm ph├Ī hß║Īt nh├ón nguy├¬n tß╗Ł
- Nguy├¬n tß╗Ł:
+ C├│ cß║źu tß║Īo rß╗Śng
+ Gß╗ōm hß║Īt nh├ón ß╗¤ trung t├óm v├Ā lß╗øp vß╗Å l├Ā c├Īc electron chuyß╗ān ─æß╗Öng xung quanh hß║Īt nh├ón.
- Nguy├¬n tß╗Ł trung ho├Ā vß╗ü ─æiß╗ćn
sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch ─æŲ░ŲĪng cß╗¦a hß║Īt nh├ón = sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch ├óm cß╗¦a c├Īc electron trong nguy├¬n tß╗Ł.
Cß║źu tß║Īo hß║Īt nh├ón nguy├¬n tß╗Ł
- Hß║Īt nh├ón nguy├¬n tß╗Ł gß╗ōm hai loß║Īi hß║Īt:
+ proton: mang diß╗ćn t├Łch dŲ░ŲĪng (+1)
+ neutron: kh├┤ng mang ─æiß╗ćn.
- Proton v├Ā neutron c├│ khß╗æi lŲ░ß╗Żng gß║¦n bß║▒ng nhau.
K├Łch thŲ░ß╗øc v├Ā khß╗æi lŲ░ß╗Żng nguy├¬n tß╗Ł
Khß╗æi lŲ░ß╗Żng cß╗¦a nguy├¬n tß╗Ł gß║¦n bß║▒ng khß╗æi lŲ░ß╗Żng hß║Īt nh├ón
B. NGUY├ŖN Tß╗É H├ōA Hß╗īC
Hß║Īt nh├ón nguy├¬n tß╗Ł
─Éiß╗ćn t├Łch hß║Īt nh├ón = +Z.
Sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón (Z) = sß╗æ proton (P) = sß╗æ electron (E).
Số khối (A) = số proton (P) + số neutron (N)
Nguy├¬n tß╗æ h├│a hß╗Źc
\(_Z^AX\)
- Mß╗Śi nguy├¬n tß╗æ ho├Ī hß╗Źc c├│ mß╗Öt sß╗æ hiß╗ću nguy├¬n tß╗Ł.
- Nguy├¬n tß╗æ ho├Ī hß╗Źc l├Ā tß║Łp hß╗Żp nhß╗»ng nguy├¬n tß╗Ł c├│ c├╣ng diß╗ćn t├Łch hß║Īt nh├ón.
─Éß╗ōng vß╗ŗ
C├Īc ─æß╗ōng vß╗ŗ cß╗¦a mß╗Öt nguy├¬n tß╗æ ho├Ī hß╗Źc l├Ā nhß╗»ng nguy├¬n tß╗Ł c├│ c├╣ng sß╗æ proton (P), c├╣ng sß╗æ hiß╗ću nguy├¬n tß╗Ł (Z), nhŲ░ng kh├Īc nhau vß╗ü sß╗æ neutron (N).
Nguy├¬n tß╗Ł khß╗æi v├Ā nguy├¬n tß╗Ł khß╗æi trung b├¼nh
- Nguy├¬n tß╗Ł khß╗æi cß╗¦a mß╗Öt nguy├¬n tß╗Ł cho biß║┐t khß╗æi lŲ░ß╗Żng cß╗¦a nguy├¬n tß╗Ł ─æ├│ nß║Ęng gß║źp bao nhi├¬u lß║¦n ─æŲĪn vß╗ŗ khß╗æi lŲ░ß╗Żng nguy├¬n tß╗Ł (1 amu).
- C├┤ng thß╗®c t├Łnh nguy├¬n tß╗Ł khß╗æi trung b├¼nh cß╗¦a nguy├¬n tß╗æ X:
\(\overline {{{\rm{A}}_{\rm{x}}}} = \frac{{{a_1}.{A_1} + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\)
\(\overline {{{\rm{A}}_{\rm{x}}}} \): l├Ā nguy├¬n tß╗Ł khß╗æi trung b├¼nh cß╗¦a X.
Ai l├Ā nguy├¬n tß╗Ł khß╗æi ─æß╗ōng vß╗ŗ thß╗® i.
ai l├Ā tß╗ē lß╗ć % sß╗æ nguy├¬n tß╗Ł ─æß╗ōng vß╗ŗ thß╗® i.
C. Cß║żU TR├ÜC Lß╗ÜP Vß╗Ä ELECTRON Cß╗”A NGUY├ŖN Tß╗¼
Sß╗▒ chuyß╗ān ─æß╗Öng cß╗¦a electron trong nguy├¬n tß╗Ł
- Orbital nguy├¬n tß╗Ł (Atomic Orbital, viß║┐t tß║»t AO) l├Ā khu vß╗▒c kh├┤ng gian xung quanh hß║Īt nh├ón nguy├¬n tß╗Ł m├Ā tß║Īi ─æ├│ x├Īc suß║źt t├¼m thß║źy electron l├Ā lß╗øn nhß║źt (khoß║Żng 90%).
- Mß╗Öt sß╗æ AO thŲ░ß╗Øng gß║Ęp: S, P, d, f.
- C├Īc AO c├│ h├¼nh dß║Īng kh├Īc nhau: AO s c├│ dß║Īng h├¼nh cß║¦u, AO p c├│ dß║Īng h├¼nh sß╗æ t├Īm nß╗Ģi, AO d v├Ā f c├│ h├¼nh dß║Īng phß╗®c tß║Īp.
Lß╗øp v├Ā ph├ón lß╗øp electron
- Trong nguy├¬n tß╗Ł, c├Īc electron ─æŲ░ß╗Żc sß║»p xß║┐p th├Ānh tß╗½ng lß╗øp (k├Ł hiß╗ću K, L, M, N, O, P,Q) tß╗½ gß║¦n ─æß║┐n xa hß║Īt nh├ón, theo thß╗® tß╗▒ tß╗½ lß╗øp n = 1 ─æß║┐n n = 7
- C├Īc electron tr├¬n c├╣ng mß╗Öt lß╗øp c├│ n─āng lŲ░ß╗Żng gß║¦n bß║▒ng nhau.
- Mß╗Śi lß╗øp electron ph├ón chia th├Ānh c├Īc phß║¦n lß╗øp, ─æŲ░ß╗Żc k├Ł hiß╗ću bß║▒ng c├Īc chß╗» c├Īi viß║┐t thŲ░ß╗Øng: s, p, d, f. C├Īc electron thuß╗Öc c├Īc phß║¦n lß╗øp s, p, d v├Ā f ─æŲ░ß╗Żc gß╗Źi tŲ░ŲĪng ß╗®ng l├Ā c├Īc electron s, p, dv├Ā f.
- C├Īc ph├ón lß╗øp s, p, d v├Ā f lß║¦n lŲ░ß╗Żt c├│ c├Īc sß╗æ AO tŲ░ŲĪng ß╗®ng 1, 3, 5 v├Ā 7.
- C├Īc electron tr├¬n c├╣ng mß╗Öt phß║¦n lß╗øp c├│ n─āng lŲ░ß╗Żng bß║▒ng nhau. Vß╗øi 4 lß╗øp ─æß║¦u (1, 2, 3, 4) sß╗æ ph├ón lß╗øp trong mß╗Śi lß╗øp bß║▒ng sß╗æ thß╗® tß╗▒ cß╗¦a lß╗øp ─æ├│.
Cß║źu h├¼nh electron nguy├¬n tß╗Ł
- Nguy├¬n l├Ł vß╗»ng bß╗ün: ß╗× trß║Īng th├Īi cŲĪ bß║Żn, c├Īc electron trong nguy├¬n tß╗Ł chiß║┐m lß║¦n lŲ░ß╗Żt nhß╗»ng orbital c├│ mß╗®c n─āng lŲ░ß╗Żng tß╗½ thß║źp ─æß║┐n cao: Is 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p...
- Nguy├¬n l├Ł Pauli: Mß╗Śi orbital chß╗ē chß╗®a tß╗æi ─æa 2 electron v├Ā c├│ chiß╗üu tß╗▒ quay ngŲ░ß╗Żc nhau.
=> Sß╗æ electron tß╗æi ─æa trong lß╗øp n l├Ā 2n (n < 4).
- Quy tß║»c Hund: Trong c├╣ng mß╗Öt phß║¦n lß╗øn chŲ░a b├Żo ho├Ā, c├Īc electron sß║Į ph├ón bß╗æ v├Āo c├Īc orbital sao cho sß╗æ electron ─æß╗Öc th├ón l├Ā tß╗æi ─æa.
- Cß║źu h├¼nh electron nguy├¬n tß╗Ł phß║Żi ─æŲ░ß╗Żc viß║┐t theo thß╗® tß╗▒ c├Īc lß╗øp electron v├Ā ph├ón lß╗øp trong mß╗Śi lß╗øp. Trong ─æ├│:
+ Sß╗æ thß╗® tß╗▒ lß╗øp electron ─æŲ░ß╗Żc viß║┐t bß║▒ng c├Īc sß╗æ tß╗▒ nhi├¬n (n = 1, 2, 3, ...).
+ Ph├ón lß╗øp ─æŲ░ß╗Żc k├Ł hiß╗ću bß║▒ng c├Īc chß╗» c├Īi thŲ░ß╗Øng s, p, d, f.
+ Sß╗æ electron cß╗¦a tß╗½ng phß║¦n lß╗øn ─æŲ░ß╗Żc ghi bß║▒ng chß╗ē sß╗æ ß╗¤ ph├Ła tr├¬n, b├¬n phß║Żi k├Ł hiß╗ću cß╗¦a ph├ón lß╗øp.
1.2. Bß║óNG TUß║”N HO├ĆN C├üC NGUY├ŖN Tß╗É H├ōA Hß╗īC
A. Cß║żU Tß║ĀO Bß║óNG TUß║”N HO├ĆN C├üC NGUY├ŖN Tß╗É H├ōA Hß╗īC
Nguy├¬n tß║»c sß║»p xß║┐p c├Īc nguy├¬n tß╗æ trong bß║Żng tuß║¦n ho├Ān
- C├Īc nguy├¬n tß╗æ ─æŲ░ß╗Żc xß║┐p theo chiß╗üu t─āng dß║¦n cß╗¦a ─æiß╗ćn t├Łch hß║Īt nh├ón nguy├¬n tß╗Ł.
- C├Īc nguy├¬n tß╗æ c├│ c├╣ng sß╗æ lß╗øp electron trong nguy├¬n tß╗Ł ─æŲ░ß╗Żc xß║┐p c├╣ng mß╗Öt chu k├¼.
- C├Īc nguy├¬n tß╗æ c├│ c├╣ng sß╗æ electron ho├Ī trß╗ŗ trong nguy├¬n tß╗Ł ─æŲ░ß╗Żc xß║┐p c├╣ng mß╗Öt nh├│m, trß╗½ nh├│m VIIIB.
Cß║źu tß║Īo cß╗¦a bß║Żng tuß║¦n ho├Ān
- ├ö nguy├¬n tß╗æ: Sß╗æ thß╗® tß╗▒ cß╗¦a mß╗Öt ├┤ nguy├¬n tß╗æ bß║▒ng sß╗æ hiß╗ću nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ ho├Ī hß╗Źc trong ├┤ ─æ├│.
- Chu kì
+ C├Īc chu k├¼ 1, 2 v├Ā 3 l├Ā c├Īc chu k├¼ nhß╗Å.
+ C├Īc chu k├¼ 4, 5, 6 v├Ā 7 l├Ā c├Īc chu k├¼ lß╗øn.
- Nh├│m: sß╗æ thß╗® tß╗▒ cß╗¦a nh├│m A bß║▒ng sß╗æ electron ß╗¤ lß╗øp ngo├Āi c├╣ng cß╗¦a nguy├¬n tß╗Ł c├Īc nguy├¬n tß╗æ trong nh├│m.
Ph├ón loß║Īi nguy├¬n tß╗æ dß╗▒a theo cß║źu h├¼nh electron v├Ā t├Łnh chß║źt ho├Ī hß╗Źc
- Dß╗▒a v├Āo cß║źu h├¼nh electron: nnguy├¬n tß╗æ s, nguy├¬n tß╗æ C, nguy├¬n tß╗æ d v├Ā nguy├¬n tß╗æ f.
- Dß╗▒a v├Āo t├Łnh chß║źt ho├Ī hß╗Źc: nguy├¬n tß╗æ kim loß║Īi, nguy├¬n tß╗æ phi kim v├Ā nguy├¬n tß╗æ kh├Ł hiß║┐m.
B. XU HŲ»ß╗ÜNG BIß║ŠN ─Éß╗öI TRONG Bß║óNG TUß║”N HO├ĆN
B├Īn k├Łnh nguy├¬n tß╗Ł
- B├Īn k├Łnh nguy├¬n tß╗Ł cß╗¦a c├Īc nguy├¬n tß╗æ nh├│m A c├│ xu huong bi├¬n ─æß╗æi tuß║¦n ho├Ān theo chiß╗üu t─āng cß╗¦a ─æiß╗ćn t├Łch hß║Īt nh├ón:
+ Trong mß╗Öt chu k├¼, tß╗½ tr├Īi sang phß║Żi, b├Īn k├Łnh nguy├¬n tß╗Ł cß╗¦a c├Īc nguy├¬n tß╗æ c├│ xu hŲ░ß╗øng giß║Żm dß║¦n
+ Trong mß╗Öt nh├│m, theo chiß╗üu tß╗½ tr├¬n xuß╗æng dŲ░ß╗øi b├Īn k├Łnh nguy├¬n tß╗Ł c├│ xu hŲ░ß╗øng t─āng.
─Éß╗Ö ├óm ─æiß╗ćn
- ─Éß╗Ö ├óm ─æiß╗ćn cß╗¦a mß╗Öt nguy├¬n tß╗Ł ─æß║Ęc trŲ░ng cho khß║Ż n─āng h├║t electron cß╗¦a nguy├¬n tß╗Ł ─æ├│ khi tß║Īo th├Ānh li├¬n kß║┐t ho├Ī hß╗Źc.
- ─Éß╗Ö ├óm ─æiß╗ćn cß╗¦a nguy├¬n tß╗Ł c├Īc nguy├¬n tß╗æ nh├│m A c├│ xu hŲ░ß╗øng biß║┐n ─æß╗æi tuß║¦n ho├Ān theo chiß╗üu t─āng cß╗¦a ─æiß╗ćn t├Łch hß║Īt nh├ón:
+ Trong mß╗Öt chu k├¼, ─æß╗Ö ├óm diß╗ćn cß╗¦a nguy├¬n tß╗½ c├Īc nguy├¬n tß╗æ c├│ xu hŲ░ß╗øng t─āng dß║¦n.
+ Trong mß╗Öt nh├│m, ─æß╗Ö ├óm ─æiß╗ćn cß╗¦a nguy├¬n tß╗Ł c├Īc nguy├¬n tß╗æ c├│ xu hŲ░ß╗øng giß║Żm dß║¦n.
T├Łnh kim loß║Īi, t├Łnh phi kim
- T├Łnh kim loß║Īi l├Ā t├Łnh chß║źt cß╗¦a mß╗Öt nguy├¬n tß╗æ m├Ā nguy├¬n tß╗Ł dß╗ģ nhŲ░ß╗Øng electron.
- T├Łnh phi kim l├Ā t├Łnh chß║źt cß╗¦a mß╗Öt nguy├¬n tß╗æ m├Ā nguy├¬n tß╗Ł dß╗ģ nhß║Łn electron.
- T├Łnh kim loß║Īi, t├Łnh phi kim cß╗¦a c├Īc nguy├¬n tß╗æ nh├│m A c├│ xu hŲ░ß╗øng biß║┐n ─æß╗Ģi tuß║¦n ho├Ān theo chiß╗üu t─āng cß╗¦a ─æiß╗ćn t├Łch hß║Īt nh├ón:
+ Trong mß╗Öt chu k├¼, t├Łnh kim loß║Īi cß╗¦a c├Īc nguy├¬n tß╗æ giß║Żm dß║¦n, t├Łnh phi kim t─āng dß║¦n.
+ Trong mß╗Öt nh├│m, t├Łnh kim loß║Īi cß╗¦a c├Īc nguy├¬n tß╗æ t─āng dß║¦n, t├Łnh phi kim giß║Żm dß║¦n.
T├Łnh acid - base cß╗¦a oxide v├Ā hydroxide
C. ─Éß╗ŖNH LUß║¼T TUß║”N HO├ĆN
─Éß╗ŗnh luß║Łt tuß║¦n ho├Ān
─Éß╗ŗnh luß║Łt tuß║¦n ho├Ān: T├Łnh chß║źt cß╗¦a c├Īc nguy├¬n tß╗æ v├Ā ─æŲĪn chß║źt, c┼®ng nhŲ░ th├Ānh phß║¦n v├Ā t├Łnh chß║źt cß╗¦a c├Īc hß╗Żp chß║źt tß║Īo n├¬n tß╗½ c├Īc nguy├¬n tß╗æ ─æ├│ biß║┐n ─æß╗Ģi tuß║¦n ho├Ān theo chiß╗üu t─āng cß╗¦a ─æiß╗ćn t├Łch hß║Īt nh├ón nguy├¬n tß╗Ł.
├Ø ngh─®a cß╗¦a bß║Żng tuß║¦n ho├Ān c├Īc nguy├¬n tß╗æ h├│a hß╗Źc
Biß║┐t vß╗ŗ tr├Ł cß╗¦a mß╗Öt nguy├¬n tß╗æ trong bß║Żng tuß║¦n ho├Ān ŌåÆ cß║źu tß║Īo nguy├¬n tß╗Ł cß╗¦a nguy├¬n tß╗æ ─æ├│ v├Ā ngŲ░ß╗Żc lß║Īi ŌåÆ biß║┐t nhß╗»ng t├Łnh chß║źt ho├Ī hß╗Źc cŲĪ bß║Żn cß╗¦a n├│.
1.3. LI├ŖN Kß║ŠT H├ōA Hß╗īC
A. QUY TẮC OCTET
Quy tß║»c Octet (b├Īt tß╗Ł): Trong qu├Ī tr├¼nh h├¼nh th├Ānh li├¬n kß║┐t ho├Ī hß╗Źc, nguy├¬n tß╗Ł cß╗¦a c├Īc nguy├¬n tß╗æ nh├│m A c├│ xu hŲ░ß╗øng tß║Īo th├Ānh lß╗øp vß╗Å ngo├Āi c├╣ng c├│ 8 electron tŲ░ŲĪng ß╗®ng vß╗øi kh├Ł hiß║┐m gß║¦n nhß║źt (hoß║Ęc 2 electron vß╗øi kh├Ł hiß║┐m helium).
B. LI├ŖN Kß║ŠT ION
- Li├¬n kß║┐t ion l├Ā li├¬n kß║┐t ─æŲ░ß╗Żc h├¼nh th├Ānh bß╗¤i lß╗▒c h├║t t─®nh ─æiß╗ćn giß╗»a c├Īc ion mang ─æiß╗ćn t├Łch tr├Īi dß║źu.
- Li├¬n kß║┐t ion thŲ░ß╗Øng ─æŲ░ß╗Żc h├¼nh th├Ānh khi kim loß║Īi ─æiß╗ān h├¼nh t├Īc dß╗źng vß╗øi phi kim ─æiß╗ān h├¼nh.
- Trong ─æiß╗üu kiß╗ćn thŲ░ß╗¤ng, c├Īc hß╗Żp chß║źt ion thŲ░ß╗Øng tß╗ōn tß║Īi ß╗¤ trß║Īng th├Īi rß║»n, kh├│ n├│ng chß║Ży, kh├│ bay hŲĪi v├Ā kh├┤ng dß║½n ─æiß╗ćn ß╗¤ trß║Īng th├Īi rß║»n. Hß╗Żp chß║źt ion thŲ░ß╗Øng dß╗ģ tan trong nŲ░ß╗øc, tß║Īo th├Ānh dung dß╗ŗch c├│ khß║Ż n─āng dß║½n ─æiß╗ćn.
C. LI├ŖN Kß║ŠT Cß╗śNG H├ōA TRß╗Ŗ
Li├¬n kß║┐t cß╗Öng h├│a trß╗ŗ
- Li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ l├Ā li├¬n kß║┐t ─æŲ░ß╗Żc h├¼nh th├Ānh giß╗»a hai nguy├¬n tß╗Ł bß║▒ng mß╗Öt hay nhiß╗üu cß║Ęp electron chung
+ Li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ kh├┤ng ph├ón cß╗▒c l├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ trong ─æ├│ cß║Ęp electron chung kh├┤ng lß╗ćch vß╗ü ph├Ła nguy├¬n tß╗Ł n├Āo.
+ Li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ ph├ón cß╗▒c l├Ā li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ trong ─æ├│ cß║Ęp electron chung lß╗ćch vß╗ü ph├Ła nguy├¬n tß╗Ł c├│ ─æß╗Ö ├óm ─æiß╗ćn lß╗øn hŲĪn.
- Li├¬n kß║┐t cho ŌĆō nhß║Łn l├Ā mß╗Öt trŲ░ß╗Øng hß╗Żp ─æß║Ęc biß╗ćt cß╗¦a li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ, trong ─æ├│ cß║Ęp electron chung chß╗ē do mß╗Öt nguy├¬n tß╗Ł ─æ├│ng g├│p.
Ph├ón biß╗ćt c├Īc loß║Īi li├¬n kß║┐t dß╗▒a theo ─æß╗Ö ├óm ─æiß╗ćn
- Dß╗▒a tr├¬n hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn x├Īc ─æß╗ŗnh loß║Īi li├¬n kß║┐t h├│a hß╗Źc:
|
Hiß╗ću ─æß╗Ö ├óm ─æiß╗ćn (Ōłåx) |
Loß║Īi li├¬n kß║┐t |
|
0 Ōēż Ōłåx < 0,4 |
Cß╗Öng h├│a trß╗ŗ kh├┤ng cß╗▒c |
|
0,4 Ōēż Ōłåx < 1,7 |
Cß╗Öng h├│a trß╗ŗ c├│ cß╗▒c |
|
Ōēź 1,7 |
Ion |
Li├¬n kß║┐t \(\sigma \), \(\pi \) v├Ā n─āng lŲ░ß╗Żng li├¬n kß║┐t
- Li├¬n kß║┐t \(\sigma \) l├Ā loß║Īi li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ ─æŲ░ß╗Żc h├¼nh th├Ānh do sß╗▒ xen phß╗¦ trß╗źc cß╗¦a hai orbital. V├╣ng xen phß╗¦ nß║▒m tr├¬n ─æŲ░ß╗Øng nß╗æi t├óm hai nguy├¬n tß╗Ł.
- Li├¬n kß║┐t \(\pi \) l├Ā loß║Īi li├¬n kß║┐t cß╗Öng ho├Ī trß╗ŗ ─æŲ░ß╗Żc h├¼nh th├Ānh do sß╗▒ xen phß╗¦ b├¬n cß╗¦a hai orbital. V├╣ng xen phß╗¦ n─ām hai b├¬n ─æŲ░ß╗Øng nß╗Öi t├óm hai nguy├¬n tß╗Ł.
- N─āng lŲ░ß╗Żng cß╗¦a mß╗Öt li├¬n kß║┐t ho├Ī hß╗Źc l├Ā n─āng lŲ░ß╗Żng cß║¦n thiß║┐t ─æß╗ā ph├Ī vß╗Ī 1 mol li├¬n kß║┐t ─æ├│ ß╗¤ thß╗ā kh├Ł, tß║Īo th├Ānh c├Īc nguy├¬n tß╗Ł ß╗¤ thß╗ā kh├Ł.
- Gi├Ī trß╗ŗ n─āng lŲ░ß╗Żng cß╗¦a mß╗Öt li├¬n kß║┐t ho├Ī hß╗Źc l├Ā thŲ░ß╗øc ─æo ─æß╗Ö bß╗ün li├¬n kß║┐t.
D. LI├ŖN Kß║ŠT HYDROGEN V├Ć TŲ»ŲĀNG T├üC VAN DER WAALS
Liên kết hydrogen
- Li├¬n kß║┐t hydrogen l├Ā mß╗Öt loß║Īi li├¬n kß║┐t yß║┐u, ─æŲ░ß╗Żc h├¼nh th├Īnh giß╗»a nguy├¬n tß╗Ł H (─æ├Ż li├¬n kß║┐t vß╗øi mß╗Öt nguy├¬n tß╗Ł c├│ ─æß╗Ö ├óm ─æiß╗ćn lß╗øn, thŲ░ß╗Øng l├Ā F, O, N) vß╗øi mß╗Öt nguy├¬n tß╗Ł kh├Īc c├│ ─æß╗Ö ├óm ─æiß╗ćn lß╗øn (thŲ░ß╗Øng l├Ā F, O, N) c├▓n cß║Łp electron ho├Ī trß╗ŗ chŲ░a tham gia li├¬n kß║┐t.
- Li├¬n kß║┐t hydrogen l├Ām t─āng nhiß╗ćt ─æß╗Ö n├│ng chß║Ży v├Ā nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a nŲ░ß╗øc.
TŲ░ŲĪng t├Īc Van der Waals
- TŲ░ŲĪng t├Īc van der Waals l├Ā tŲ░ŲĪng t├Īc t─®nh ─æiß╗ćn lŲ░ß╗Īng cß╗▒c ŌĆō lŲ░ß╗Īng cß╗▒c ─æŲ░ß╗Żc h├¼nh th├Ānh giß╗»a c├Īc ph├ón tß╗Ł hay nguy├¬n tß╗Ł.
- TŲ░ŲĪng t├Īc van der Waals l├Ām t─āng nhiß╗ćt ─æß╗Ö n├│ng chß║Ży v├Ā nhiß╗ćt ─æß╗Ö s├┤i cß╗¦a c├Īc chß║źt.
2. B├ĆI Tß║¼P
C├óu 1: Nß╗Öi dung n├Āo dŲ░ß╗øi ─æ├óy thuß╗Öc ─æß╗æi tŲ░ß╗Żng nghi├¬n cß╗®u cß╗¦a H├│a hß╗Źc?
A. Sß╗▒ vß║Łn chuyß╗ān cß╗¦a m├Īu trong hß╗ć tuß║¦n ho├Ān.
B. Cß║źu tß║Īo cß╗¦a chß║źt v├Ā sß╗▒ biß║┐n ─æß╗Ģi cß╗¦a chß║źt.
C. Tß╗æc ─æß╗Ö cß╗¦a ├Īnh s├Īng trong ch├ón kh├┤ng.
D. Sß╗▒ tß╗▒ quay cß╗¦a Tr├Īi ─Éß║źt quanh trß╗źc ri├¬ng.
C├óu 2: Th├┤ng tin n├Āo sau ─æ├óy kh├┤ng ─æ├║ng?
A. Proton mang ─æiß╗ćn t├Łch dŲ░ŲĪng, nß║▒m trong hß║Īt nh├ón.
B. Nguy├¬n tß╗Ł trung h├▓a vß╗ü ─æiß╗ćn.
C. Proton v├Ā electron c├│ khß╗æi lŲ░ß╗Żng gß║¦n bß║▒ng nhau.
D. Nguy├¬n tß╗Ł c├│ cß║źu tr├║c rß╗Śng.
C├óu 3: Mß╗Öt nguy├¬n tß╗Ł ─æŲ░ß╗Żc ─æß║Ęc trŲ░ng cŲĪ bß║Żn bß║▒ng
A. sß╗æ proton v├Ā sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón.
B. sß╗æ proton v├Ā sß╗æ electron.
C. sß╗æ khß╗æi v├Ā sß╗æ neutron.
D. sß╗æ khß╗æi v├Ā sß╗æ ─æŲĪn vß╗ŗ ─æiß╗ćn t├Łch hß║Īt nh├ón.
C├óu 4: Cho nhß╗»ng nguy├¬n tß╗Ł cß╗¦a c├Īc nguy├¬n tß╗æ sau:

Nhß╗»ng nguy├¬n tß╗Ł n├Āo sau ─æ├óy l├Ā ─æß╗ōng vß╗ŗ cß╗¦a nhau?
A. 1 v├Ā 2.
B. 2 v├Ā 3.
C. 1, 2 v├Ā 3.
D. 1, 2, 3 v├Ā 4.
C├óu 5: H├¼nh ß║Żnh dŲ░ß╗øi ─æ├óy l├Ā h├¼nh dß║Īng cß╗¦a loß║Īi orbital nguy├¬n tß╗Ł n├Āo?

A. Orbital s.
B. Orbital p.
C. Orbital d.
D. Orbital f.
C├óu 6: Electron thuß╗Öc lß╗øp n├Āo sau ─æ├óy li├¬n kß║┐t chß║Ęt chß║Į nhß║źt vß╗øi hß║Īt nh├ón?
A. Lß╗øp N.
B. Lß╗øp L.
C. Lß╗øp M.
D. Lß╗øp K.
C├óu 7: Nguy├¬n tß╗Ł nguy├¬n tß╗æ X c├│ 3 lß╗øp electron. Lß╗øp ngo├Āi c├╣ng c├│ 4 electron. Cß║źu h├¼nh electron cß╗¦a X l├Ā
A. [Ne] 3s23p2.
B. [Ne] 3s23d2.
C. [He] 3s23p2.
D. [Ar] 3s23p2.
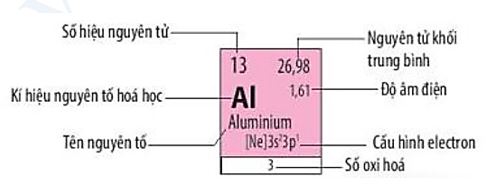
C├óu 8: ß╗× trß║Īng th├Īi cŲĪ bß║Żn, nguy├¬n tß╗Ł aluminium (Al) c├│ sß╗æ electron ─æß╗Öc th├ón l├Ā
A. 1.
B. 2.
C. 3.
D. 4.
C├óu 9: S├┤╠ü hi├¬╠Żu nguy├¬n tŲ░╠ē cu╠ēa nguy├¬n t├┤╠ü ho╠üa ho╠Żc b─ā╠Ćng
A. s├┤╠ü thŲ░╠ü tŲ░╠Ż cu╠ēa ├┤ nguy├¬n t├┤╠ü.
B. s├┤╠ü thŲ░╠ü tŲ░╠Ż cu╠ēa chu ki╠Ć.
C. s├┤╠ü thŲ░╠ü tŲ░╠Ż cu╠ēa nho╠üm.
D. s├┤╠ü electron lŲĪ╠üp ngoa╠Ći cu╠Ćng cu╠ēa nguy├¬n tŲ░╠ē.
C├óu 10: Chu k├¼ 4 cß╗¦a bß║Żng hß╗ć thß╗æng tuß║¦n ho├Ān c├│
A. 2 nguyên tố.
B. 18 nguyên tố.
C. 32 nguyên tố.
D. 8 nguyên tố.
C├óu 11: Trong c├Īc nh├│m A, sß╗▒ biß║┐n thi├¬n t├Łnh chß║źt cß╗¦a c├Īc nguy├¬n tß╗æ thuß╗Öc chu k├¼ sau lß║Īi lß║Ęp lß║Īi giß╗æng nhŲ░ chu k├¼ trŲ░ß╗øc (biß║┐n ─æß╗Ģi tuß║¦n ho├Ān) l├Ā do
A. sß╗▒ lß║Ęp lß║Īi t├Łnh kim loß║Īi cß╗¦a c├Īc nguy├¬n tß╗æ ß╗¤ chu k├¼ sau so vß╗øi chu k├¼ trŲ░ß╗øc.
B. sß╗▒ lß║Ęp lß║Īi t├Łnh phi kim cß╗¦a c├Īc nguy├¬n tß╗æ ß╗¤ chu k├¼ sau so vß╗øi chu k├¼ trŲ░ß╗øc.
C. sß╗▒ lß║Ęp lß║Īi cß║źu h├¼nh electron lß╗øp ngo├Āi c├╣ng cß╗¦a nguy├¬n tß╗Ł c├Īc nguy├¬n tß╗æ ß╗¤ chu k├¼ sau so vß╗øi chu k├¼ trŲ░ß╗øc.
D. sß╗▒ lß║Ęp lß║Īi t├Łnh chß║źt h├│a hß╗Źc cß╗¦a c├Īc nguy├¬n tß╗æ ß╗¤ chu k├¼ sau so vß╗øi chu k├¼ trŲ░ß╗øc.
C├óu 12: Trong mß╗Öt chu k├¼, theo chiß╗üu t─āng cß╗¦a ─æiß╗ćn t├Łch hß║Īt nh├ón, ─æß╗Ö ├óm ─æiß╗ćn thŲ░ß╗Øng
A. giß║Żm xuß╗æng.
B. t─āng dß║¦n.
C. biß║┐n ─æß╗Ģi kh├┤ng theo quy luß║Łt.
D. kh├┤ng thay ─æß╗Ģi.
C├óu 13: Cho c├Īc nguy├¬n tß╗æ O (Z = 8), F (Z = 9), Si (Z = 14), S (Z = 16). Nguy├¬n tß╗æ c├│ t├Łnh phi kim lß╗øn nhß║źt trong sß╗æ c├Īc nguy├¬n tß╗æ tr├¬n l├Ā
A. O.
B. F.
C. S.
D. Si.
C├óu 14: X l├Ā nguy├¬n tß╗æ nh├│m IA. C├┤ng thß╗®c oxide ß╗®ng vß╗øi h├│a trß╗ŗ cao nhß║źt cß╗¦a X l├Ā
A. XO.
B. XO2.
C. X2O.
D. X2O3.
C├óu 15: Nguy├¬n tß╗æ X ß╗¤ chu k├¼ 3, nh├│m IIA cß╗¦a bß║Żng tuß║¦n ho├Ān. Cß║źu h├¼nh electron cß╗¦a nguy├¬n tß╗Ł nguy├¬n tß╗æ X l├Ā
A. 1s┬▓2s┬▓2p6.
B. 1s┬▓2s┬▓2p3s┬▓3p┬╣.
C. 1s┬▓2s┬▓2p3s┬│.
D. 1s┬▓2s┬▓2p63s┬▓.
ĐÁP ÁN
|
1B |
2C |
3D |
4C |
5B |
6D |
7A |
8A |
9A |
10B |
|
11C |
12B |
13B |
14C |
15D |
16A |
17B |
18B |
19D |
20C |
|
21B |
22A |
23B |
24B |
25D |
26D |
27A |
28B |
29B |
30D |
Tr├¬n ─æ├óy l├Ā mß╗Öt phß║¦n tr├Łch ─æoß║Īn nß╗Öi dung ─Éß╗ü cŲ░ŲĪng ├┤n tß║Łp HK1 m├┤n H├│a hß╗Źc 10 CTST n─ām 2022-2023. ─Éß╗ā xem to├Ān bß╗Ö nß╗Öi dung c├Īc em chß╗Źn chß╗®c n─āng xem online hoß║Ęc ─æ─āng nhß║Łp v├Āo trang hoc247.net ─æß╗ā tß║Żi t├Āi liß╗ću vß╗ü m├Īy t├Łnh.
Mß╗Øi c├Īc em tham khß║Żo t├Āi liß╗ću c├│ li├¬n quan:
- ─Éß╗ü cŲ░ŲĪng ├┤n tß║Łp HK1 m├┤n Lß╗ŗch sß╗Ł 10 CTST n─ām hß╗Źc 2022-2023
- ─Éß╗ü cŲ░ŲĪng ├┤n tß║Łp HK1 m├┤n Tiß║┐ng Anh 10 CTST n─ām 2022-2023
Hy vß╗Źng t├Āi liß╗ću n├Āy sß║Į gi├║p c├Īc em hß╗Źc sinh ├┤n tß║Łp tß╗æt v├Ā ─æß║Īt th├Ānh t├Łch cao trong hß╗Źc tß║Łp.
T├Āi liß╗ću li├¬n quan
TŲ░ liß╗ću nß╗Ģi bß║Łt tuß║¦n
- Xem thêm