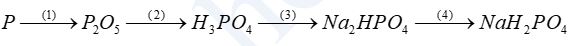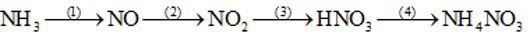Để chuẩn bị cho kì thi học kì 1 sắp tới, HOC247 giới thiệu đến các em tài liệu Bộ 5 đề thi HK1 môn Hóa học 11 có đáp án năm 2022-2023 Trường THPT Đặng Huy Trứ được HOC247 tổng hợp và biên soạn. Hi vọng tài liệu này sẽ giúp các em khái quát được toàn bộ kiến thức quan trọng. Chúc các em học tốt nhé!
1. ĐỀ SỐ 1
I. TRẮC NGHIỆM
Câu 1: Tính dẫn điện của các dung dịch axit, bazơ, muối là do
A. chúng dễ hòa tan trong nước.
B. trong dd chúng phân li ra các ion.
C. sự chuyển dịch của các phân tử hòa tan.
D. chúng ở trạng thài lỏng.
Câu 2: Dung dịch một chất có pH= 8 thì nồng độ mol/lít của ion OH- trong dd là
A. 10-8
B. 8.10-1
C. 8.10-3
D. 10-6
Câu 3: Trường hợp nào sau đây các ion không cùng tồn tại trong một dung dịch?
A. Al3+ , SO42-, Mg2+, Cl-
B. K+, CO32-, SO42-
C. H+, NO3-, SO42-, Mg2+
D. Fe2+, NO3-, S2-, Na+
Câu 4: Cho Fe(III) oxit tác dụng với axit nitric thì sản phẩm thu được là:
A. Fe(NO3)2, NO và H2O
B. Fe(NO3)2, NO2 và H2O
C. Fe(NO3)2, N2
D. Fe(NO3)3 và H2O
Câu 5: Ở điều kiện thường photpho hoạt động hóa học khá hơn nitơ là do
A. Photpho ở trạng thái rắn còn nitơ ở trạng thái khí.
B. Độ âm điện của P nhỏ hơn nitơ.
C. Photpho chỉ có liên kết đơn, còn nitơ có liên kết ba .
D. P có đô âm điện lớn hơn nitơ.
II. TỰ LUẬN
Câu 1. Viết phương trình hóa học
a. Viết phương trình hóa học dưới dạng phân tử và ion rút gọn của phản ứng xảy ra sau: CaCO3 + HCl→
b. Viết phương trình nhiệt phân các muối trong các trường hợp sau: NH4NO3; Ca(NO3)2, MgCO3
c. Lập PTHH các phản ứng sau: C + HNO3 đặc
Câu 2. Hòa tan 21,60 gam hỗn hợp X (gồm Fe và CuO) bằng dung dịch HNO3 dư thu được dung dịch Y và 2,24 lít NO (đktc) là sản phẩm khử duy nhất .
a. Viết phương trình hóa học xảy ra.
b. Xác định thành phần % của các chất trong hỗn hợp đầu hỗn hợp ban đầu ?
---(Để xem đầy đủ nội dung của Đề thi số 01, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 1
I. Trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
B |
D |
D |
D |
C |
B |
B |
A |
D |
D |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
||
|
C |
C |
B |
A |
C |
B |
B |
D |
Câu 1
a.
CaCO3+ 2HCl → CaCl2 + H2O + CO2 ↑
CaCO3+ 2H+ → Ca2+ + H2O + CO2 ↑.
b.
NH4NO3 N2O + 2H2O
Ca(NO3)2 Ca(NO2)2 + O2
MgCO3 MgO + CO2
c. C + 4HNO3đặc CO2 +4NO2 +2H2O
Câu 2
nNO = 0,1 (mol)
a. PTHH: Fe + 4HNO3 Fe(NO3)3 + NO + 2H2O
0,1 0,1 (mol)
CuO + 2HNO3 Cu(NO3)2 + H2O
b. %mFe= 25,93%;
% mCuO= 100- 44, 83=74,07%
2. ĐỀ SỐ 2
I. TRẮC NGHIỆM
Câu 1: Độ dinh dưỡng của phân lân được đánh giá theo tỉ lệ phần trăm về khối lượng của
A. P2O5.
B. nguyên tố P.
C. K2O.
D. N2O5.
Câu 2: Trường hợp nào sau đây khi nhiệt phân tạo ra sản phẩm là oxit kim loại, khí nitơ đioxit và oxi?
A. KNO3, Pb(NO3)2.
B. Fe(NO3)3, AgNO3.
C. Zn(NO3)2, Mg(NO3)2.
D. Pb(NO3)2, Ca(NO3)2.
Câu 3: Silic thể hiện tính oxi hóa trong phản ứng nào sau đây?
A. Si + 2F2 SiF4.
B. Si + O2 SiO2.
C. 2Mg + Si Mg2Si.
D. Si + 2NaOH + H2O Na2SiO3 + 2H2.
Câu 4: Dung dịch HCl 0,01M có pH bằng
A. 2,0.
B. 3,0.
C. 1,0.
D. 4,0.
Câu 5: Trộn 150 dung dịch KOH 1M tác dụng với 50ml dung dịch H3PO4 2M. Sau khi phản ứng hoàn toàn thu được dung dịch T. Muối có trong dung dịch T là
A. KH2PO4 và K2HPO4.
B. KH2PO4 và K3PO4.
C. K2HPO4 và K3PO4.
D. KH2PO4.
II.TỰ LUẬN
Câu 1:
a. Cho các chất H2SO4, NaOH, Fe(OH)3, Na2CO3 hãy xác định chất nào là chất điện ly mạnh, chất nào là chất điện ly yếu ?
b. Tính pH của các dung dịch sau: HNO3 0,01M; Ba(OH)2 0,005M
Câu 2:
a. Cho 4,48 lít CO2 (đktc) tác dụng với dung dịch Ca(OH)2 dư sau phản ứng thu được m gam kết tủa. Tính m?
b. Lấy m gam H3PO4 tác dụng vừa đủ với dung dịch NaOH sau phản ứng chỉ thu được 18 gam NaH2PO4. Tính m?
Câu 3
a. Nhiệt phân 22,56 gam Cu(NO3)2 đến khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Tính m?
b. Cho 2,16 gam Mg tác dụng với dung dịch HNO3 (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít khí NO (ở đktc). Cô cạn cẩn thận dung dịch sau phản ứng thì thu được bao nhiêu gam muối?
---(Để xem đầy đủ nội dung của Đề thi số 02, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 2
I. TRẮC NGHIỆM
|
1 |
2 |
3 |
4 |
5 |
|
A |
C |
C |
A |
A |
|
6 |
7 |
8 |
9 |
10 |
|
B |
D |
B |
A |
A |
|
11 |
12 |
13 |
14 |
15 |
|
D |
C |
C |
D |
B |
Câu 1:
a.
Chất điện ly mạnh gồm: H2SO4, NaOH, Na2CO3
Chất điện ly yếu gồm: Fe(OH)3
b.
HNO3 → H+ + NO3-
0,01M 0,01M
pH = - lg(0,01) = 2
Ba(OH)2 → Ba2+ + 2OH-
0,005M 0,01M
pOH = - lg(0,01) = 2
→ pH = 14-pH = 12
Câu 2:
a.
Số mol CO2 = 0,2 mol
Vì tác dụng với dung dịch Ca(OH)2 dư nên ta có phương trình phản ứng xảy ra
CO2 + Ca(OH)2 → CaCO3 + H2O
0,2 mol 0,2 mol
m = 0,2 . 100 = 20 gam
b.
Số mol NaH2PO4 = 0,15 mol
Vì chỉ tạo muối NaH2PO4 nên ta có phương trình phản ứng xảy ra
NaOH + H3PO4 → NaH2PO4 + H2O
0,15 mol 0,15 mol
m = 0,15 . 98 = 14,7 gam
3. ĐỀ SỐ 3
I. TRẮC NGHIỆM
Câu 1. Dung dịch axit nitric làm giấy quỳ tím
A. không đổi màu.
B. chuyển thành màu xanh.
C. mất màu.
D. chuyển thành màu đỏ.
Câu 2. Dãy nào sau đây gồm các chất điện li?
A. CH4, C2H5OH
B. H2S, SO2
C. NaCl, HCl
D. Cl2, H2SO3
Câu 3. Số oxi hóa của nitơ trong hợp chất NH3 là
A. +3.
B. -3.
C. +1.
D. +5.
Câu 4. Amoni nitrat có công thức hóa học là
A. NH4CO3.
B. NH4NO3.
C. (NH4)2CO3.
D. (NH2)2CO.
Câu 5. Số oxi hoá của cacbon trong CO2 là
A. + 4.
B. 0.
C. + 2.
D. – 4.
II. TỰ LUẬN
Câu 1
a. Xác định nồng độ của ion trong các dung dịch sau: Al2(SO4)3 0,5M; KCl 1,5M
b. Cho các hóa chất NH4NO3, KCl, NaH2PO4, K2CO3 chất nào được dùng làm phân đạm, phân lân, phân kali?
Câu 2:
a. Hoàn thành dãy chuyển hóa sau :
b. Bằng phương pháp hóa học hãy phân biệt các dung dịch mất nhãn sau: KNO3, NH4NO3, Na2SO4, NaCl
---(Để xem đầy đủ nội dung của Đề thi số 03, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 3
I .TRẮC NGHIỆM
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
D |
C |
B |
B |
A |
D |
B |
D |
C |
A |
A |
B |
A |
A |
|
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
C |
B |
B |
C |
B |
D |
D |
A |
B |
B |
B |
B |
B |
C |
Câu 1
a.
Al2(SO4)3 → 2 Al3+ + 3 SO42-
0,5M 1M 1,5M
KCl → K+ + Cl-
1,5M 1,5M 1,5M
b. Phân đạm: NH4NO3
Phân lân: NaH2PO4
Phân kali: KCl, K2CO3
Câu 2:
KNO3, NH4NO3, Na2SO4, NaCl
- Dùng dung dịch NaOH à NH4NO3
- Dùng dung dịch BaCl2 à Na2SO4
- Dùng dung dịch AgNO3 à NaCl
- Còn lại là KNO3
4. ĐỀ SỐ 4
I. TRẮC NGHIỆM
Câu 1 Phân bón nào dưới đây có hàm lượng N cao nhất?
A. NH4Cl
B. NH4NO3
C. Ca(NO3)2
D. (NH2)2CO
Câu 2: Chất điện li mạnh có độ điện li (α)
A. α = 0
B. α = 1
C. 0 < α
D. α > 1
Câu 3: Dung dịch X có [H+] = 5.10-4. Dung dịch X có môi trường
A. axit
B. bazơ
C. trung tính
D. lưỡng tính
Câu 4: Khí N2 tương đối trơ về mặt hóa học ở nhiệt độ thường do nguyên nhân chính là
A. nitơ có bán kính nguyên tử nhỏ.
B. phân tử N2 không phân cực.
C. nitơ có độ âm điện lớn nhất trong nhóm VIA.
D. liên kết trong phân tử N2 là liên kết 3, không phân cực, có năng lượng lớn.
Câu 5: Để nhận biết ion PO43- trong dung dịch muối, người ta dùng thuốc thử là
A. dung dịch AgNO3
B. dung dịch NaOH
C. dung dịch HNO3
D. dung dịch Br2
II. TỰ LUẬN
Câu 1: Trộn 500 ml dung dịch HNO3 0,02M với 500 ml dung dịch NaOH 0,04M thu được dung dịch X. Tính pH của dung dịch X.
Câu 2: Hòa tan hoàn toàn 3,04 gam hỗn hợp X gồm (Fe, Cu) tác dụng hoàn toàn với dung dịch HNO3 loãng dư, sau phản ứng thu được 0,896 lít khí NO (sản phẩm khử duy nhất, ở đktc). Tính khối lượng mỗi kim loại trong hỗn hợp X?
Câu 3: Phản ứng của thuốc nổ đen: 2KNO3 + 3C + S .3CO2 + N2 + K2S; ΔH < 0
Tính phần trăm theo khối lượng các chất trong thuốc nổ đen, biết rằng thuốc nổ đen được trộn theo đúng tỉ lệ phản ứng. Khi đốt 1 kg thuốc nổ đen có thể tạo thành khối khí có thể tích bao nhiêu (ở 2730C và 1 atm).
---(Để xem đầy đủ nội dung của Đề thi số 04, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 4
I. TRẮC NGIỆM
|
1. D |
2. B |
3. A |
4. D |
5. A |
6. B |
7. D |
8. B |
9. A |
10. A |
Câu 1:
nH+ = nHNO3 = 0,02.0,5 = 0,01 mol
nOH- = nNaOH = 0,04.0,5 = 0,02 mol
H+ + OH- → H2O
Bđ: 0,01 0,02 (mol)
Pư: 0,01→0,01 (mol)
Sau: 0 0,01 (mol)
[OH-] = n/V = 0,01/(0,5 + 0,5) = 0,01M
=> pOH = -log[OH-] = -log(0,01) = 2
=> pH = 14 – pOH = 14 – 2 = 12
Vậy pH của dung dịch thu được sau phản ứng là 12.
Câu 2:
\(\begin{array}{l}
\mathop {Fe}\limits^0 - 3e \to \mathop {Fe}\limits^{ + 3} \\
x \to 3x\\
\mathop N\limits^{ + 5} + 2e \to \mathop N\limits^{ + 2} (NO)\\
0,08 \leftarrow 0,04\\
\mathop {Cu}\limits^0 - 2e \to \mathop {Cu}\limits^{ + 2} \\
y \to 2y
\end{array}\)
Khối lượng hỗn hợp: m hh = 56x + 64y = 3,04 (1’)
- Định luật bảo toàn e: 3nFe + 2nCu = 3nNO => 3x + 2y = 3.0,04 (2’)
Giải (1’) và (2’) thu được x = 0,02 mol và y = 0,03 mol
Trong hỗn hợp ban đầu: mFe = 0,02.56 = 1,12 gam và mCu = 0,03.64 = 1,92 gam
5. ĐỀ SỐ 5
I. TRẮC NGHIỆM
Câu 1: Để phân biệt dung dịch Na3PO4 và dung dịch NaNO3 nên dùng thuốc thử nào sau đây?
A. Dung dịch HCl.
B. Dung dịch KOH.
C. Dung dịch AgNO3.
D. Dung dịch H2SO4.
Câu 2: Khí NH3 làm quì tím ẩm chuyển sang màu
A. xanh.
B. đỏ.
C. hồng.
D. tím.
Câu 3: Cho hỗn hợp gồm 0,1 mol CuO và 0,1 mol Cu tác dụng với dung dịch HNO3 đặc nóng, dư thu được V lít khí NO2 (đktc). Giá trị của V là
A. 3,36.
B. 2,24.
C. 4,48.
D. 6,72.
Câu 4: Trong các cặp chất cho dưới đây, cặp nào không xảy ra phản ứng với nhau?
A. HCl, Fe(OH)3.
B. KOH, CaCO3.
C. CuCl2, AgNO3.
D. K2SO4, Ba(NO3)2.
Câu 5: Dung dịch nào sau đây có pH = 7?
A. NaOH.
B. H2SO4.
C. NaCl.
D. HCl.
II. TỰ LUẬN
Câu 1 Cho 100 ml dung dịch HNO3 1,0 M (dung dịch A) vào 100 ml dung dịch KOH 1,0M (dung dịch B).
a) Viết phương trình điện li của HNO3; KOH.
b) Tính pH của dung dịch A và dung dịch B.
c) Tính pH khi trộn lẫn dung dịch A và dung dịch B.
Câu 2 Thực hiện dãy chuyển hoá sau và ghi rõ điều kiện phản ứng nếu có.
Câu 3
a) Vào mùa lạnh người ta thường sử dụng than để sưởi ấm, tuy nhiên có nhiều trường hợp bị ngộ độc dẫn đến tử vong. Chất nào gây nên sự ngộ độc trên? Viết phương trình hóa học tạo thành chất đó trong quá trình sử dụng than để sưởi ấm. Nêu biện pháp tránh bị ngộ độc khi sử dụng than để sưởi ấm.
b) Cho 0,56 lít CO2 (đktc) hấp thụ hoàn toàn vào 400 ml dung dịch Ca(OH)2 0,05M. Tính khối lượng kết tủa thu được.
Câu 4 Cho hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X môt thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là bao nhiêu?
---(Để xem đầy đủ nội dung của Đề thi số 05, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 5
I. TRẮC NGHIỆM
|
1 |
2 |
3 |
4 |
|
C |
A |
C |
B |
|
5 |
6 |
7 |
8 |
|
C |
D |
A |
D |
Câu 1
a) Phương trình điện li của HNO3 và HCl:
HNO3 → H+ + NO3- (1)
KOH → K+ + OH- (2)
b)
Theo (1): nH+ = nHNO3 = 0,1.1 = 0,1 mol
=> pH = -log[H+] = -log(0,1) = 1
Theo (2): nOH- = nKOH = 0,1.1 = 0,1 mol
=> pOH = -log[OH-] = -log(0,1) = 1
=> pH = 14 – pOH = 13
Vậy pH của dung dịch A là 1 và pH của dung dịch B là 13.
c) Khi trộn dung dịch A và dung dịch B với nhau:
H+ + OH- → H2O
Ta thấy: nH+ = nOH- => Phản ứng vừa đủ
=> Dung dịch sau phản ứng có pH = 7
Câu 2
(1) NH3 + O2 ⟶ NO + H2O
(2) 2NO + O2 → 2NO2
(3) 4NO2 + O2 + 2H2O → 4HNO3
(4) HNO3 + NH3 → NH4NO3
Trên đây là một phần trích đoạn nội dung Bộ 5 đề thi HK1 môn Hóa học 11 có đáp án năm 2022-2023 Trường THPT Đặng Huy Trứ. Để xem toàn bộ nội dung các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Mời các em tham khảo tài liệu có liên quan:
- Bộ 5 đề thi HK1 môn Hóa học 11 có đáp án năm 2022-2023 Trường THPT Nguyễn Huệ
- Bộ 5 đề thi HK1 môn Hóa học 11 có đáp án năm 2022-2023 Trường THPT Lý Thường Kiệt
Hy vọng bộ đề thi này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong kì thi sắp tới.