HỌC247 xin giới thiệu đến các em Bộ 5 đề thi HK1 môn Hóa học 11 có đáp án năm 2022-2023 Trường THPT Lý Thường Kiệt bao gồm các kiến thức trọng tâm và câu hỏi ôn tập có đáp án hướng dẫn chi tiết giúp các em ôn tập rèn luyện kĩ năng, củng cố kiến thức, chuẩn bị cho kì thi học kì 1 sắp tới. Chúc các em đạt được kết quả học tập tốt!
1. ĐỀ SỐ 1
I. TRẮC NGHIỆM
Câu 1: Chất nào sau đây thuộc loại chất điện li yếu ?
A. B. H2SO4.
B. C. KOH.
C. CH3COOH.
D. NaCl.
Câu 2: Cho dung dịch KOH đến dư vào 50 ml (NH4)2SO4 1M. Đun nóng nhẹ, thu được thể tích khí thoát ra (đktc) là
A. 1,12 lít
B. 4,48 lít.
C. 0,112 lít.
D. 2,24 lít.
Câu 3: Sục 0,15 mol khí CO2 vào 200 ml dung dịch Ba(OH)2 1M, kết thúc phản ứng thu được các chất
A. Ba(HCO3)2 và Ba(OH)2dư.
B. Ba(HCO3)2.
C. Ba(HCO3)2 và BaCO3.
D. BaCO3, Ba(OH)2dư.
Câu 4: Hòa tan 10,71 gam hỗn hợp gồm Al, Zn, Fe trong 4 lít dung dịch HNO3 a mol/l vừa đủ, thu được dung dịch Y và 1,792 lít (đktc) hỗn hợp khí gồm N2 và N2O có tỉ lệ mol 1:1. Cô cạn dung dịch Y thu được m gam muối khan. Biết Y phản ứng với dung dịch NaOH thì không thấy khí thoát ra. Giá trị m và a lần lượt là
A. 55,35 và 2,20.
B. 53,55 và 2,20.
C. 53,55 và 0,22.
D. 55,35 và 0,22.
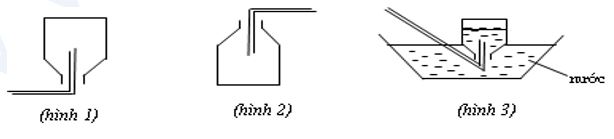
Câu 5: Các hình vẽ sau mô tả các cách thu khí trong phòng thí nghiệm:
Kết luận nào sau đây đúng?
A. Hình 3: Thu khí N2, H2 và HCl.
B. Hình 2: Thu khí CO2, SO2 và NH3.
C. Hình 3: Thu khí N2, H2 và NH3.
D. Hình 1: Thu khí H2, He và NH3.
II. TỰ LUẬN
Câu 1: Trộn lẫn 100 ml dung dịch NaOH 0,01M với 100 ml dung dịch HCl 0,03M được 200 ml dung dịch Y. Dung dịch Y có pH bằng bao nhiêu?
Câu 2: Cho 2,8 gam N2 tác dụng H2 lấy dư. Biết hiệu suất phản ứng đạt 20%. Tính thể tích của NH3 thu được sau phản ứng (đktc)?
Câu 3: Thêm 200 ml dung dịch KOH 1M vào 300 ml dung dịch H3PO4 1M thu được dung dịch X. Tính khối lượng muối trong dung dịch X.
---(Để xem đầy đủ nội dung và đáp án của Đề thi số 01, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 1
I. TRẮC NGHIỆM:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
C |
D |
D |
D |
D |
A |
A |
B |
A |
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
B |
B |
C |
D |
B |
C |
D |
B |
D |
Câu 1
nH+ = nHCl = 3.10-3 (mol) ;
nOH- = nNaOH = 1.10-3 (mol)
[H+]dư = (3.10-3 -1.10-3)/0,2 = 0,01 (M)
®pH=2
Câu 2
nN2 = 0,1 (mol)
\({N_2}(k) + 3{H_2}(k)\mathop \Leftrightarrow \limits^{xt,{t^o}} 2N{H_3}(k)\)
0,1 → 0,2 (mol)
VNH3 = 0,2.22,4.0,2= 0,896 (l)
2. ĐỀ SỐ 2
I. TRẮC NGHIỆM
Câu 1: Hòa tan hoàn toàn 1,2 gam kim loại X vào dung dịch HNO3 dư thu được 0,224 lít khí N2 ở đktc (sản phẩm khử duy nhất). Kim loại X là
A. Al
B. Mg
C. Zn
D. Cu
Câu 2: Hai chất nào sau đây là đồng đẳng của nhau?
A. C2H5OH, CH3OCH3.
B. CH3CH2CH2OH, C2H5OH.
C. CH3OCH3, CH3CHO.
D. C4H10, C6H6.
Câu 3: Trong phòng thí nghiệm có thể điều chế N2 bằng cách
A. phân hủy khí NH3.
B. nhiệt phân NaNO2.
C. thủy phân Mg3N2.
D. Đun hỗn hợp NaNO2 và NH4Cl.
Câu 4: Công thức đơn giản nhất là công thức
A. biểu diễn số lượng nguyên tử của các nguyên tố trong phân tử
B. biểu thị tỉ lệ tối giản các nguyên tử của các nguyên tố trong phân tử
C. biểu thị tỉ lệ tối đa các nguyên tử của các nguyên tố trong phân tử
D. biểu thị tỉ lệ số nguyên tử của các nguyên tố trong phân tử
Câu 5: Cho 44g NaOH vào dung dịch chứa 39,2g H3PO4. Sau khi phản ứng xảy ra hoàn toàn. Hỏi những muối nào thu được và khối lượng muối khan thu được là bao nhiêu ?
A. Na2HPO4 và 14,2g ; Na3PO4 và 49,2g
B. Na3PO4 và 50,0g
C. NaH2PO4 và 49,2g ; Na2HPO4 và 14,2g
D. Na2HPO4 và 15,0g
II. TỰ LUẬN
Một chất hữu cơ X có thành phần khối lượng các nguyên tố là: 54,5% C; 9,1% H; 36,4% O.
a) Tìm công thức đơn giản nhất của X?
b) Biết X có khối lượng phân tử là 88 đvC. Hãy xác định công thức phân tử của X?
---(Để xem đầy đủ nội dung và đáp án của Đề thi số 02, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 2
I. TRẮC NGHIỆM
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
B |
B |
D |
B |
A |
A |
D |
A |
C |
A |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
A |
C |
D |
C |
D |
C |
A |
B |
D |
D |
|
21 |
22 |
23 |
24 |
||||||
|
C |
B |
B |
C |
||||||
a) Giả sử công thức phân tử của X là CxHyOz
Ta có:
\(\begin{array}{*{20}{l}}
{x:y:z = \frac{{{\rm{\% }}{m_C}}}{{12}}:\frac{{{\rm{\% }}{m_H}}}{1}:\frac{{{\rm{\% }}{m_O}}}{{16}}}\\
{{\mkern 1mu} = \frac{{54,5}}{{12}}:\frac{{9,1}}{1}:\frac{{36,4}}{{16}}}\\
{{\mkern 1mu} = 4,54:9,1:2,275}\\
{{\mkern 1mu} = 2:4:1}
\end{array}\)
Vậy công thức đơn giản nhất của X là: C2H4O
b) Công thức phân tử của X có dạng (C2H4O)n
MX = 88 => 44n = 88 => n = 2
Vậy công thức phân tử của X là C4H8O2
3. ĐỀ SỐ 3
I. TRẮC NGHIỆM
Câu 1: Thuốc muối nabica được dùng trong công nghiệp thực phẩm và dùng làm thuốc chữa đau dạ dày. Công thức hóa học của nabica là
A. CaCO3.
B. Na2CO3.
C. NH4HCO3.
D. NaHCO3.
Câu 2: Dung dịch chất nào sau đây ( cùng nồng độ) dẫn điện tốt nhất ?
A. K2SO4 .
B. Al2(SO4)3.
C. NaOH.
D. KNO3.
Câu 3: Công thức của phân urê là
A. (NH2)2CO.
B. (NH2)2CO3.
C. NH4NO3.
D. (NH4)2CO3.
Câu 4: Tính khử của cacbon thể hiện ở phản ứng nào trong các phản ứng sau ?
A. 2C + Ca → CaC2.
B. 3C + 4Al → Al4C3.
C. C + 2H2 → CH4.
D. 3C + 2KClO3 → 2KCl+ 3CO2.
Câu 5: Trong các chất sau, chất nào là chất điện li mạnh?
A. HF.
B. NaCl.
C. H2O.
D. Fe(OH)2.
---(Để xem đầy đủ nội dung và đáp án của Đề thi số 03, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 3
I. TRẮC NGHIỆM
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
D |
B |
A |
D |
B |
A |
A |
D |
C |
A |
B |
B |
C |
D |
C |
B |
A |
D |
A |
C |
B |
Câu 1:
CuCl2 + 2NaOH Cu(OH)2 + 2NaCl
Cu2+ + 2OH- Cu(OH)2
Cu2+ + 2OH- Cu(OH)2
2NH4+ + SO42- + Ba2+ + 2OH- NH3 + BaSO4 + 2H2O
Câu 2:
a.
\({{\rm{n}}_{{\rm{NO}}}}{\rm{ = }}\frac{{{\rm{6,72}}}}{{{\rm{22,4}}}}{\rm{ = 0,3mol}}\)
Al +4HNO3 Al(NO3)3+ NO + 2H2O (1)
Al2O3 + 6HNO3 2Al(NO3)3 + 3H2O (2)
Theo (1),
=> mAl= 0,3x27=8,1 (g)
mAl2O3= 18,3-8,1=10,2 (g)
b) Theo (1 (2) nHNO3 = 4x0,3 + 6x
mHNO3 =1,8x63=113,4g
\({m_{{\rm{dd}}}}_{{\rm{HN}}{{\rm{O}}_{\rm{3}}}}{\rm{ = }}\frac{{{\rm{113,4}}{\rm{.100}}}}{{{\rm{10}}}}{\rm{ = 1134g}}\)
4. ĐỀ SỐ 4
I. TRẮC NGHIỆM
Câu 1. Silic đioxit (SiO2) tan được trong dung dịch của chất nào sau đây?
A. HF.
B. HNO3 đặc.
C. H2SO4 đặc.
D. H3PO4.
Câu 2. Một loại nước thải công nghiệp có pH = 9. Nước thải đó có môi trường
A. bazơ.
B. lưỡng tính.
C. axit.
D. trung tính.
Câu 3. Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, thu được dung dịch Y chứa 8m gam muối và x mol một chất khí duy nhất là N2O. Cho dung dịch NaOH dư vào Y, kết thúc thí nghiệm có 64,6 gam NaOH đã phản ứng. Giá trị của x gần nhất với
A. 0,148.
B. 0,136.
C. 0,122.
D. 0,082.
Câu 4. Khí X không màu, không mùi, rất độc nhưng được dùng trong luyện kim để khử các oxit kim loại. Khí X là
A. CO.
B. H2.
C. CO2.
D. NH3.
Câu 5. Nhỏ từ từ dung dịch HNO3 đến dư vào dung dịch NH4HCO3, hiện tượng xảy ra là
A. xuất hiện kết tủa trắng.
B. thoát ra khí không màu.
C. thoát ra khí mùi khai.
D. có kết tủa và sủi bọt khí.
II. TỰ LUẬN
Câu 1: Bảng dưới đây ghi lại kết quả quan sát khi nhỏ dung dịch Ba(OH)2 vào các ống nghiệm (1), (2), (3), đun nóng đựng một trong các dung dịch NH4NO3, K2CO3, KCl không theo thứ tự.
|
Ống nghiệm |
(1) |
(2) |
(3) |
|
Hiện tượng |
Xuất hiện kết tủa trắng |
Thoát ra khí mùi khai |
Không hiện tượng |
b. Viết phương trình hóa học xảy ra.
Câu 2: Hòa tan hoàn toàn m gam Zn vào dung dịch HNO3 dư, thu được 313,6 ml khí NO2 (đktc, sản phẩm khử duy nhất). Tính giá trị của m. Hòa
Câu 3: Một cái ao dùng để nuôi thủy sản chứa 7000 m3 nước có pH = 4,5. Trước khi nuôi, người ta làm tăng độ pH trong ao lên 7,0 bằng cách hòa m gam vôi sống (ngchất) vào nước trong ao. Tính giá trị m.
---(Để xem đầy đủ nội dung và đáp án của Đề thi số 04, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 4
I. TRẮC NGHIỆM
|
1 |
2 |
3 |
4 |
5 |
|
A |
A |
B |
A |
B |
|
6 |
7 |
8 |
9 |
10 |
|
B |
D |
A |
D |
A |
|
11 |
12 |
13 |
14 |
15 |
|
B |
A |
B |
A |
B |
Câu 1:
a. Ống (1) chứa dung dịch K2CO3, ống (2) chứa dung dịch NH4NO3, ống (3) chứa dung dịch KCl.
b.
K2CO3 + Ba(OH)2 → BaCO3↓ + 2KOH
2NH4NO3 + Ba(OH)2 → 2NH3↑ + 2H2O + Ba(NO3)2
Câu 2:
Số mol của NO2 = 0,3136/22,4 = 0,014 mol
PTHH: Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
0,007 0,014
Tính được số mol Zn = 0,007 mol
mZn = 0,007.65 = 0,455 gam
5. ĐỀ SỐ 5
I. TRẮC NGHIỆM
Câu 1: Khi cho quỳ tím vào dung dịch HCl 0,10M thì quỳ tím đổi sang màu:
A. vàng.
B. xanh.
C. trắng.
D. đỏ.
Câu 2: Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của :
A. N
B. K2O
C. P
D. P2O5
Câu 3: Sục V lít CO2(đkc) vào 100ml dung dịch Ca(OH)2 2M thu được 10 gam kết tủa.V có giá trị là:
A. 2,24 lít hoặc 6,72 lít.
B. 2,24 lít.
C. 6,72 lít.
D. 2,24 lít hoặc 4,48 lít.
Câu 4: Hiđroxit nào sau đây không phải là hiđroxit lưỡng tính:
A. Cr(OH)3.
B. Al(OH)3 .
C. Zn(OH)2.
D. Ba(OH)2.
Câu 5: Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
A. 2,24 lít.
B. 11,2 lít.
C. 4,48 lít.
D. 6,72 lít.
---(Để xem đầy đủ nội dung và đáp án của Đề thi số 05, các em vui lòng xem online hoặc đăng nhập HOC247.NET tải về máy)---
ĐÁP ÁN ĐỀ SỐ 5
I. TRẮC NGHIỆM
|
1 |
2 |
3 |
4 |
5 |
|
D |
D |
A |
D |
C |
|
6 |
7 |
8 |
9 |
10 |
|
A |
C |
D |
B |
A |
|
11 |
12 |
13 |
14 |
15 |
|
B |
B |
B |
A |
C |
|
16 |
17 |
18 |
|
|
|
B |
C |
D |
||
Câu 1
(1) N2 + O2 ⟶2NO
(2) 2NO + O2 → 2NO2
(3) 4NO2 + O2 + 2H2O → 4HNO3
(4) 6HNO3 + Fe2O3 → 2Fe(NO3)3 + 3H2O
Câu 2
nHNO3 bđ = 0,4.0,5 = 0,2 mol
nNO = 1,008/22,4 = 0,045 mol
Đặt nFe = x mol và nCu = y mol
a) Khối lượng của hỗn hợp là 3,32 gam nên ta có: 56x + 64y = 3,32 (1)
Ta có quá trình cho – nhận e:
Fe0 – 3e → Fe+3
x → 3x (mol)
Cu0 – 2e → Cu+2
y → 2y (mol)
N+5 + 3e → N+2
0,135←0,045 (mol)
Theo định luật bảo toàn e ta có: 3x + 2y = 0,135 (2)
Từ (1) và (2) ta có hệ phương trình:
b) BT “N”: nHNO3 sau pư = nHNO3 bđ – 3nFe(NO3)3 – 2nCu(NO3)2 – nNO
= 0,2 – 3.0,025 – 2.0,03 – 0,045 = 0,02 mol
=> CM HNO3 sau pư = n/V = 0,02/0,4 = 0,05 M
Trên đây là một phần trích đoạn nội dung Bộ 5 đề thi HK1 môn Hóa học 11 có đáp án năm 2022-2023 Trường THPT Lý Thường Kiệt. Để xem toàn bộ nội dung các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Mời các em tham khảo tài liệu có liên quan:
- Bộ 5 đề thi HK1 môn Hóa học 11 có đáp án năm 2022-2023 Trường THPT Nguyễn Huệ
- Đề cương ôn tập HK1 môn Hóa học 11 năm học 2022-2023
Hy vọng bộ đề thi này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong kì thi sắp tới.